JMLS 2022 June;7(1):37-44. 10.23005/ksmls.2022.7.1.37 Epub 2022 June 17
Copyright © 2022 by The Korean Society of Marine Life Science
Sexual Group Maturity and Main Spawning Period of Glyptocephalus stelleri (Teleostei: Pleuronectidae)
So Ryung Shin; Department of Aqualife Medicine, Chonnam National University, Yeosu 59626, Korea
Hyeon Jin Kim; Department of Aqualife Medicine, Chonnam National University, Yeosu 59626, Korea
Han Young Oh; Department of Aqualife Medicine, Chonnam National University, Yeosu 59626, Korea
Jung Sick Lee; Department of Aqualife Medicine, Chonnam National University, Yeosu 59626, Korea
Hyejin Song; Dokdo Fisheries Research Center, National Institute of Fisheries Science, Pohang 37709, Korea
Jae Won Kim; Department of Smart Aquaculture, Gangwon State University, Gangneung 24525, Korea
- Abstract
연구는 기름가자미의 성비, 군성숙도 및 주 산란기에 관한 정보를 얻기 위해 수행하였다. 성비 (암:수)는 1:0.54 (n=189:103, 암컷 64.7%)였으며, 전장이 증가함에 따라 암컷의 비율이 높아지는 경향을 보였다. 난모세포 발달패턴은 동일 난소 내에서 여러 단계의 난모세포군이 확인되는 난군동기발달형이었다. 로지스틱 회귀모델에 의해 분석된 50% 성숙 전장은 암, 수 각각 28.51 cm과 30.49 cm였다. GSI는 암, 수 각각 4월과 3월에 가장 높았으며, 주 산란기는 4-5월로 분석되었다.
This study was performed to obtain information on the sex ratio, size at sexual group maturity, and main spawning period of Glyptocephalus stelleri. The sex ratio (female: male) was 1:0.54 (n=189:103, 64.7% female), and the frequency of females in the population tended to increase with total length. The oocyte development pattern was group synchronous development, in which oocyte groups at different stages were identified within the same ovary. The total length at 50% sexual group maturity was analyzed using a logistic regression model, and was determined to be 28.51 (female) and 30.49 cm (male). The gonadosomatic index (GSI) displayed the highest values in April (female) and March (male), and the main spawning period being in April to May.
Keywords: Glyptocephalus stelleri(기름가자미) Sex ratio(성비) Sexual group maturity(군성숙도) Main spawning period(주 산란기)
Correspondence to: Jae Won Kim; Department of Smart Aquaculture, Gangwon State University, Gangneung 24525, Korea; E-mail: kjw01@gw.ac.kr
- Received
- 20 May 2022;
- Revised
- 24 May 2022;
- Accepted
- 30 May 2022.
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Language: Korean/English,
Full Text:

서 론
경골어류의 성비, 생식주기, 주 산란기, 성숙도 및 생식 지배요인과 같은 생식생물학적 정보는 개체군 자원량의 보존 및 양식생물학적 측면에서 매우 중요하다.
기름가자미는 가자미목(Pleuronectiformes) 가자미과(Pleuronec- tidae)에 속하는 측편형 경골어류로 한국 동해, 남해, 일본, 사할린, 동중국해에 분포하며, 수심 40-700 m의 사니질에 광범위하게 서식하는 저서성으로 산란기에는 연안으로 이동하는 생태적 특성을 가진다(Kim et al., 2005). 한국에서 기름가자미는 주로 동해안에서 자망, 연승, 저인망 및 트롤 등의 어업방법으로 어획되며, 동해안 가자미류 생산량의 많은 부분을 차지하는데, 2000년 이후 자원량의 감소 경향을 보이고 있어 자원관리를 위한 수산자원회복사업 대상종으로 선정되어 있다(Shon et al., 2013).
가자미류의 생식과 관련한 국내 연구로는 문치가자미 Limanda yokohamae의 생식주기 및 개체군 동태(Lee et al., 1985), 참가자미 Limanda herzensteini의 연령, 성장 및 성숙(Choi et al., 1986), 생식주기(Chang et al., 2004), 성숙과 산란(Cha et al., 2006), 물가자미 Eopsetta grigorjewi와 문치가자미(An et al., 1999a, b)의 정자형성과정, 용가자미 Cleisthenes pinetorum herzensteine의 성장과 성숙(Choi et al., 1999), 돌가자미 Karejus bicoloratus의 성 성숙(Jun et al., 2003), 기름가자미의 성숙과 산란(Cha et al., 2008), 기름가자미의 성 스테로이드 호르몬 대사물질 분석(Lee and Baek, 2015) 등을 찾아볼 수 있다.
본 연구는 우리나라 동해안에 서식하는 기름가자미의 성비, 성숙체장, 주 산란기 등을 분석하여 이들의 생식생물학적 정보를 제공하고자 하였다.
재료 및 방법
1. 재료
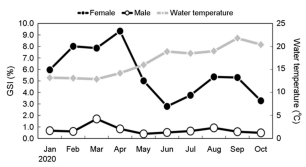
연구에 사용된 기름가자미 Glyptocephalus stelleri는 2020년 1월에서 10월까지 경상북도 감포 근해에서 동해구 중형 외끌이 저인망으로 채집하였다. 전장 29.3 (±4.4) cm, 체중 215.2 (±122.6) g의 292개체를 사용하였다(Fig. 1; Table 1).


2. 방법
2.1. 광학현미경 표본제작
계측형질을 측정한 다음 해부하여 생식소를 적출한 후 10% 중성 포르말린으로 고정 및 수세 후, 파라핀 절편법에 의해 두께 4-6 μm의 연속절편을 제작하였다. 제작된 조직표본은 Mayer's hematoxylin-0.5% eosin (H-E) 이중염색과 Masson 삼중염색을 실시하였다.
2.2. 수온
채집지역의 월별 수온 자료는 국립해양조사원(KHOA, 2020)에서 인용하였다.
2.3. 성비
성비 (암:수)는 다음과 같은 방법으로 계산하였다.
2.4. 생식소중량지수
생식소중량지수(gonadosomatic index, GSI)는 아래의 식으로 계산하였다.
2.5. 생식소 발달단계
생식소 발달단계는 각 발달단계에 속한 생식세포들의 우점 정도에 따라 암, 수 모두 휴지기(resting stage), 성장기(growing stage), 성숙기(mature stage), 완숙기(ripe stage), 방출 및 퇴화기 (spent and degenerative stage)로 구분하였다.
2.6. 성숙체장
연구에서는 로지스틱 모델을 사용하여 50%, 75%, 97.5%의 성숙체장을 추정하였다. 성숙체장은 전장을 2.0 cm 간격으로 구분하여 같은 크기에 속하는 개체 가운데 성숙기 이후의 생식소 조직상을 보이는 개체를 성숙 개체로 판정하여 분석하였다.
결 과
1. 성비
개체의 크기에 따른 성비 (암:수)는 전장이 증가함에 따라 암컷의 비율이 높아지는 경향을 보였다. 전체 292개체 가운데 암컷은 189개체, 수컷은 103개체로 성비는 1:0.54로 암컷의 비율이 높았으며, 암컷의 비율은 64.7%였다(Table 1).
2. 생식소중량지수 (GSI)의 변화
암컷의 GSI는 2월과 3월에서는 각각 8.01, 7.86으로 증가하기 시작하여 4월에 9.34로 조사 기간 중 가장 높았으며 5월에는 5.01로 감소하기 시작하여 6월에 2.79로 가장 낮은 값을 보였다. 수컷의 GSI는 1월과 2월에 증가하기 시작하여 3월에는 1.70으로 가장 높은 값을 나타냈으며, 5월에는 0.40으로 가장 낮은 값을 보였다(Fig. 2).
3. 생식소 발달과 조직상의 변화
3.1. 난소
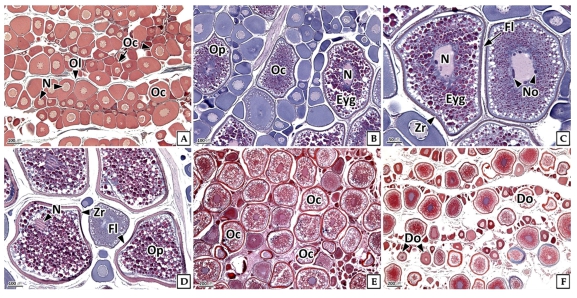
기름가자미의 난모세포 발달패턴은 성장기 및 성숙기 난소 내에서 여러 단계의 난모세포군이 확인되는 난군동기발달형이었다. 휴지기의 난소에서는 주로 난원세포와 난황형성전기의 난모세포들이 관찰되었으며(Fig. 3A), 성장기 난소에서는 난황형성전기의 난모세포와 난황형성개시기의 난모세포들과 일부 난황형성활성기의 난모세포들이 관찰되었다. 난황형성전기의 난모세포는 H-E 염색에서 세포질이 호염기성을 보였다. 난황형성개시기의 난모세포는 인의 수가 증가하였으며, 난황형성활성기에는 여포세포층이 발달하고 세포질의 대부분은 호산성 난황과립으로 채워져 있었다(Fig. 3B, C). 성숙기의 난소에서는 성숙 난모세포들이 주를 이루었는데, 이들은 거치화되고 동물극으로 이동한 핵을 가지며, 잘 발달된 여포세포층과 호산성의 방사대 그리고 세포질의 대부분은 호산성 난황과립들이 차지하고 있었다(Fig. 3D). 완숙기에는 타원형의 불규칙한 형태의 핵을 가지며, 난황과립이 세포질을 가득 채운 완숙 난모세포들이 주를 이루고 있었다(Fig. 3E). 방출 및 퇴화기에는 산란 후 잔존 난모세포의 퇴화 및 흡수가 관찰되었다(Fig. 3F).
3.1. 정소
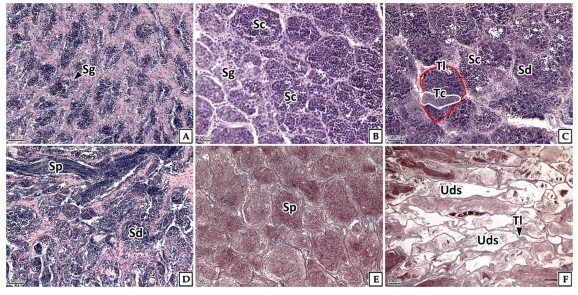
정모세포 발달패턴은 동일한 정소 내에서 각각의 정소 소낭에서 여러 단계의 생식세포군이 동시다발적으로 확인되는 그룹동기발달형이었다. 휴지기의 정소에서는 정소엽에서 유래된 정원세포들이 주로 관찰되었으며, 이들은 핵이 세포의 대부분을 차지하고 있었다(Fig. 4A). 성장기 정소에서는 정원세포에 비해 핵질과 세포질이 응축된 정모세포들이 주로 관찰되었다(Fig. 4B). 성숙기의 정소에서는 확장된 정소 소낭 내에 H-E 염색에서 호염기성으로 반응하는 정세포를 주로 확인할 수 있었으며(Fig. 4C), 완숙기의 정소는 H-E 염색에서 강한 호염기성을 나타내는 정자들로 채워져 있었다(Fig. 4D, E). 방출 및 퇴화기에 정소의 수질부에서는 방정 후 잔존 정자들이 관찰되었으나 피질부에서는 정모세포와 정세포들이 주를 이루고 있었다(Fig. 4F).
4. 생식소 발달단계의 변화
4.1. 난소
1월부터 10월까지 난소 발달단계 출현율은 성숙기 33.7%, 성장기 28.9%, 휴지기 18.7%, 방출 및 퇴화기 11.8%, 완숙기 7.0%로 나타났다(Fig. 5).

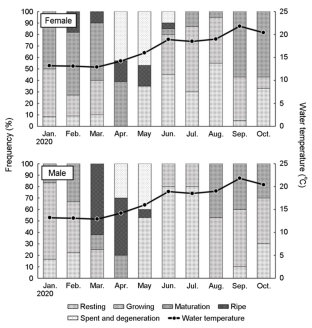
난소 발달단계별 출현율의 월 변화는 1월에는 성장기와 성숙기가 각각 41.7%와 50.0%로 높은 비율을 차지하였고, 2월에는 성숙기와 완숙기가 각각 54.6%, 18.2%로 성숙기의 비율이 증가하였다. 3월에는 성숙기가 50.0%로 우점하였으며, 4월에는 성숙기 39.3%, 완숙기 17.4%, 방출 및 퇴화기 42.9%로 나타났다. 5월에는 휴지기와 방출 및 퇴화기의 비율이 증가하였다. 6월에는 휴지기와 성장기가 각각 45.0%, 35.0%였으며, 7월과 8월에는 성장기의 비율이 약 55.0%로 가장 높았다. 9월에는 성장기 36.8%, 성숙기 57.9%였다(Fig. 6).
4.2. 정소
기름가자미의 연중 정소 발달단계 출현율은 휴지기와 성장기가 각각 30.5%, 성숙기 20.0%, 완숙기 10.5%, 방출 및 퇴화기 8.6%로 나타났다(Fig. 5). 정소 발달단계의 출현율 변화는 1월에는 성장기와 성숙기가 각각 66.7%와 16.7%를 차지하였으며, 2월에는 성장기와 성숙기가 44.4%와 33.3%로 성숙기의 비율이 증가하였다. 3월에는 성숙기 및 완숙기의 비율이 각각 12.5%와 62.5%였으며, 4월에는 성숙기 20.0%, 완숙기 50.0%, 방출 및 퇴화기 30.0%로 나타났다. 5월에는 휴지기 41.7%, 완숙기 8.3%, 방출 및 퇴화기 50.0%로 방출 및 퇴화기의 비율이 증가하였다. 6월과 7월은 휴지기 80.0%, 성장기 20.0%였으며, 8월부터 10월까지는 성장기가 우점하였다(Fig. 6).
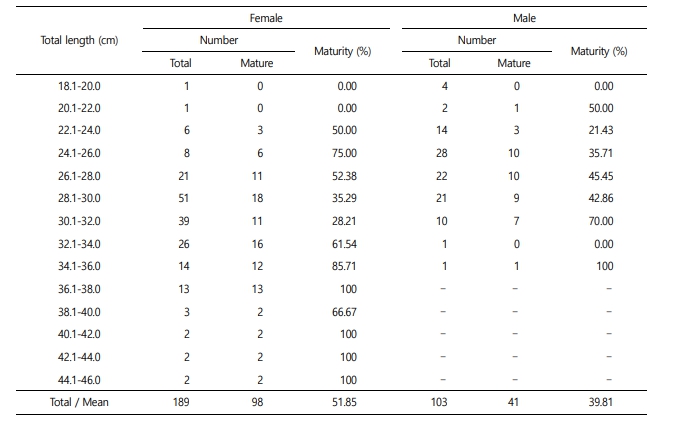
5. 군성숙도
암컷 189개체, 수컷 103개체를 전장 2 cm 구간으로 구분하여 성숙도를 조사한 결과는 Table 2와 같으며, 이를 로지스틱 식에 의해 분석한 결과, 기름가자미 암컷의 50% 성숙 전장은 28.51 cm였으며, 75%, 97.5% 성숙 전장은 각각 34.95 cm, 49.96 cm였다. 수컷의 50% 성숙 전장은 30.49 cm였으며, 75%, 97.5% 성숙 전장은 각각 39.38 cm, 60.12 cm였다(Fig. 7).

고 찰
경골어류의 생식과 관련한 생물학적 지표의 분석에는 형태학, 해부학, 조직학, 분자생물학 등의 다양한 방법들이 사용되고 있다. 특히, 형태학 및 해부학적 방법에 의한 결과 분석은 중대한 오류를 초래할 수 있으며, 조직학적 방법을 이용하여 생식소 발달 및 성숙도를 분석하는 과정과 결과의 해석 과정에서도 많은 오류가 발생하므로 이에 관한 주의가 필요하다(Head et al., 2014, 2016). 따라서 본 연구는 형태학, 해부학 및 조직학적 방법을 함께 사용하였으며, 생식소 발달단계와 성숙도 분석 과정 그리고 결과 해석은 기존의 방법(Wallace and Selman, 1981; Eloryduy-Garay and Ramirez-Luna, 1994; Lee et al., 1998; Lee and Huh, 2000; Martins and Haimovici, 2000; Rajesh, 2015; Head et al., 2016; Rahman and Samat, 2021)들을 정리하여 공통된 내용들을 사용하여 오류를 최소화 하였다.
경골어류의 성비(암:수)는 수정률과 시간 경과에 따른 개체군 크기의 변화에 영향을 주는 중요한 요인 가운데 하나이다. 참가자미 성비는 60.2:39.8로 암컷의 비율이 높다. 크기에 따른 성비는 전장 17 cm 이하에서는 수컷의 비율이 높았으나 체장이 증가할수록 암컷의 비율이 증가하여 27 cm 이상에서는 채집된 모든 개체가 암컷이었다(Cha et al., 2006). Seo et al. (2010)은 문치가자미 Pleuronectes yokohamae의 성비는 1:0.8 (n=519:422)로 암컷의 비율이 높았으며, 크기 별 성비는 전장 25 cm 이하에서는 수컷의 비율이 높고 그 이상에서는 암컷의 비율이 높으며, 전장 32 cm 이상에서는 암컷만 채집된 결과를 보고하였다. 찰가자미 Microstomus achne 97개체를 대상으로 성비를 분석한 결과는 1:1.4 (n=41:56)로 수컷의 비율이 높았다(Byun et al., 2011). 본 연구에서 기름가자미의 전체 성비(암:수)는 1:0.54로 암컷의 비율이 높았으나 전장이 증가함에 따라 암컷의 비율이 높아지는 경향을 보였는데, 전장 약 25 cm 이하 그룹에서는 수컷의 성비가 높았으나 전장 약 25 cm 이상에서는 암컷의 비율이 높았다. Cha et al. (2008)의 연구에서도 기름가자미의 성비는 1:0.9 (n=14,485:13,255)로 암컷의 비율이 높았으며, 전장 30 cm 이상의 수컷은 거의 채집되지 않았는데, 이는 암컷이 수컷보다 성장상태가 좋고 늦게 성숙하며 연령이 더 긴 것으로 추정하였으며, 이와 관련하여 가자미류의 연령과 성장에 관한 연구가 필요하다고 언급하였다.
주둥치 Leiognathus nuchalis (Lee and Huh, 2000)와 Nemipterus furcosus (Rahman and Samat, 2021)를 비롯한 많은 경골어류의 생식소중량지수(GSI)와 생식소 발달단계의 변화는 광주기와 수온 등의 변화패턴과 유사한 계절성을 보인다. 하지만, 기름가자미의 GSI와 생식소 발달단계를 분석한 결과, 수온 등의 환경변화 패턴과는 무관하게 계절성을 보이지는 않았다.
온대지역에 서식하는 어류의 산란형태는 계절에 따라 춘계산란형, 춘하계산란형, 추계산란형, 동계산란형으로 구분된다(Shimizu and Hanyu, 1982, 1983). 우리나라에 서식하는 가자미류의 산란시기는 문치가자미는 12-1월(Lee et al., 1985; Seo et al., 2010), 용가자미는 2-3월(Choi et al., 1999), 돌가자미는 11-1월(Jun et al., 2003), 찰가자미 Microstomus achne (Byun et al., 2011)는 1-2월로 동계산란형으로 구분할 수 있다. 동해안 기름가자미는 3-6월 (Cha et al., 2008)로 보고되었으며, 본 연구에서도 기름가자미의 주 산란기는 4-5월로 춘계산란형으로 구분할 수 있었다. 하지만 동해안 참가자미 Limanda herzensteini의 주 산란기는 Chang et al. (2004)은 1-3월로 보고하였으며, Cha et al. (2006)은 3-4월로 보고하여 다소 차이를 보였다.
경골어류의 난모세포 발달패턴은 산란패턴과 횟수에 관한 중요한 정보를 제공하며, 난소 내에 우점하는 난모세포의 분포 양상에 따라 동기발달형(synchronous type), 난군동기발달형(group synchronous type), 비동기발달형(asynchronous type)으로 구분할 수 있다(Wallace and Selman, 1981). 이 가운데 난군동기발달형은 경골어류에서 주로 볼 수 있는 형태로 Caulolatilus princeps (Eloryduy-Garay and Ramirez-Luna, 1994), 주둥치 (Lee and Huh, 2000), 참서대 Cynoglossus joyneri (Lee et al., 2000), 참가자미 (Chang et al., 2004), Gadus morhua, Melanogrammus aeglefinis, Hippoglossoides platessoides (Murua and Saborido-Rey, 2003)에서 보고되었다. 기름가자미의 난모세포 발달패턴은 난소를 조직학적으로 분석한 결과, 동일 난소 내에서 다양한 그룹의 난모세포들이 확인되는 점으로 보아 난군동기발달형으로 주 산란기에 다회산란 하는 것으로 판단되었다.
수산동물의 주 산란기와 성숙체장에 관한 정보는 생물자원의 보존과 남획 방지 등을 위한 금어기와 어획 금지체장 설정에 매우 중요한 자료로 활용된다. 기름가자미의 GSI와 생식소 발달단계의 월 변화를 분석한 결과, 주 산란기는 GSI가 감소하고 방출기가 나타나는 시기인 4-5월로 판단되었다. 가자미류에서 암컷의 50% 성숙체장은 문치가자미는 전장 19.8 cm (Seo et al., 2010), 용가자미는 24.6 cm (Choi et al., 1999), 참가자미는 17.8 cm (Cha et al., 2006)로 보고되었다. 기존의 연구에서 기름가자미 암컷의 50% 성숙체장은 전장 25.6 cm로 추정되었다(Cha et al., 2008). 하지만 본 연구에서 기름가자미 암컷의 50% 성숙체장은 전장 28.5 cm로 기존의 보고와는 전장 약 3 cm 차이를 보였다. 이러한 차이는 조사 시기의 차이에 따른 결과인지, 난소의 외형적인 평가를 통하여 중숙 이상의 단계를 성숙으로 판정한 기존의 보고와 난소의 조직학적 성숙 기준의 차이에서 온 것인지 명확하지 않다.
- References
-
1. An CM, Lee JS, Huh SH. 1999a. Ultrastructural study on the spermatogenesis of the marbled sole, Limanda yokohamae (Teleostei: Pleuronectidae). Appl Microsc 29: 427-435.
-
2. An CM, Lee JS, Huh SH. 1999b. Spermiogenesis and spermatozoal ultrastructure of the roundnose flounder, Eopsetta grigorjewi (Teleostei: Pleuronectidae). Fish Aquatic Sci 32: 730-736.
-
3. Byun SG, Kim SY, Kim JD, Lee BI, Lee JH, Han KH, Jeong MH. 2011. Sexual maturity and gonadal development of slime flounder, Microstomus achne. Korean J Ichthyol 23: 179-186.
-
4. Cha HK, Kwon HC, Lee SI, Yang JH, Chang DS, Chun YY. 2008. Maturity and spawning of Korean flounder, Glytocephalus stelleri (Schmidt) in the East Sea of Korea. Korean J Ichthyol 20: 263-271.
-
5. Cha HK, Park KY, Lee SI, Park HW, Kwon HC, Choi SH. 2006. Maturity and spawning of brown sole, Pleuronectes herzen- steini (Jordan et Snyder) in the East Sea of Korea. Korean J Ichthyol 18: 363-367.
-
6. Chang YJ, Lee JY, Chang YJ. 2004. Reproductive cycle of the brown sole, Limanda herzensteini in Eastern Waters of Korea. J Aquaculture 17: 128-132.
-
7. Choi SH, Chun YY, Gong YG, Son SJ. 1986. Studies on the age, growth and maturity of the flounder Limanda herzensteini (Jordan et Snyder) in Yong-il Bay of the Eastern Sea of Korea. Bull Fish Res Dev Agency 39: 43-51.
-
8. Choi SH, Hur YH, Chun YY, Zhang CI. 1999. Growth and maturity of pointedhead flounder, Cleithenes pinetorum herzensteini (Schmidt) in the East Sea. J Korean Sco Fish Res 2: 1-13.
-
9. Eloryduy-Garay JF, Ramirez-Luna S. 1994. Gonadal development and spawning of female ocean whitefish, Caulolatilus princeps (Pisces: Branchiostegidae) in the Bay of La Paz, B.C.S., Mexico. J Fish Biol 44: 553-566.
-
10. Head MA, Keller AA, Bradburn M. 2014. Maturity and growth of sablefish, Anoplopoma fimbria, along the U.S. West Coast. Fish Res 159: 56-67.
-
11. Head MA, Stokes GL, Thorson JT, Keller AA. 2016. Techniques for improving estimates of maturity ogives in groundfish using double-reads and measurement error models. Fish Res 179: 251-258.
-
12. Jun JC, Sim DS, Kim YH, Chung EY. 2003. Sexual maturation of the stone flounder, Kareius bicoloratus, on the West Coast of Korea. Korean J Ichthyol 15: 259-271.
-
13. Kim IS, Choi Y, Lee CL, Lee YJ, Kim BJ, Kim JH. 2005. Illustrated book of Korean fishes. Kyohak publishing co., LTD. Seoul, Korea, pp 477.
-
14. KHOA, Korea Hydrographic and Oceanographic Agency, 2020. Ocean data in grid framework. http://www.khoa.go.kr/ oceangrid/khoa/intro.do
-
15. Lee TY, Kang YJ, Lee BD. 1985. Reproduction and population dynamics of marbled sole Limanda yokohamae. 1. Repro- duction. Fish Aquatic Sci 18: 253-261.
-
16. Lee JS, An CM, Huh SH. 1998. Reproductive cycle of the goldeye rockfish, Sebastes thompsoni (Teleostei: Scorpaenidae). Fish Aquatic Sci 31: 8-16.
-
17. Lee JS, Huh SH. 2000. Reproductive biology of the slimy, Leio- gnathus nuchalis (Teleostei: Leiognathidae). Korean J Ichthyol 12: 192-202.
-
18. Lee JS, Kim SY, Ma KH, Huh SH. 2000. Ovarian development and reproductive cycle of the female red tongue sole, Cyno- glossus joyneri (Teleostei: Cynoglossidae). J Kor Fish Soc 33: 554-558.
-
19. Lee HW, Baek HJ. 2015. Steroid metabolism in the blackfin flounder Glyptocephalus stelleri during oocyte maturation. Korean J Fish Aquat Sci 48: 483-488.
-
20. Martins AS, Haimovici M. 2000. Reproduction of the cutlassfish Trichiurus lepturus in the southern Brazil subtropical con- vergence ecosystem. Sci Mar 64: 97-105.
-
21. Murua H, Saborido-Rey F. 2003. Female reproductive strategies of marine fish species of the North Atlantic. J Northw Atl Fish Sci 33: 23-31.
-
22. Rahman MM, Samat AF. 2021. Reproductive cycle, sexual maturity and fecundity of Nemipterus furcosus (Valenciennes, 1830). Aquac Fish 6: 424-431.
-
23. Rajesh KM. 2015. Fishery, reproductive biology and stock status of the largehead hairtail Trichiurus lepturus Linnaeus, 1758 off Karnataka, south-west coast of India. Indian J Fish 62: 28-34.
-
24. Seo YI, Joo H, Lee SK, Kim H, Ko JC, Choi MS, Kim JI, Oh TY. 2010. Maturity and spawning of marbled sole Pleuronectes yokohamae in the Southern Sea of Korea. Korean J Ichthyol 22: 83-89.
-
25. Shimizu A, Hanyu I. 1982. Environmental regulation of annual reproductive cycle in a spring-spawning bitterling Acheilo- gnathus tabira. Bull Jap Soc Sci Fish 48: 1563-1568.
-
26. Shimizu A, Hanyu I. 1983. Environmental regulation of spawning-period in an autumn-spawning bitterling Pseudoperilampus typus. Bull Jap Soc Sci Fish 49: 895-900.
-
27. Sohn MH, Yang JH, Park JH, Lee H, Choi YM, Lee JB. 2013. Stock assessment and optimal catch of blackfin flounder Glypto- cephalus stelleri in the East Sea, Korea. Kor J Fish Aquat Sci 46: 598-606.
-
28. Wallace RA, Selmen K. 1981. Cellular and dynamic aspects of oocyte growth in teleosts. Amer Zoo 21: 325-343.












