JMLS 2022 December;7(2):213-220. 10.23005/ksmls.2022.7.2.213 Epub 2022 December 14
Copyright © 2022 by The Korean Society of Marine Life Science
A Study on Survival and Growth of whiteleg shrimp (Litopenaeus vannamei) according to Water Temperature and Rearing Density in Low Salinity Conditions
Chul Won Kim; Department of Aquaculture, Korea National College of Agriculture and Fisheries, Jeollabuk-do 54874, Korea
Han Seung Kang; MS BioLab, Daejeon 34576, Korea
- Abstract
본 연구는 저염분 상태에서 수온 및 사육밀도와 같은 환경요인이 흰다리새우(Litopenaeus vannamei)의 성장에 미치는 영향을 조사하기 위하여 수행하였다. 연구 결과, 흰다리새우는 저염분 상태에서 전반적으로 수온이 높을수록 생존율이 높게 나타났고, 사육밀도가 낮을수록 생존율이 높아졌다. 사료효율에 관한 연구에서는 수온이 높을수록 증체량(WG)이 증가하였고, 사육밀도가 증가할수록 증체량은 감소하였다. 수온이 높을수록(수온 31℃) 성장 속도가 빨랐다. 또한 사육밀도에 따른 성장도의 평가에서도 사육밀도가 낮은 상태에서 성장 속도가 빨라지는 것을 확인하였다. 본 연구 결과를 흰다리새우의 최적 성장을 위한 적정 사육밀도 및 사육수온의 결정에 유용하게 적용되리라 사료된다.
This study was conducted to investigate the effect of environmental factors such as water temperature and rearing density on the survival and growth of Litopenaeus vannamei under low salinity conditions. Overall, in the higher water temperature, the higher survival rate comes out and in the lower rearing density, the higher the survival rate does. In a study on feed efficiency, weight gain (WG) increased significantly as water temperature increased, and weight gain according to rearing density significantly decreased as rearing density increased. The growth rate of L. vannamei was faster when the water temperature was higher (water temperature 31℃) under low salinity conditions. In addition, in the evaluation of the growth rate according to the rearing density, it was confirmed that the growth rate was accelerated at a low rearinging density. It is believed that the results of this study will be usefully applied to the determination of the optimal rearinging density and breeding water temperature of L. vannamei in low salinity condition.
Keywords: Litopenaeus vannamei(흰다리새우) Low salinity(저염분) Water temperature (수온) Rearingking density(사육밀도) Growth(성장)
Correspondence to: Han Seung Kang; MS BioLab, Daejeon 34576, Korea
- Received
- 1 December 2022;
- Revised
- 1 December 2022;
- Accepted
- 7 December 2022.
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Language: Korean/English,
Full Text:

서 론
해양생물에 있어서 수온 및 염분 등의 해양환경은 생리대사와 서식분포에 영향을 주는 중요한 요인이다. 수온은 성 성숙, 유생 발생 및 성장과 관련해 중요한 요인으로 알려져 있다(Logue et al., 1995). 해양생물은 수온변화에 매우 민감하게 반응하는 것으로 알려져 있는데 특히 대사 및 에너지균형에 영향을 미친다고 알려져 있다(Newell and Kofoed, 1977; Loomis et al., 1995; Chapple et al., 1998). 해양에서 염분 농도는 대략 33~34 psu를 표준 염분 농도로 하며, 해양생물에게 생태학적으로 중요한 환경요인인 수온과 더불어 생태적 내성 및 분포를 결정하는 중요한 요인이다(Dame, 1996). 염분의 변화는 해양생물의 성장에 있어 직접적인 영향을 미치며(Beckmann et al., 1990; Boeuf and Payan, 2001), 급격한 염분변화는 해양생물에 스트레스 요인으로 작용하여 항상성을 유지하기 위하여 체내 삼투, 체액 농도 조절 및 산소 소비와 같은 대사활동에 관여하며, 염분의 변화 폭이 크면 생물체는 적응을 못하는 상황에 도래하여 폐사하게 된다고 알려져 있다(Hammond, 1983; Weirich and Tomasso, 1991; Marshall, 2002; Matthews and Fairweather, 2004).
흰다리새우(Litopenaeus vannamei)는 광염성 종으로 1~40 psu의 염분 범위에서 생존이 가능하여 지역의 제한을 받지 않고 양식이 가능한 생물로 알려져 있다(Abdelrahman et al., 2019). 광염성의 생리학적 특성을 가지고 있는 흰다리새우는 현재 가장 선호하는 새우 양식품종 대상이다. 국내 전통적인 새우 양식품종인 보리새우 및 대하 양식의 경우 흰반점병(white spot disease, WSD)과 같은 양식산 새우에게 발생하는 바이러스성 질병 내성에 대한 문제점으로 인해 현재는 거의 이루어지고 있지 않고 있는 상태이다(Jang and Jun, 2005). 흰반점병(WSD)에 의한 새우양식의 피해를 줄이고자 WSD에 내성이 강한 흰다리새우를 2003년부터 이식하여 양식품종으로 대체하면서 새우 생산량은 증가하였다(Jang et al., 2008a). 흰다리새우 양식 생산량은 2020년 기준 8,100톤이며, 생산 금액으로는 국내 양식품종 중 6위를 차지하고 있어 국내 주요 양식품종으로 자리매김하고 있다(NIFS, 2018; MOF, 2021; Lee et al., 2022). 흰다리새우가 양식새우품종으로서의 장점은 WSD에 강한 내성뿐만 아니라 다른 새우품종과 비교하여 빠른 성장, 낮은 사료 단백질 요구량, 낮은 공식률, 높은 환경내성 및 SPF (Specific Pathogen Free) 생산이 가능한 장점이 있다(Lotz, 1997; Briggs et al., 2004; FAO, 2006; Lightner et al., 2009). 그러나 흰다리새우의 일반 해수의 염분 농도 이하에서도 사육을 통한 양식이 가능한 이점이 있지만, 저염분 조건에서 체내 건강도 및 스트레스에 영향을 미칠 수 있다. 이전 연구에서 저염분 조건은 흰다리새우의 사육 초기 저염분 순치 과정에서 생존율이 감소하여 생산성의 차이를 보인다는 보고가 있다(McGraw et al., 2002; McGraw and Scarpa, 2003, 2004). 또한 낮은 염분 농도에서 오랜 기간 사육 시 체내 이온 균형의 변화에 의해 성장과 생존에 영향을 미치는 것으로 알려져 있다(Roy et al., 2007; Castillo-Soriano et al., 2010). 흰다리새우는 생존율, 사료효율 향상 및 생산량 증대의 효과를 얻기 위해 중간육성이라는 단계를 거치는 것이 일반화 되어 있다(Jang et al., 2008a). 중간육성은 사육공간 및 경제적 측면을 고려하여 고밀도 사육을 실시하는 경향이 있다(Jang et al., 2008b). 해양생물의 사육에 있어서 고밀도의 사육은 한계 수용치를 벗어나면 스트레스를 유도하여 생존과 성장에 나쁜 영향을 미치는 것으로 알려져 있다(Kim, 2006; Min and Shin, 2010; Kim and Yi, 2017).
흰다리새우는 고수온 및 저염분에 강한 것으로 알려져 있으며 효소활성과 수온, 염분도, 용존산소 등과 같은 물리적 요인에 대한 연구는 다수 진행되었으나(Kim et al., 2017), 저염분(10 psu 이하)의 조건에서 수온의 변화 및 사육밀도에 따른 성장에 관한 연구는 거의 이루어진 바가 없다. 따라서 본 연구는 최근 내륙에서 해수가 아닌 담수로 흰다리새우를 양식하는 어가가 늘어남에 따라 저염분 조건에서 수온과 사육밀도가 흰다리새우의 생존 및 성장에 미치는 영향을 조사하고자 한다.
재료 및 방법
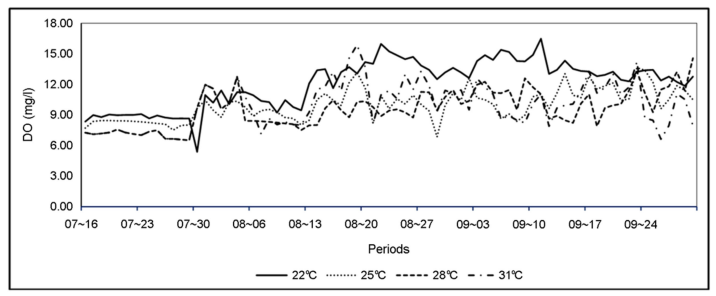
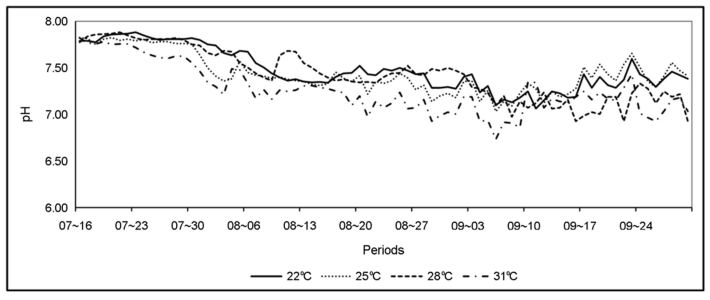
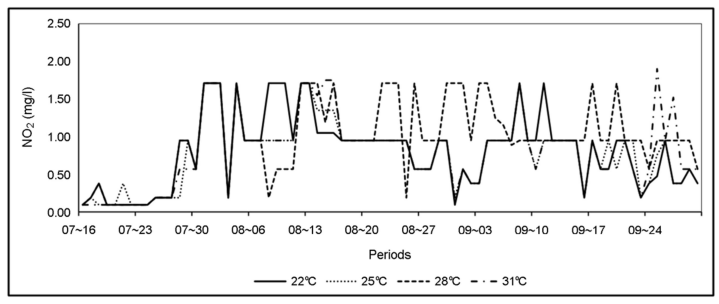
본 실험은 한국농수산대학교 수산생물사육동에서 수행되었으며, 실험수조는 지름이 1.8 m, 수심은 1 m(용량 약 2.5 ton)의 PP 재질의 원형 수조 4개를 사용하였다(Fig. 1). 저염분 조건(2.0~4.0 psu)에서 수온 실험구는 22℃, 25℃, 28℃ 그리고 31℃로 구분하였으며, 2 kw 티타늄 전기히터를 사용하여 수온을 유지시켰다. 그리고 저염분 조건(2.0~4.0 psu) 사육밀도 실험구는 수온실험구와 같은 크기의 수조에서 200개체/m2, 300개체/m2, 400개체/m2, 600개체/ m2로 구분하여 실험하였다. 사육밀도는 일반 어가에서 70~100개체/m2로 양식하고 있으나 본 실험에서는 고밀도로 실험구를 설정하여 생존율 및 성장에 미치는 영향을 조사하였다. 수질환경은 용존산소(DO), 수소이온농도(pH), 암모니아(NH4) 및 아질산(NO2)을 자동측정센서에 의하여 30분 단위로 실시간 수집하여 나타내었다(Fig. 2, 3, 4, 5). DO는 모든 실험구에서 6.0~15.0 mg/l의 범위로 나타났으며, pH는 모든 실험구에서 7.0~8.0 범위로 매우 안정적으로 나타났다. NH4 농도는 모든 실험구에서 0.2~2.0 mg/l의 범위로 나타났고, NO2 농도는 모든 실험구에서 0.2~1.2 mg/l의 범위로 나타났다.
실험에 사용된 흰다리새우 치하는 평균 크기가 2.45±0.33 mm였고, 평균 중량은 0.18±0.03 g으로 중간육성된 개체를 사용하였으며 총 74일간 사육하였다. 저염분 조건은 흰다리새우 환경내성 등의 자료를 근거로 2.0~4.0 psu 조건으로 설정하였으며, 사료는 시중에서 판매되는 배합사료를 사용하였으며 성장단계에 사료 크기와 사료공급량을 조절하였고 각 수조의 실험개체가 만복이 될 때까지 1일 4회 공급하였다. 성장 측정은 1주 간격으로 각 수조에서 30개체를 채집하여 전장과 무게를 측정하였으며 실험종료 시 생존율을 조사하였다. 통계처리는 Two-way ANOVA와 Duncan's multiple range test로 실험구간의 유의성(p< 0.05)을 검정하였다.


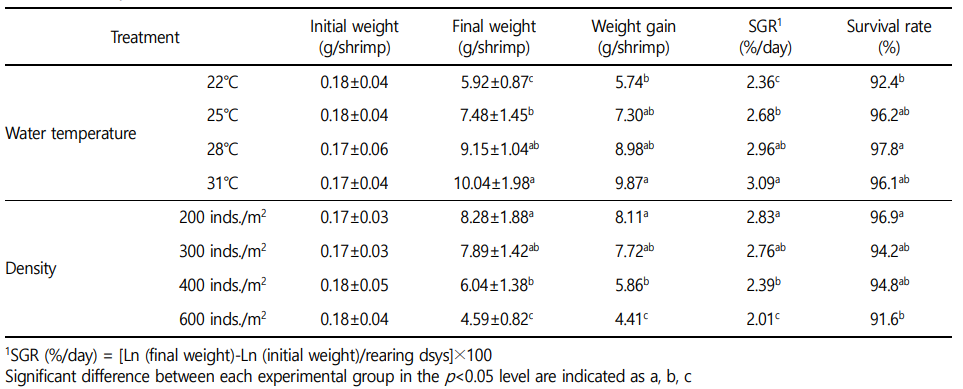
결과 및 고찰
본 연구는 흰다리새우 치하를 대상으로 염분 농도에 따른 생존율, 성장 및 사료효율 등을 분석하였다. 연구 결과 수온에 따른 생존율은 22℃, 25℃, 28℃ 및 31℃에서 각각 92.4%, 96.2%, 97.8% 및 96.1%로 유의적인 차이를 보였다. 28℃ 수온에서 97.8%의 가장 높은 생존율을 보여주었고, 전반적으로 수온이 높을수록 생존율은 높아지는 경향을 보였다(Table 1). 사육밀도에 따른 생존율은 200개체/m2 실험구에서 96.9%, 300개체/m2 실험구에서 94.2%, 400개체/m2 실험구에서 94.8%, 600개체/m2 실험구에서 91.6%로 유의적인 차이를 보였다. 200개체/m2 실험구에서 96.9%의 가장 높은 생존율을 보여주었고, 전반적으로 사육밀도가 낮을수록 생존율은 높아지는 경향을 보였다(Table 1). 성장 및 사료효율에 관한 연구 결과로는 다음과 같다. 증중율(weight gain, WG)은 수온의 증가에 따라 유의적인 증가를 나타냈다. 수온 22℃에서 5.74 g, 25℃에서 7.30 g, 28℃에서 8.98 g 및 31℃에서 9.87 g로 나타났다(Table 1). 사육밀도에 따른 중증율은 사육밀도가 높아짐에 따라 유의적인 감소를 나타냈다. 사육밀도 200개체/m2 실험구에서 8.11 g, 300개체/m2 실험구에서 7.72 g, 400개체/m2 실험구에서 5.86 g, 600개체/m2 실험구에서 4.41 g으로 유의적인 차이를 보였다(Table 1). 수온에 따른 일간성장률(specific growth rate, SGR)은 22℃, 25℃, 28℃ 및 31℃에서 각각 2.36%, 2.68%, 2.96% 및 3.09%로 수온이 높을수록 유의적인 증가를 보였다(Table 1). 사육밀도에 따른 일간성장률은 200개체/m2 실험구에서 2.83%, 300개체/m2 실험구에서 2.76%, 400개체/m2 실험구에서 2.39%, 600개체/m2 실험구에서 2.01%로 사육밀도가 높을수록 일간성장률은 유의적으로 낮아지는 경향을 보였다(Table 1).
저염분 조건에서 수온의 차이에 따른 흰다리새우의 성장은 수온이 높을수록 흰다리새우의 성장이 빠른 것으로 나타났다. 실험종료 시 전장은 7.09~10.3 cm의 범위로 성장하였으며 수온 31℃에서 평균 10.3 cm로 가장 빨리 성장하였으며, 수온 22℃에서는 7.09 cm로 성장 속도가 가장 느렸다. 수온 25℃ 및 28℃에서는 각각 7.89 cm 및 9.28 cm로 성장하였다(Fig. 6). 무게 성장은 약 5.92~10.04 g의 범위로 나타났으며 수온 31℃에서 10.04 g으로 가장 높았고, 수온 22℃에서는 5.92 g으로 가장 낮았다. 수온 25℃에서는 7.48 g 및 28℃에서는 9.15 g으로 무게 성장이 나타났다(Fig. 6).
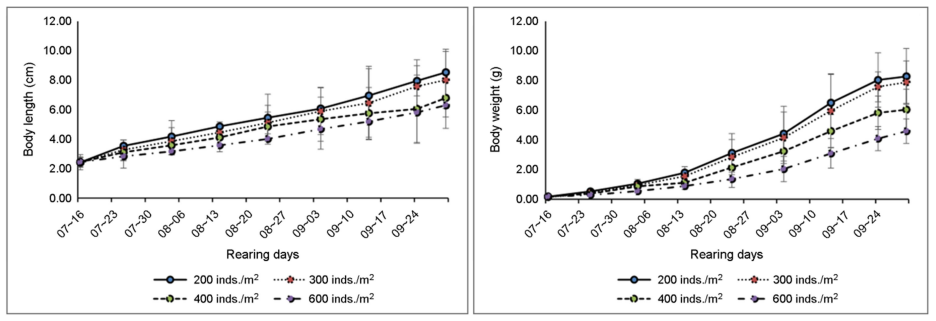
저염분 조건에서 사육밀도에 따른 흰다리새우의 성장은 사육밀도가 낮을수록 성장이 좋은 것으로 나타났다(Fig. 7). 실험종료 후, 사육밀도별 흰다리새우 개체의 전장은 200개체/m2 실험구에서 평균 8.53 cm, 300개체/m2 실험구에서 평균 8.01 cm, 400개체/m2 실험구에서 평균 6.79 cm, 600개체/m2 실험구에서 6.29 cm로 나타났다. 초기 10일간의 전장을 살펴보면 200개체/m2 실험구에서 평균 3.54 cm, 300개체/m2 실험구에서 평균 3.27 cm, 400개체/m2 실험구에서 평균 3.10 cm, 600개체/m2 실험구에서 2.83 cm로 나타나 사육밀도에 따른 전장의 차이는 초기부터 나타나기 시작하였음을 보여준다(Fig. 7). 사육밀도별 흰다리새우 개체의 무게는 실험종료 시, 200개체/m2 실험구에서 평균 8.28 g, 300개체/m2 실험구에서 평균 7.89 g, 400개체/m2 실험구에서 평균 6.04 g, 600개체/m2 실험구에서 4.59 g으로 나타났다. 초기 10일간의 무게를 살펴보면 200개체/m2 실험구에서 평균 0.53 g, 300개체/m2 실험구에서 평균 0.44 g, 400개체/m2 실험구에서 평균 0.38 g, 600개체/m2 실험구에서 0.29 g으로 나타나, 사육밀도에 따른 무게의 차이는 초기부터 나타나기 시작하였음을 보여준다(Fig. 7).
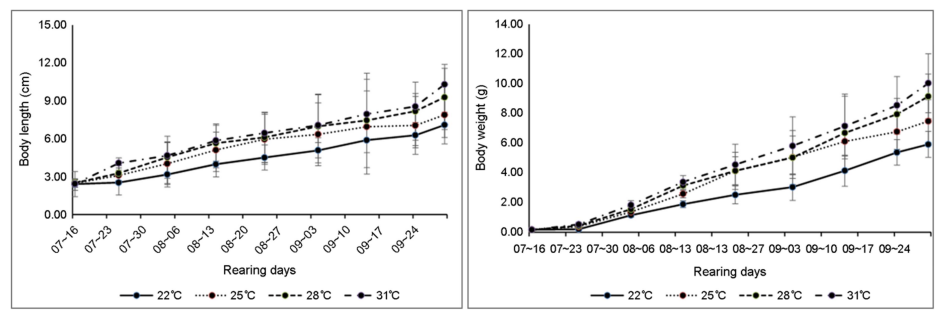
성장률은 새우 양식장의 경제적 성과를 결정짓는 중요한 요소이며, 수온은 새우의 성장을 조절하는 중요한 환경요인이다(Boyd and Pine, 2010). 흰다리새우는 사육온도가 26℃에서 33℃ (Wickins and Lee, 2008) 염분 농도는 0.5 psu에서 45 psu 정도(Lester and Pante, 1992)의 범위에서 서식할 수 있다고 한다. 이러한 염분 농도와 수온의 범위에서 수온은 성장과 매우 밀접한 관계가 있다. 일반적으로 수생생물은 수온이 상승함에 따라 성장 속도도 증가한다는 보고가 있다(Talbot, 1993). 새우의 성장에 있어서도 수온, 수질, 용존산소, 먹이 및 사육밀도 등이 중요한 요인으로 작용하지만 특히 수온과 용존산소 농도의 증가는 생리적 과정의 속도를 높여 성장을 증가시킨다는 보고가 있다(Brett, 1979; Buentello et al., 2000). 흰다리새우의 성장에 관여하는 최적의 수온은 개체 크기에 따라 달라서 작은 새우의 경우 30℃ 이상이고, 큰 새우의 경우는 27℃ 정도이며, 더 이상의 수온 상승은 성장에 나쁜 영향을 미친다는 보고가 있다(Brett, 1979; Wyban et al., 1995). 또한 수온이 23℃ 미만일 경우에는 개체 크기에 상관없이 모든 크기의 새우에 악영향을 미치며, 30℃를 초과할 경우에는 크기가 큰 새우의 경우 사료 소비 및 성장이 감소한다는 보고가 있다(Wyban et al., 1995). 적정 수온의 범위를 벗어나서 서식할 경우 갑각류 등은 면역반응이 억제되어 생산력이 떨어진다는 보고도 있다(Wickins and Lee, 2008). 본 연구의 결과 수온이 높을수록 전장 및 무게 등의 성장도가 증가하는 양상은 앞선 연구 결과와 비교하여 일치한다는 생각이다.
사육밀도에 따른 새우의 생산력은 밀도에 따라 생산력이 증가한다는 보고와 반대로 감소한다는 보고 등이 있었다. 본 연구에서는 사육밀도에 따라 비교적 긴 시간 동안 연구를 통해 사육밀도에 반비례하는 성장도를 관찰하였다. 이와 같은 연구의 결과는 다른 해양생물에서도 고밀도가 개체에게 스트레스를 준다는 결과를 뒷받침 할 수 있다고 판단된다. Esparza-Leal 등 (2010)은 흰다리 새우를 대상으로 사육밀도에 따른 성장도의 관찰에서 사육밀도가 낮은 수조에서 서식하는 흰다리새우의 개체가 성장이 빠르다는 결과를 보여주었다.
저염분과 수온 및 사육밀도에 따른 국내에서 사육하는 흰다리새우 성장과의 관련 연구는 아주 미미한 상태이다. 본 연구 결과를 통해 저염분 조건 흰다리새우의 양식에서 적정 사육밀도 및 사육 수온의 결정에 유용하게 적용되리라 사료된다.
- References
-
1. Abdelrahman HA, Abebe A, Boyd CE. 2019. Influence of variation in water temperature on survival, growth and yield of Pacific white shrimp Litopenaeus vannamei in inland ponds for low-salinity culture. Aquaculture Research 50: 658-672.
-
2. Beckmann RP, Mizzen LE, Welch WJ. 1990. Interaction of HSP70 with newly synthesized proteins: implications for protein folding and assembly. Science 248: 850-854.
-
3. Boeuf G, Payan P. 2001. How should salinity influence fish growth? Comp Biochem Physiol Part C 130: 411-423.
-
4. Boyd CE, Pine H. 2010. Application of agrometeorology to aqua- culture and fisheries. In: Guide to Agricultural Meteorological Practices (GAMP), Chapter 13. (pp 1-25). Geneva, Switzerland: World Meteorological Organization.
-
-
6. Briggs M, Funge-Smith S, Subasinghe R, Phillips M. 2004. Intro- ductions and movement of Penaeus vannamei and Penaeus stylirostris in Asia and the Pacific. RAP publication 2004/ 10. FAO Regional Office for Asia and the Pacific, Bangkok, Thailand, 1-92.
-
7. Buentello JA, Gatlin DM III, Neill WH. 2000. Effects of water tem- perature and dissolved oxygen on daily feed consumption, feed utilization and growth of channel catfish (Ictalurus punctatus). Aquaculture 182: 339-352.
-
8. Castillo-Soriano FA, Ibarra-Junquera VA, Olivos-Ortiz FJ, Barragán-Vázquez FJ, Meyer-Willerer AO. 2010. Influence of water supply chemistry on white shrimp (Litopenaeus vannamei) culture in low-salinity and zero-water exchange ponds. Panam J Aquat Sci 5: 376-386.
-
9. Chapple JP, Smerdon GR, Berry RJ, Hawkins AJS. 1998. Seasonal changes in stress-70 protein levels reflect thermal tolerance in the marine bivalve Mytilus edulis L. J Exp Mar Biol Ecol 229: 53-68.
-
10. Dame RF. 1996. Ecology of marine bivalves: An ecosystem approach. pp 254. CRC marine science series. CRC Press, Boca Raton.
-
11. Esparza-Leal HM, Ponce-Parafox JT, Valenzuera-Quinonez W, Arredondo-Figueroa JL, Mahuel Garcia-Ulloa Gomez. 2010. Effects of density on growth and survival of juvenile pacific white shrimp, Penaeus vannamei, reared in low salinity well water. Journal of The World Aquaculture Society 41: 648-654.
-
12. FAO. 2006. State of world aquaculture 2006. FAO technical report, Food and Agriculture Organisation of the United Nations, Fishery Resources Division, Rome, Italy, 1-134.
-
13. Hammond LS. 1983. Experimental studies of salinity tolerance, burrowing behavior and pedicle regeneration in Lingula anatina (Brachiopoda, Inarticulata). Journal of Paleontology 57: 1311-1316.
-
14. Jang IK, Jun JC. 2005. Current status of shrimp diseases and its control in Korea. In: The first Korea-U.S. Seminar and Work- shop on the Sustainable Marine Shrimp culture: Challenges and Opportunities for the Future of Marine Shrimp Farming. August 8-12, 2002. West Sea Fisheries Research Institute, Incheon, Republic of Korea, 1-54.
-
15. Jang IK, Gopalakannan A, Suriakala K, Kim JS, Kim BR, Cho YR, Meng XH, Seo HC. 2008a. Real-time PCR Quantification of White Spot Syndrome Virus (WSSV) and Hepatopancreatic Parvovirus (HPV) Loads in Shrimp and Seawaters of Shrimp Ponds on the West Coast of South Korea. Fisheries and Aquatic Sciences 11: 195-204.
-
16. Jang IK, Kim JS, Cho KJ, Seo HC, Cho YR, Gopalakannan A, Kim BL. 2008b. Intensive culture of the pacific white shrimp Lito- penaeus vannamei under limited water exchange Ⅰ. Indoor nursery culture of postlarvae. J Aquaculture 21: 339-345.
-
17. Kim TY. 2006. Studies on the artificial seedling production of the hard clam (Röding). Ph.D. thesis, Pukyong National University, pp 114.
-
18. Kim CW, Yi SW. 2017. Effect of Water Temperature, Rearing Density, Salinity, and Food Organisms on The Growth and Survival Rate in Early Juvenile Hard Shelled Mussel, Mytilus coruscus. Korean J Environ Biol 35: 152-159.
-
19. Kim SK, Shim NY, Jang JW, Jun JC, Kim S, Shin YK. 2017. Effect of acclimation methods on physiological status of white shrimp, Litopenaeus vannamei larvae to low salinities. Korean J Environ Biol 35: 6-12.
-
20. Lee A, Kong K, Kim H, Oh M, Kim D, Kim J, Kim W. 2022. The complete genome sequence of a white spot syndrome virus isolated from Litopenaeus vannamei. J Fish Pathol 35: 129-133.
-
21. Lester L, Pante MJ. 1992. Penaeid temperature and salinity re- sponses. Developments in Aquaculture and Fisheries Science 23: 515-534.
-
22. Lightner DV, Redman RM, Arce SM, Moss SM. 2009. Specific pathogen free shrimp stocks in shrimp farming facilities as a novel method for disease control in crustaceans. In: Shumway SE, Rodrick GE. (Eds.), Shellfish Safety and Quality. CRC Press, Woodhead Publishing Limited, Cambridge, England, pp 384-424.
-
23. Logue J, Tiku P, Cossins AR. 1995. Heat injury and resistance adaptation in fish. J Therm Biol 20: 191-197.
-
24. Loomis SH, Ansell AD, Gibson RN, Barnes M. 1995. Freezing tolerance of marine invertebrates. Oceanogr Mar Biol Annu Rev 33: 337-350.
-
25. Lotz JM. 1997. Disease control and pathogen status assurance in an SPF-based shrimp aquaculture industry, with particular reference to the United States. In: Flegel TW, MacRae IH. (Eds.), Diseases in Asian Aquaculture III, Fish Health Section, Manila, the Philippines, Asian Fisheries, Society, pp 243-254.
-
26. McGraw WJ, Davis DA, Teichert-Coddington D, Rouse DB. 2002. Acclimation of Litopenaeus vannamei postlarvae to low salinity: Influence of Age, Salinity endpoint, and rate of salinity reduction. J World Aquac Soc 33: 78-84.
-
27. McGraw WJ, Scarpa J. 2003. Minimum Environmental potassium for survival of Pacific white shrimp Litopenaeus vannamei (Boone) in freshwater. J of Shellfish Res 22: 263-267.
-
28. McGraw WJ, Scarpa J. 2004. Mortality of freshwater-acclimated Litopenaeus vannamei associated with acclimation rate, habituation period, and ionic challenge. Aquaculture 236: 285-296.
-
29. Marshall WS. 2002. Na+, Cl-, Ca2+ and Zn2+ transport by fish gills: retrospective review and prospective synthesis. J Exp Zool 293: 264-283.
-
30. Matthews YTG, Fairweather PG. 2004. Effect of lowered salinity on the survival, condition and reburial of Soletellina alba (Lamarch, 1818) (Bivalvia: Psammobiidae). Austral Ecology 29: 250-257.
-
31. Ministry of oceans and fisheries (MOF): Survey on the current status of the seafood production and distribution industry in 2020. 2021.
-
32. Min BH, Shin HJ. 2010. Effects of Rearing Condition and Species of Microalgae on Growth and Survival of Larvae of the Sunray Surf Clam, Mactra chinensis. Korean J Malacol 26: 303-310.
-
33. National institute of fisheries science (NIFS). Standard manual of whiteleg shrimp culture. 2018.
-
34. Newell RC, Kofoed LH. 1977. Adjustment of the components of energy balance in the gastropod Crepidula fornicate in response to thermal acclimation. Mar Biol 44: 275-286
-
35. Roy LA, Davis DA, Saoud IP, Henry RP. 2007. Effects of varying levels of aqueous potassium and magnesium on survival, growth and respiration of the Pacific white shrimp, Lito- penaeus vannamei, reared in low salinity waters. Aquaculture 262: 461-469.
-
36. Talbot C. 1993. Some aspects of the biology of feeding and growth in fish. Proceedings of the Nutrition Society 52: 403-416.
-
37. Weirich CR, Tomasso JR. 1991. Confinement and transport induced stress on red drum juveniles: effect of salinity. Prog Fish Cult 53: 146-149.
-
38. Wickins JF, Lee DOC. 2008. Crustacean farming: Ranching and culture (2nd ed.). Ames, Iowa, USA: Blackwell Science.
-
39. Wyban J, Walsh WA, Godin DM. 1995. Temperature effects on growth, feeding rate and feed conversion of the Pacific white shrimp (Penaeus vannamei). Aquaculture 138: 267-279.












