JMLS 2022 December;7(2):205-212. 10.23005/ksmls.2022.7.2.205 Epub 2022 December 14
Copyright © 2022 by The Korean Society of Marine Life Science
Effect of Water Temperature, Salinity and Anaesthetic of Olive Flounder (Paralichthys olivaceus) to Live Transportation
Yong Hyun Do; Southeast Sea Fisheries Research Institute, NIFS, Tongyeong 53085, Korea
Jae-Hye Song; Southeast Sea Fisheries Research Institute, NIFS, Tongyeong 53085, Korea
Si-Woo Lee; Southeast Sea Fisheries Research Institute, NIFS, Tongyeong 53085, Korea
Jung Yeol Park; Department of Aquaculture and Aquatic Science, Kunsan National University, Gunsan 54150, Korea
Jun Wook Hur; Department of Aquaculture and Aquatic Science, Kunsan National University, Gunsan 54150, Korea
- Abstract
수송은 양식어류의 양식과정에서 필수적으로 수행되며, 선별과 같은 물리적인 스트레스 요인 중 하나이다. 이러한 이유로 본 연구에서는 해산어류인 넙치를 이용하여 수송 시 염분, 수온 및 마취제의 영향을 확인하기 위해 수송 시 해수 염분(35‰, 15‰)과 수온은 20℃ (natural water temperature, NWT), 15℃ (cooling water temperature, CWT)로 설정하였으며 마취제(anesthesia, Anes., Sigma USA)는 50 ppm 희석하여 염분, 수온, 마취제 요인들을 혼합한 실험구를 설정하였다. 실험구는 각각 NWT+35‰, CWT+ 35‰, NWT+15‰, CWT+15‰, NWT+15‰+Anes. 및 CWT+15‰+Anes.으로 설정하였다. 스티로폼 상자(66×42×20 cm)를 수송용기로 사용하였으며, 해수 3 ℓ와 액화산소를 주입한 비닐봉지에 넙치 8마리씩 수용하여 수송하였다. 연구 결과 수송 전 코티졸 농도는 2.4±0.1 ng ml-1로부터 CWT+35‰ 구(16.7±12.8 ng ml-1)를 제외한 나머지 실험구에서 유의하게 높아졌다. K+ 농도는 수송 전 3.1±0.0 mEq l-1로부터 NWT+15‰ 구에서 4.5±1.1 mEq l-1로 차이를 보이지 않았으나, 나머지 실험구에서는 모두 유의하게 높은 값을 보였다. 혈액성상의 변화에는 영향을 미치지 않았으며, 수온과 마취제는 스트레스를 유발로 인한 삼투압조절에 부정적인 영향을 미쳤다. AST, ALT에는 영향을 미치지 않았다.
Transport is essential in the farming process of farmed fish and is one of the physical stress factors such as sorting. The effect of water temperature and anesthesia during low salinity transport was confirmed. In the experimental group, the water temperature was set to 20℃ (natural water temperature, NWT), 15℃ (cooling water temperature, CWT) respectively, in water with a salinity concentration of 35‰, 15‰ and an anesthetic (anesthesia, Anes., Sigma USA) was diluted and mixed to 50 ppm. A styrofoam box (66×42×20 cm) was used as a transport container, and 8 flounder were accommodated and transported in a plastic bag injected with 3 ℓ of seawater and liquid oxygen. As a result of the study, the concentration of cortisol before transport increased significantly from 2.4±0.1 ng ml-1 in the experimental groups except for the CWT+35‰ group (16.7±12.8 ng ml-1). The K+ concentration slightly increased from 3.1±0.0 mEq l-1 before transport to 4.5±1.1 mEq l-1 in the NWT+15‰ group, showing no difference, and significantly increased in all other experimental groups. There was no effect on changes in blood characteristics, and water temperature and anesthetic had a negative effect on osmotic control due to stress. AST and ALT were not affected.
Keywords: Olive flounder Paralichthys olivaceus(넙치) Water temperature(수온) Salinity (염분) Anaesthetic(마취제) Live transportation(활어수송)
Correspondence to: Jun Wook Hur; Department of Aquaculture and Aquatic Science, Kunsan National University, Gunsan 54150, Korea
- Received
- 25 November 2022;
- Revised
- 28 November 2022;
- Accepted
- 1 December 2022.
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Language: Korean/English,
Full Text:

서 론
양식과정 중 사육어류들은 한 시설(수조)에서 다른 시설로 또는 상품어를 운송(수송)을 필수적으로 해야 한다. 수송은 어류에 스트레스를 유발하는 것으로 알려져 있으며 카테콜아민과 코르티코스테로이드의 방출은 물론 혈액 내 글루코스 수치 증가와 같은 다양한 생리적 반응을 유발한다(Barton, 2011; Pankhurst, 2011). 어류의 수송 후에는 혈장 코티졸, 글루코스, 전해질 및 삼투질 농도뿐만 아니라, 적혈구 수, 헤마토크리트, 헤모글로빈, 총 단백질, 혈액의 pH 및 근육지방 등이 변화하는 것으로 알려지고 있다(Hur et al., 2003). Carmichael (1984)은 수송 후 어류가 스트레스 충격으로 높은 사망률을 나타낼 수 있다고 하였으며, 국외의 대부분 연구들은 주로 연어류에 중심이 되어, 염분, 수온, 밀도, 수송시간 및 수송 전후 스트레스 조건 등에 관한 단독 또는 복합적인 스트레스에 대하여 보고하고 있다(Tacchi et al., 2015; Omeji et al., 2017).
국내에서의 운송과정 중 스트레스 요인 별 연구로는 염분, 수온, 밀도 및 수송시간에 관한 것이 있으며, 아울러 이들의 복합적인 스트레스에 대하여 연구된 바 있다(Hur et al., 2003; Hur et al., 2019a; Hur et al., 2019b). 그러나 국내에서는 운송과정에 의한 어류의 생리적 변화의 연구 결과가 많이 부족한 상황이며, 각 요인들에 대한 스트레스를 확인 했을 뿐 스트레스를 완화 시킬 수 있는 연구가 필요한 실정이다.
생명체가 스트레스 요인에 접하게 되면, 체내 호르몬의 분비로 스트레스 반응을 일으킨다. 그러므로 생활자체가 항상성 유지를 위한 스트레스 반응이므로 호르몬의 분비 및 감소가 지속된다(Hur et al., 2008). 어류의 항상성 유지를 위한 스트레스 지표 호르몬으로는 코티졸(cortisol)이 있으며, 안정 시 혈중 농도는 매우 낮지만 급박한 스트레스를 받게 되면 그 농도는 순식간에 수십 배로 증가한다(Hur et al., 2008). 코티졸은 당질대사에 관여하는 스테로이드성 호르몬으로서, 단백질로부터 당의 생성을 촉진하고 지질대사에도 영향을 미친다. 그 작용은 간장에서 당신생(gluconeo- genesis), 글리코겐 저장의 촉진 및 혈당 상승 등이 있다(Barton and Iwama, 1991). 일반적으로 어류가 스트레스를 받게 되면 체내 항상성 유지를 위한 코티졸 호르몬이 분비되나, 스트레스의 강도가 높거나 반복적으로 받게 되면, 어류는 항상성 유지 능력을 상실하여 생리적 장애, 번식과정의 혼란, 질병에 대한 저항성 감소가 나타나게 되고 최종적으로 사망에 이르게 된다(Barton and Iwama, 1991). 어류에서 스트레스 자극은 코티졸의 분비를 통해 당신생 효소의 활성을 촉진시켜 글루코스(glucose)의 분비량이 증가한다. Barton and Iwama (1991)는 스트레스 자극에 의한 내분비적 현상을 스트레스의 1차반응(코티졸의 증가)에 따른 2차반응(글루코스의 증가)의 결과라고 정의하였다. 이러한 이유로 스트레스 연구에서 어류의 혈액 내 호르몬(코티졸) 수치 변화로 스트레스를 확인하는데 보편적으로 활용되고 있다. 또한, 국내 · 외에서 스트레스에 의한 호르몬 수치 변화는 주로 해산어(양식어종)를 중심으로 연구가 진행되었다(Chang et al., 2002; Lankford et al., 2003; Davis, 2004; Hur et al., 2008). 특히 어류 수송 시에는 밀폐된 공간과 한정적인 수송수 및 산소, 그리고 지속적인 진동과 소음에 의해 스트레스를 받게 된다. 하지만 수송 시 스트레스에 의한 호르몬 수치 변화에 대한 연구는 적은 편이기 때문에 여러 수송 상황에서의 호르몬 변화를 확인할 필요가 있다.
따라서 본 연구는 광염성으로 알려진 넙치를 이용하였으며, 염분, 수온 변화 및 마취제 혼합을 이용하여 넙치의 체내대사 활동 및 삼투압조절 완화를 통해 스트레스로 인한 항상성을 유지할 수 이게 해줄 것으로 판단되어 본 실험을 실시하였다.
재료 및 방법
1. 수송 전 실험어 관리와 수송방법
실험어로 사용하기 위하여 육상수조 양식장에서 사육 중인 넙치를 구입하였다. 실험어는 콘크리트 수조 2개(18 ton)에 수용하여 상업용 터봇사료(수분 10%, 조단백질 56%, 조지방 12%, 조섬유 1.7%, 회분 12%, 인 1.9%, 비타민 A 10,000 IU kg-1, 비타민 D3 1,750 IU kg-1, 비타민 E 200 mg kg-1, 비타민 C 250 mg kg-1, France)을 공급하면서 3주간 안정시킨 다음 실험에 사용하였다. 광주기는 형광등에 자동타이머가 설치하여 12L:12D 조건으로 유지되었고, 수온은 22℃에서 24℃ 범위로 자연수온에 의존하였다. 사료공급은 1일 2회(오전 10:00, 오후 16:00) 공급하였다.
실험어류의 평균길이는 21.26±1.8 cm, 평균무게는 97.4±19.1 g이었다. 실험수조(FRP 원형, 500 ℓ, 수량 330 ℓ)는 유수식 사육시스템이었으며, 해수는 1차 모래 여과하여 사용하였다. 실험수조의 환수율은 1일 30회전, 용존산소량은 에어레이션을 이용하여 5 ppm 이상이 되도록 유지하였다. 또한 실험어의 안정과 도피방지를 위해 비닐 차광막을 수조 상부에 덮어주었다.
저염분 수송 시 수온과 마취의 영향 실험에서는 해수(35‰)와 15‰ 해수에 각각 수온을 20℃ (natural water temperature, NWT), 15℃ (cooling water temperature, CWT)와 50 ppm으로 마취제(anesthesia, Anes., Sigma USA)를 희석하여 혼합한 실험구를 설정하였다. 실험구는 각각 NWT+35‰, CWT+35‰, NWT+15‰, CWT+15‰, NWT+15‰+Anes. 및 CWT+15‰+Anes.의 6개 실험구를 2반복으로 설정하여 5시간(약 300 km) 차량 수송하였다. 스티로폼 상자(66×42×20 cm)를 수송용기로 사용하였으며, 해수 3 ℓ와 액화산소를 주입한 비닐봉지에 넙치 8마리씩 수용하여 수송하였다.
2. 혈액의 채취 및 분석
혈액의 성상을 수송 전 · 후에 채혈하여 비교하였다. 실험어의 혈액은 채혈시각(수송 전후)에 맞추어 무작위 추출하고, 헤파린을 처리한 주사기 (3 ml; Sung Shim Medical Co., Ltd., Bucheon, Korea)를 사용하여 마취 없이 1분 이내에 개체 별로 미병부의 혈관에서 채취하였다. 채취한 혈액시료는 1.5 ml 튜브에 분주하였다. 이중 일부는 혈액성상 분석을 위해 즉시 혈액분석기로 분석하였으며, 혈장 분석용 시료는 실온에서 20분간 방치한 뒤, 원심분리(5,600 ×g, 5분)에 의해 혈장을 추출하여 -70℃에 분석 전까지 보관하였다. 코티졸(cortisol), 글루코스(glucose), Na+, K+, Cl-, total pro- tein, alanine aminotransferase (ALT) 및 aspartate aminotransferase (AST)는 아미노기 전이 효소의 분석에 사용하였다.
전혈분석에 있어서 헤마토크리트(hematocrit: Ht), 적혈구 수(red blood cell: RBC), 헤모글로빈량(hemoglobin: Hb)과 같은 혈액성상 분석은 자동혈액분석기(Excell 500, USA)로 측정하였다. 이 결과를 토대로 평균혈구용적(mean corpuscular volume: MCV), 평균혈구혈색소량(mean corpuscular hemoglobin: MCH) 및 평균혈구혈색소농도(mean corpuscular hemoglobin concentration: MCHC)를 구하였다. 계산식은 MCV=Ht×10/RBC, MCHC=Hg×100/Ht, MCH= Hg×10/RBC와 같다.
코티졸 농도는 cortisol RIA kit (DSL, USA)로 항원 · 항체 반응을 유도한 다음, Wizard 1470 γ-counter (Hewlett Packard, USA)를 사용하여 radioimmunoassay (RIA)로 측정하였다. 글루코스, 전해질(Na+, K+, Cl-), TP, ALT 및 AST는 건식혈액분석기(Kodak, USA)를 사용하여 분석하였다.
3. 통계처리
각 실험에서 얻어진 자료 값 사이의 유의차 유무는 SPSS-통계 패키지에 의한 ANOVA 및 Duncan's multiple range test로 검정하였다.
결 과
1. 혈액의 일반적 특성
MCV, MCH, MCHC의 결과는 Table 1과 같다. MCV는 수송 전 61.4±7.8 fl였으며 NWT+35‰ 실험구는 59.2±18.9로 낮아졌으나, CWT+35‰ 구는 68.0±7.4 fl, CWT+15‰+Anes. 구는 77.5±5.7 fl로 수송 전보다 높은 값을 보였으나 실험구 사이에 유의한 차이는 없었다(p>0.05). MCH는 수송 전 34.5±5.0 pg로부터 수송 후 CWT+ 35‰ 구는 61.6±11.1 pg로 가장 높은 값을 보였으며, CWT+15‰ 구는 43.2±5.7 fl로 가장 낮은 값을 보였다. 모든 수송 후 실험구에서 유의하게 높은 값을 보였다(p<0.05). MCHC는 수송 전 56.6±9.3%으로부터 수송 후 CWT+35‰ 구는 91.0±16.0%, NWT+35‰구는 86.8±16.4%, NWT+15‰ 구는 68.5±1.6%로 수송 전 실험구에 비해 유의하게 높은 값을 보였다(p<0.05).
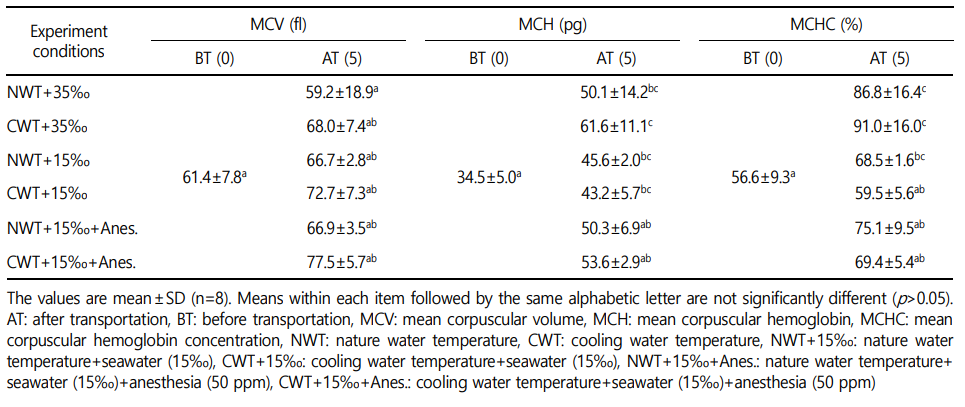
헤마토크리트, 적혈구, 헤모글로빈의 결과는 Fig. 1과 같다. 수송 전 헤마토크리트는 22.2±3.8%에서 수송 후 NWT+35‰ 실험구에서 15.3±3.9%로 낮아졌고, CWT+35‰ 실험구는 16.7±3.0%으로 유의하게 낮아지는 경향을 보였다(p<0.05). 수송 후 NWT+15‰ 실험구에서는 19.2±1.8%로 낮아졌으며, CWT+15‰ 실험구는 20.9±3.6%로 수송 전과 유의한 차이가 없었다(p>0.05). 한편 수송 후 NWT+15‰+Anes. 실험구는 17.8±0.9%로 낮아졌으나 수송 전과 유의한 차이를 보이지 않았고(p>0.05), 수송 후 CWT+15‰+Anes. 구는 14.5±1.5%로 가장 낮아진 값으로 수송 전과 유의한 차이를 보였다(p<0.05).
적혈구 수는 수송 전 3.6±0.6×106 cell μl-1으로부터 수송 후 모든 실험구에서 낮아졌으며, 수송 후 CWT+35‰는 2.5±0.4×106 cell μl-1, NWT+15‰는 2.9±0.2×106 cell μl-1, CWT+15‰+Anes.는 1.9±0.1×106 cell μl-1로 수송 전에 비해 유의하게 낮은 값을 보였다(p<0.05). 헤모글로빈 농도는 수송 전과 후 유의한 차이를 나 타내지 않았다(p>0.05).
2. 혈액의 코티졸, 글루코스 및 전해질 농도
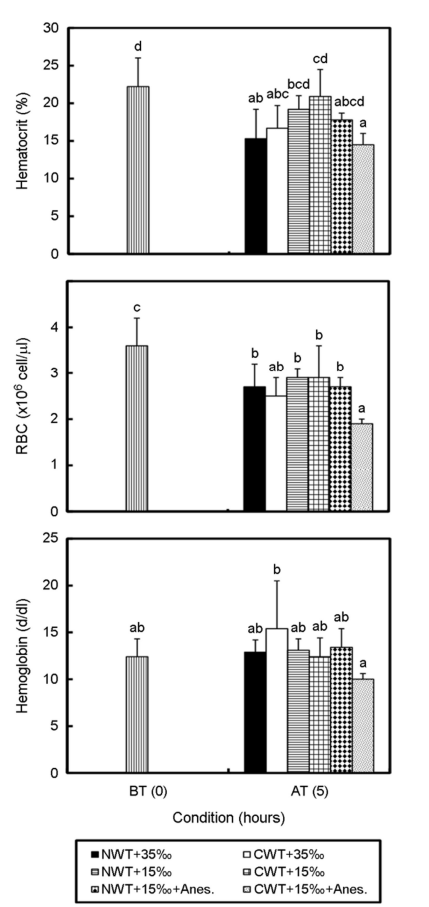
혈장 코티졸과 글루코스 농도 결과는 Fig. 2와 같다. 수송 전 혈장 코티졸 농도는 2.4±0.1 ng ml-1로부터 CWT+35‰ 구는 16.7±12.8 ng ml-1로 높아졌으나 유의한 차이를 보이지 않았다(p>0.05). 반면, NWT+35‰ 구는 47.9±19.8 ng ml-1로 높아져 유의한 차이를 나타냈다(p<0.05). NWT+15‰ 구는 43.5±13.9 ng ml-1로, CWT+ 15‰ 구는 26.1±8.3으로 유의하게 높아졌다(p<0.05). NWT+15‰+Anes. 구는 61.7±3.3 ng ml-1로 높아졌고, CWT+15‰+Anes. 구는 86.1±19.0 ng ml-1로 가장 높은 값을 보였으며, 두 실험구 수송 전에 비해 유의하게 높은 값을 보였다(p<0.05).
혈장 글루코스 농도는 수송 전 74.2±32.6 mg dl-1로부터 NWT+ 35‰ 구는 197.9±27.5 mg dl-1, CWT+35‰ 구는 272.1±29.9 mg dl-1로 수송 전에 비해 유의하게 높아졌다(p<0.05). NWT+15‰ 구와 CWT+15‰ 구는 각각 97.6±44.3 mg dl-1, 135.4±35.5 mg dl-1로 높아졌으나 유의한 차이를 보이지 않았다(p>0.05). NWT+15‰+Anes. 구는 87.0±10.3 mg dl-1로 유의한 차이를 보이지 않았고(p>0.05), CWT+15‰+Anes. 구는 251.1±56.7 mg dl-1로 유의하게 높아졌다(p<0.05).
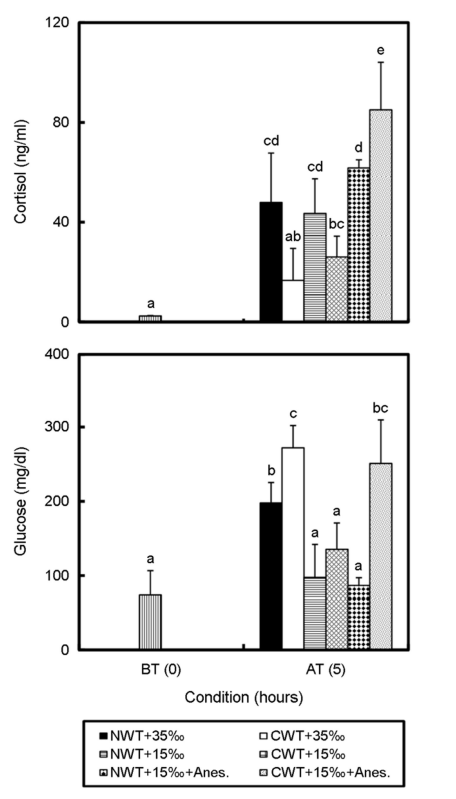
전해질(Na+, K+, Cl-) 농도는 Fig. 3과 같다. Na+의 수송 전 농도는 163.5±0.6 mEq l-1로부터 NWT+35‰ 구와 CWT+35‰ 구는 각각 175.3±1.2 mEq l-1, 190.0±5.0 mEq l-1로 유의하게 높은 값을 보였다(p<0.05). 나머지 실험구에서는 유의차를 보이지 않았다(p> 0.05). K+ 농도는 수송 전 3.1±0.0 mEq l-1로부터 NW+15‰ 구에서 4.5±1.1 mEq l-1로 수송 전과 유의한 차이를 보이지 않았고(p> 0.05), 나머지 실험구에서는 모두 유의하게 높아졌다(p<0.05). Cl- 농도는 수송 전 56.5±2.6으로부터 CWT+35‰ 구는 59.5±3.9 mEq l-1로 약간 높아진 값을 보였으나 유의차는 없었다(p>0.05). 나머지 실험구에서도 수송 전보다 유의하게 낮은 값을 보였다(p<0.05).
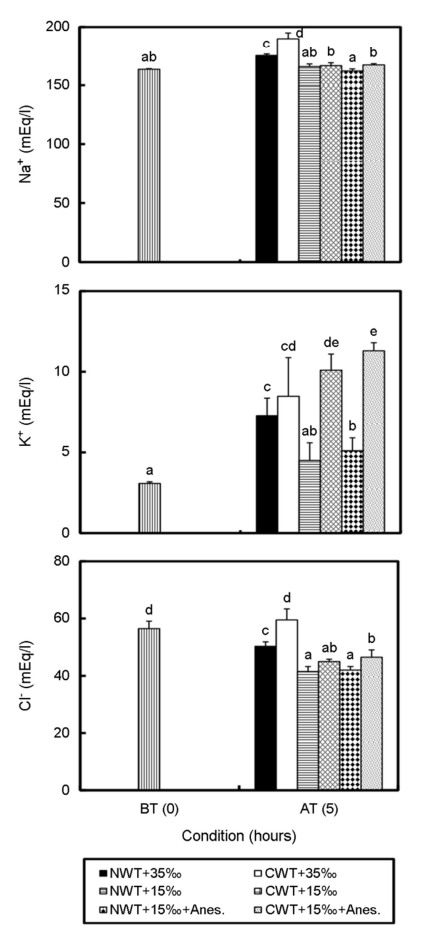
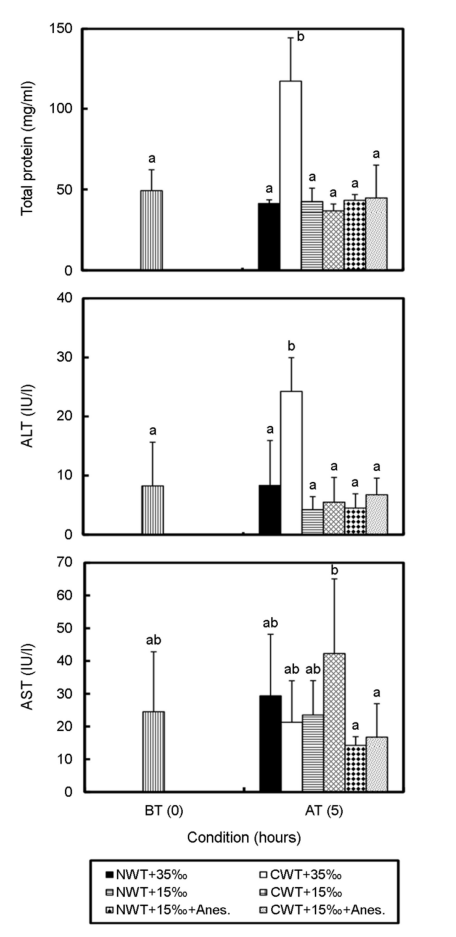
총 단백질 함량과 AST, ALT의 결과는 Fig. 4와 같다. 총 단백질 함량은 CWT+35‰ 구에서 117.0±27.4 mg ml-1로 수송 전에 비해 유의하게 높은 값을 보였다(p<0.05). 나머지 실험구에서는 수송 전과 차이를 보이지 않았다(p>0.05). ALT 또한 CWT+35‰ 구에서 24.3±5.7 IU l-1로 수송 전 8.3±7.4 IU l-1 보다 약 3배 정도 유의하게 높아진 값을 나타냈다(p<0.05). 수송 전 AST 농도 24.5±18.3 IU l-1로부터 NWT+35‰ 구는 29.3±18.8 IU l-1로 높아졌으나, CWT+35‰ 구는 21.3±12.7 IU l-1로 낮아진 경향을 보였다. NWT+ 15‰ 구는 23.5±10.5 IU l-1로 낮아졌고 CWT+15‰ 구는 42.3±22.8 IU l-1로 높아지는 경향을 보였다. NWT+15‰+Anes. 구는 14.3±2.6 IU l-1, CWT+15‰+Anes. 구는 16.8±10.2 IU l-1로 낮아지는 경향을 보였다. 수송 전과 후의 결과 값은 유의한 차이를 보이지 않았다(p>0.05).
고 찰
활어 수송에 관한 연구는 연어과 어류를 중심으로 보고되었으며(Specker and Schreck, 1980; Tacchi et al., 2015), 종묘의 방류 시 폐사율을 최소화하기 위한 목적으로 진행되어 왔다. 또한 수송 스트레스에 관하여는 수용밀도(Specker and Schreck, 1980), 수온(Davis et al., 1984) 및 염분(Tacchi et al., 2015) 등의 여러 요인들이 복합적으로 연구되고 있다. 따라서 본 연구에서는 넙치 수송에 따른 수온, 염분, 마취 첨가 유무에 따른 스트레스 및 혈액성상의 변화를 확인하였다.
헤마토크리트, 적혈구 수 및 헤모글로빈 등의 혈액인자는 어류의 산소 운반 능력을 나타내며, 어류가 스트레스에 노출 시 증가한다고 알려져 있다(Hur et al., 2001). 헤마토크리트의 증가는 적혈구 세포의 팽창, 낮은 산소 함량이 원인이며, 만성 스트레스 시 헤마토크리트의 증가와 MCV, MCH 및 MCHC의 감소가 나타난다고 보고된 바 있다(Hur et al., 2001). 본 연구에서는 Hur et al. (2001)의 결과와 일부 상반된 결과가 나타났다. MCV는 실험구간에 차이를 보이지 않았으나, MCH와 MCHC는 수송 후 증가하는 경향을 보였으며, 수온과 염분이 높은 실험구에서 유의하게 높은 값을 나타냈다. 이러한 결과는 저산소 환경 및 스트레스로 인한 혈액성상의 변화와 반대의 경향을 보인다. 본 연구에서 수송포장 과정 중 고농도의 산소 주입을 통해 충분한 산소 공급으로 인한 혈액성상의 변화로 추측된다.
어류의 수송에 있어 염분, 수온, 밀도, 수송시간 등이 스트레스 요인이 작용한다(Omeji et al., 2017). 본 연구에서 1차적 스트레스 반응 요인으로서 코티졸 농도는 상대적으로 수온이 낮은 실험구에 비해 수온이 높은 실험구에서 유의하게 높은 경향을 보였다. 2차적 스트레스 반응 요인으로서 글루코스는 NWT+35‰, CWT+ 35‰, NWT+15‰+Anes. 구에서 높아지는 경향을 보였다. 이러한 결과는 냉수성 어류인 넙치의 생리적 특징과 수온이 낮아지면 체내의 신진대사 활동이 감소하여 코티졸 농도의 차이가 있는 것으로 판단된다. 또한 마취제를 포함한 CWT+15‰+Anes.와 NWT +15‰+Anes. 구에서 유의하게 높은 경향을 보였다. Kim et al. (2005)은 조피볼락을 이용하여 마취제 농도에 따른 혈액생리학적 반응을 확인하였으며, 50 ppm 농도로 마취 후 조피볼락의 코티졸 수치가 89.2±13.8 ng ml-1로 대조구에 비해 유의하게 높은 결과를 보였다. 따라서 마취제 사용으로 스트레스에 의한 혈액성상의 변화로 판단된다.
경골어류의 삼투압조절은 아가미, 소화관 및 신장에서 이루어진다(Laurent and Kunel, 1980; Maina, 1990). 이러한 기관의 작용에 의해 해수 경골어류의 경우, 수분은 고장의 환경에서 저장의 어체 내로 유입되고, 이온들은 저장의 어체 내에서 고장의 해수환경으로 유출된다. 담수에 서식하는 경골어류에서는 해수 경골어류와는 반대현상을 보여준다. 따라서 해수에 서식하는 어류는 삼투압에 의한 고장의 환경으로 빼앗긴 체내의 물을 보충하기 위하여 해수를 마신다(Kirsch et al., 1985). 담수에 서식하는 경골어류에서는 해수 경골어류와는 반대현상을 보여준다. 물과 이온 등을 마신 해수어류는 1가이온(Na+, Cl-, K+)을 소화관 벽에서 흡수하여 아가미에서 배출되고, 2가이온(Mg2+, Ca2+)은 소화관 내에 축적되어 신장에서 배출한다(Kirsch and Meister, 1982). 수온 및 염분의 변화 등 많은 환경적인 요인에 따라 삼투압조절에 있어 많은 영향을 미치는데, 이에 따라 Na+, K+ 및 Cl- 이온의 농도 변화가 발생한다(Kim et al., 2009). Park and Min (2018)의 연구에 경우 넙치의 사육수 염분이 10‰에서 Na+는 24시간 후에 유의적으로 증가하였고 Cl-은 48시간 후에 유의적으로 감소하는 경향을 보였으나 오랜 시간 노출에 의한 결과이기 때문에 짧은 시간 동안의 노출은 변화에 영향을 미치지 않은 것으로 판단된다. 따라서 본 연구와는 반대되는 결과를 보였으나, 짧은 노출시간을 감안하면 전해질의 변화는 염분과 수온에 의한 변화보다 운송 스트레스에 의한 변화로 추측된다.
Dobisikova et al. (2006)은 잉어를 대상으로 12시간 동안 육상 수송을 진행한 다음 AST 및 ALT 농도를 측정한 결과 AST 및 ALT 농도는 증가하지 않았다. 또한 Chang et al. (1999)의 연구 결과로 염분 35‰과 15‰에서 사육한 넙치의 혈액성상 총 단백질량, AST, ALT의 값은 유의한 차이를 보이지 않았다. 본 연구와 비슷한 결과로 운송, 염분, 수온에 대한 총 단백질량, AST 및 ALT에 영향을 미치지 않은 것으로 판단된다.
본 연구의 결과, 포장 운송은 고농도의 산소 주입으로 인해 체내의 산소를 운반하는 혈액성상의 요인들인 MCV, MCH, MCHC, 헤마토크리트, 적혈구 수, 헤모글로빈이 항상성을 유지할 수 있었던 것으로 판단된다. 수온과 마취제는 넙치의 코티졸과 글루코스를 증가시키는 스트레스 요인이었으며, 수온과 염분 변화에 의한 요인보다 운송 스트레스 자체에서 삼투압조절 능력에 부정적인 영향을 미친다는 것으로 사료된다. 총 단백질 함량과 ALT 및 AST의 경우 운송 중에 큰 영향을 미치지 않은 것으로 판단된다. 어류의 수송 시 스트레스는 어류의 생리적 변화와 폐사에 직접적으로 관련되기 때문에, 앞으로는 수송과정 중에 있어서 어체 혈액의 산소 수급 및 pH를 비롯한 제반 생리적 변화를 조사하여 어종 별 생리적 특성에 알맞은 수송 조건을 연구개발해 나가야 할 것이다.
- References
-
1. Barton B. 2011. Stress in finfish: past, present and future-a historical perspective. In: Iwama GK, Pickering AD, Sumpter JP, Shreck CB (eds.), Fish stress and health in aquaculture. Cambridge university press, England, pp 1-34.
-
2. Barton BA, Iwama GK. 1991. Physiological changes in fish from stress in aquaculture with emphasis on the response and effects of corticosteroids. Annu Rev Fish Dis 1: 3-26.
-
3. Carmichael GJ, Tomasso R, Simco BA, Davis KB. 1984. Character- ization and alleviation of stress associated with hauling largemouth bass. Transactions of the American Fisheries Society 113: 778-785.
-
4. Chang YJ, Park MR, Kang DY, Lee BK. 1999. Physiological responses of cultured olive flounder (Paralichthys olivaceus) on series of lowering seawater temperature sharply and continuously. J Korean Fish Soc 32: 601-606.
-
5. Chang YJ, Min BH, Chang HJ, Hur JW. 2002. Comparison of blood physiology in juvenile black seabream (Acanthopagrus schlegeli) reared in converted freshwater from seawater and seawater from freshwater. J Korean Fish Soc 35: 595-600.
-
6. Davis KB. 2004. Temperature affects physiological stress responses to acute confinement in sunshine bass (Morone chrysops × Morone saxatilis). Comp Biochem Physiol A Mol Integr Physiol 139: 433-440.
-
7. Davis KB, Suttle MA, Parker NC. 1984. Biotic and abiotic influences on corticosteroid hormone rhythms in channel catfish. Trans Am Fish Soc 113: 414-421.
-
8. Dobisikova R, Svobodova Z, Blahova J, Modra H, Velisek J. 2006. Stress response to long distance transportation of common carp (Cyprinus carpio L.). Acta Veterinaria Brno 75: 437-448.
-
9. Hur JW, Chang YJ, Lim HK, Lee BK. 2001. Stress responses of cultured fishes elicited by water level reduction in rearing tank and fish transference during selection process. J Korean Fish Soc 34: 465-472.
-
10. Hur JW, Chol CY, Chang YJ, William HN. 2003. Effects of con- finement and transport stress on physiological condition in olive flounder, Paralichthys olivaceus. J Aquaculture 16: 135-141.
-
11. Hur JW, Gil HW, Choi SH, Jung HJ, Kang YJ. 2019a. Anesthetic efficacy of clove oil and the associated physiological re- sponses in olive flounder (Paralichthys olivaceus). Aquac Rep 15: 100227.
-
12. Hur JW, Kang KH, Kang YJ. 2019b. Effects of acute air exposure on the hematological characteristics and physiological stress response of olive flounder (Paralichthys olivaceus) and Japanese croaker (Nibea japonica). Aquaculture 502: 142-147.
-
13. Hur JW, Lim HK, Chang YJ. 2008. Effects of repetitive temperature changes on the stress response and growth of olive flounder, Paralichthys olivaceus. J Appl Anim Res 33: 49-54.
-
14. Kim JH, Hur JW, Park IS, Kho KH, Chang YJ. 2005. Effect of the different anesthetic doses of MS-222 and lidocaine-HCL on the blood physiological responses in black rockfish, Sebastes schlegeli. J of Aquaculture 18: 236-244.
-
15. Kim YS, Do YH, Min BH, Lim HK, Lee BK, Chang YJ. 2009. Physio- logical responses of starry flounder Platichthys stellatus during freshwater acclimation with different speeds in salinity change. J of Aquaculture 22: 28-33.
-
16. Kirsch R, Humbert W, Simoneaux V. 1985. The gut as an osmore- gulatory organ, comparative aspects and special references to fishes. In: R. Gilles and M. Gilles-Baillien (eds.), Transport Procosses, Iono and Osmoregulation. Springer Verlag, Berlin pp 265-277.
-
17. Kirsch R, Meister MF. 1982. Progressive processing of ingested water in the gut of seawater teleosts. J Exp Biol 98: 67-81.
-
18. Lankford SE, Adams TE, Cech Jr JJ. 2003. Time of day and water temperature modify the physiological stress response in green sturgeon, Acipenser medirostris. Comp Biochem Physiol A Mol Integr Physiol 135: 291-302.
-
-
20. Maina JN. 1990. A study of the morphology of the gills of an extreme alkalinity and hyperosmotic adapted teleost Oreo- chromis alcalicus grahami (Boulenger) with particular em- phasis on the ultrastructure of the chloride cells and their modifications with water dilutiom. A SEM and TEM study. Ana Embryol 181: 83-98.
-
21. Omeji S, Apochi JO, Egwumah KA. 2017. Stress concept in trans- portation of live fishes–a review. J Res For Wildl Environ 9: 57-64.
-
22. Pankhurst NW. 2011. The endocrinology of stress in fish: an environmental perspective. Gen Comp Endocrino 170: 265-275.
-
23. Park HJ, Min BH. 2018. Stress responses of olive flounder (Parali- chthys olivaceus) to salinity change. Korean Journal of Ichthy- ology 30: 1-8.
-
24. Specker JL, Schreck CB. 1980. Stress response to transportation and fitness for marine survival in coho salmon (Oncorhynchus kisutch) smolts. Can J Fish Aquat Sci 37: 765-769.
-
25. Tacchi L, Lowrey L, Musharrafieh R, Crossey K, Larragoite ET, Salinas I. 2015. Effects of transportation stress and addition of salt to transport water on the skin mucosal homeostasis of rainbow trout (Oncorhynchus mykiss). Aquaculture 435: 120-127.












