JMLS 2022 December;7(2):196-204. 10.23005/ksmls.2022.7.2.196 Epub 2022 December 14
Copyright © 2022 by The Korean Society of Marine Life Science
Change of Water Quality and Growth of Leiocassis ussuriensis Cultivated in a Biofloc System using Bacillus subtilis
Kyu Seok Cho; Department of Inland Fisheries Research Institute, Chung Cheong Buk-Do 27432, Korea
Jong Ho Park; Department of Inland Fisheries Research Institute, Chung Cheong Buk-Do 27432, Korea
Han Seung Kang; MS BioLab, Daejeon 34576, Korea
- Abstract
본 연구는 Bacillus subtilis를 활용한 바이오플락 양식 기술(Biofloc technology, BFT)을 이용하여 대농갱이(Leiocassis ussuriensis) 양식의 가능성을 확인하기 위해 90일 동안 생존, 성장지수와 사육수 수질의 변화를 관찰하였다. 대농갱이를 입식하기 전 BFT 수 제조를 위해 실험수조에 사료와 당밀을 첨가한 후 B. subtilis를 접종하여 40일간 수질을 안정화시켰다. 실험결과, 대농갱이의 생존율은 대조구 92.7±3.2%와 BFT 실험구 95.8±3.3%로 조사되었다. 증체율은 대조구 118.1±9.0%와 BFT 실험구 197.7±15.6%을 보였고, 일간 성장율은 대조구 0.87±0.5%, BFT 실험구 1.21±0.06%로 나타났다. 사료효율은 대조구가 43.7±2.6%이었고, BFT 실험구는 70.1±4.1%로 측정되어 BFT 실험구의 사료효율이 더 높은 것으로 조사되었다. 실험기간 동안의 수질 변화를 측정한 결과, pH는 대조구와 BFT 실험구 모두 감소되었고, MLSS는 대조구에서 변화를 보이지 않았지만, BFT 실험구에서는 90일째부터 유의한 증가를 보였다. NH4+-N와 NO2--N는 대조구에서 실험 30일째부터 유의한 증가를 보였으나, BFT 실험구에서는 변화를 보이지 않았다. 결론적으로 B. subtilis를 활용한 BFT 시스템을 대농갱이 양성 과정에 적용한 결과, 수질은 안정화되는 경향을 보였고, 성장도와 사료효율은 대조구에 비해 높은 것으로 조사되어 긍정적인 효과가 있는 것으로 확인되었다.
Abstract This study observed changes in survival, growth performance and water quality for 90 days to confirm the possibility of Leiocassis ussuriensis farming using Biofloc technology (BFT) using Bacillus subtilis. Feed and molasses were added to the experimental tank to produce BFT water before planting the experiment, and B. subtilis was inoculated to stabilize the water quality for 40 days. The survival rate of the experimental fish was 92.7±3.2% in the control group and 95.8±3.3% in the BFT group. The Weight gain (WG) was 118.1±9.0% of the control and 197.7±15.6% of the BFT, and the Specific growth rate (SGR) was 0.87±0.5% of the control and 1.21±0.06% of the BFT. As for the feed efficiency, the control was 43.7±2.6% and the BFT was measured at 70.1±4.1%, indicating that the feed efficiency of the BFT was higher. As a result of measuring the water quality change during the experimental period, pH was reduced in both the control and the BFT, and Mixed Liquor Suspended Solids (MLSS) did not show any change in the control, but the BFT showed a significant increase at 90 days. NH4+-N and NO2--N showed a significant increase from the 30 days of the experiment in the control, but showed no change in the BFT. In conclusion, as a result of applying the BFT system using B. subtilis to the process of cultivating Leiocassis ussuriensis, the water quality tended to stabilize, and the growth rate and feed efficiency were found to be higher than those of the control, confirmiWng that it had a positive effect.
Keywords: Leiocassis ussuriensis(대농갱이) Bacillus subtilis(고초균) Biofloc technology (바이오플락 기술) Growth(성장) Water quality(수질)
Correspondence to: Han Seung Kang; MS BioLab, Daejeon 34576, Korea
- Received
- 24 November 2022;
- Revised
- 24 November 2022;
- Accepted
- 2 December 2022.
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Language: Korean/English,
Full Text:

서 론
양식장 사육수는 수중의 사료 찌꺼기와 배설물 등에 의해 유기 오염물질(Organic pollutants), 질소(Nitrogen) 및 인(Phosphorus) 농도 증가 및 용존산소(Dissolved oxygen) 감소가 발생하게 되어 양식생물에 악영향을 주게 된다(Herath and Satoh, 2015; Morata et al., 2015). 일반적으로 양식장의 사육환경은 밀식 상태이므로 수질 악화는 양식생물의 면역력 저하와 병원성 미생물의 증식 조건이 조성되어 양식생물의 생존율과 성장률 등의 감소에 영향을 주어 전체적인 양식장 경영에 문제를 일으킨다(Zokaeifar et al., 2014). 또한, 고농도의 유기 오염물질이 포함된 양식장 배출수는 주변 하천수와 지하수를 오염시키고, 수생태계에 영향을 미칠 뿐만 아니라, 수서생물의 체내에 축적될 수도 있다(Lalloo et al., 2007).
사육수의 수질을 손쉽게 개선하는 방법은 환수를 자주하는 것인데, 이것은 에너지 비용이 많이 소요되고, 노동력이 필요로 하며 병원체에 노출될 우려가 커지는 문제가 있다(Devaraja et al., 2013). 따라서, 현재 적용되고 있는 가장 일반적인 방법은 순환여과시스템(Recirculating Aquaculture System, RAS)과 바이오플락 기술(Biofloc Technology, BFT)이다(Emerenciano et al., 2013; Van Rijn, 2013). RAS는 사육수를 정화해서 재사용하는 기술로서 고농도의 오염물질을 여과 처리하여 재사용하고 일부만 배수하는 방식이지만, 시스템 설비 및 운용 비용이 높아 사업화 과정에서의 제약이 존재한다(Decamp et al., 2007). 환경문제에 대하여 엄격한 규제를 적용하고 있는 유럽 등 일부 선진 국가를 제외하고는 보급률이 매우 저조한 실정이다.
BFT 방식은 사육수를 교환하지 않고 질소화합물의 제거를 미생물에 의존한다는 점에서 기존 RAS 방식과 비슷하지만, 별도의 여과조가 필요 없고 모든 질소 순환과정이 사육수조 내에서 일어난다는 점에서 많은 차이가 있다(Jang et al., 2009). BFT 방식은 사육수조 내의 미생물이 어류 배설물과 사료 찌꺼기에 기인한 질소화합물을 분해하여 먹이로 전환시켜주고, 양식장의 수질을 유지시켜주므로 사육수를 교환하지 않고 장기간 양식이 가능하다(Crab et al., 2012; Emerenciano et al., 2013).
BFT는 양식수조 안에서 미생물, 조류, 원생동물 및 미세입자가 뭉쳐서 바이오플락이 형성되는데, 이는 단백질 함량이 20~50%로 영양학적 가치가 높아 양식생물의 추가 단백질원 즉 양식생물의 먹이가 되기 때문에 사료효율이 개선되어 전체 양식 비용의 50% 이상을 차지하는 사료 비용의 절감을 가져오는 장점도 있다(Emerenciano et al., 2013). 또한, 연료비에 대한 부담이 적어서 연중 생산이 가능하며 출하조절을 통한 상품 가격을 관리할 수 있다(Jang et al., 2009).
양식 분야에서 미생물의 사용 목적은 양식장 수질을 개선하는 것이지만, 사료 이용률을 증가시키고, 성장을 개선하고, 영양성분과 효소의 공급 그리고 면역기능을 증진시키고, 병원성 미생물을 직접 또는 간접 저해하는 추가적인 장점을 가질 수 있다(Hoseinifar et al., 2018; Kuebutornye et al., 2019). 최근 양식산업에서 바실러스를 활용한 연구가 많이 수행되고 있다(Devaraja et al., 2013; Soltani et al., 2019). 바실러스균은 다른 미생물과는 달리 포자(spores)를 형성하고, 넓은 범위의 병원성 미생물을 제어할 수 있는 대사산물(Metabolites)를 생산할 수 있는 능력이 있다는 장점이 있다.
대농갱이(Leiocassis ussuriensis)는 분류학상 메기목(Order Siluri- formes) 동자개과(Family Bagridae)에 속하며 전장이 50 cm에 이르고 한강과 금강 등 우리나라의 각종 하천에 서식하며 북한과 중국, 러시아에도 분포한다(Lee and Kim, 1990). 현재 대농갱이는 자원증식 목적으로 방류사업에 참여하기 위한 치어 생산 위주로 생산되고 있으나 양성은 아직 본격적으로 이루어지지 않고 있다. 대농갱이는 맛이 좋고 대형종으로 성장하기 때문에 메기와 동자개의 대체 품종으로 육성할 필요가 있다. 대농갱이 양식이 지연되고 있는 원인은 양식장 사육환경에서의 잦은 질병 발생, 사육수 수질관리의 어려움 및 성장도 저하 등으로 볼 수 있다. 본 연구는 이러한 문제점을 해결하고자 B. subtilis를 활용한 대농갱이 바이오플락 양식 연구를 실시하였고, 그 과정에서 사육수 내의 미생물 상의 변화, 수질 상태 및 성장도의 변화를 연구하였다.
재료 및 방법
실험어로 사용한 대농갱이(L. ussuriensis)는 충청북도내수면산업연구소에서 분양 받은 개체를 사용하였고, 실험시작 전까지 순환여과식 사각수조(2.5×2.5×1 m)에서 시판되는 메기용 부상사료를 공급하여 순응시켰다. 실험기간은 6월부터 8월까지 90일간 실시하였고, 각 실험구는 지름 3 m × 수심 1 m의 원형수조(7톤)를 사용하였다. 실험구는 매일 100% 환수하는 대조구와 미생물을 넣고 환수하지 않은 BFT 실험구로 구성하였으며 3반복구로 실험하였다. BFT 수조에는 수중펌프를 설치하여 원활하게 혼합되게 하였고, 공기 주입장치를 통해 사육조 하부와 중간에서 에어가 발생하게 하여 바이오플락과 유기물의 침전을 방지하였다.
바이오플락 양식수를 만들기 위해 각 실험구에는 0.5 μm micro-filter로 여과한 지하수를 사용하였다. 타가 영양세균의 활성을 위해 Avnimelech (1999)의 계산법에 따라 탄질비 (C:N ratio)를 15:1로 조성하였는데, 탄소원과 질소원을 공급하기 위해서 각 BFT 수조에 국내 시판 중인 메기사료를 각 5 kg(탄소량 2.5 kg, 질소량 0.3 kg)씩 넣었고, 부족한 탄소원으로 당밀 6 kg(탄소 2.5 kg)을 첨가하였다. 바이오플락 양식수 만들기에 사용한 바실러스균은 충청북도내수면산업연구소 미생물배양실에서 분양 받은 B. subtilis를 이용하였다. B. subtilis은 각각 34℃에서 24시간 배양하였고, 이때 생균수를 측정한 결과 4.8×107 CFU/ml이었다. 미생물은 배양한 즉시 수조에 담긴 물의 수온과 동일하게 만들어서 각 BFT 수조에 5 ℓ씩 투여하였다. 수질측정은 NH4+-N, NO2--N 및 NO3--N 및 MLSS (Mixed Liquor Suspended Solids)를 40일간 측정하였고, 수질이 안정화된 것으로 확인한 후 실험어를 투입하였다.
각 실험수조에는 외관상 질병의 증세가 나타나지 않고 먹이 붙임이 좋은 대농갱이(체중 3.28±0.65 g, 체장 4~5 cm)를 각각 1,000마리씩 수용하였다. 실험어는 메기 배합사료를 어체 중 3%씩 1일 3회 나누어 공급하였고, 각 실험구에 공급한 총 사료량은 8.8 kg이었다. Avnimelech (1999)의 계산법에 의거하여 7일 기준으로 공급된 사료량은 740 g(탄소량 370 g, 질소량 50 g)이었고, 당밀 880 g(탄소량 370 g)을 추가하여 탄질비를 15:1 정도로 맞추었다.
실험종료 시 BFT 수조의 사육수에서 미생물 스크리닝을 실시하였다. 미생물은 멸균 증류수로 희석한 후 TSA 배지에서 배양되어 순수한 집락을 취하였다. 미생물 동정은 MALDI-TOF MS (Matrix-assisted laser desorption/ionization-time of flight mass spectrometry) 법을 이용하여 ASTA MicroIDsys에서 분석되었다.
수질분석은 수온, pH, 용존산소, NH4+-N, NO2--N, NO3--N 및 MLSS를 측정하였으며, 측정방법은 Standard Methods (APHA, 1989)에 준하여 실시하였다. 실험은 고수온기(6~8월)에 실시하게 됨에 따라 각 실험조의 용존산소량을 유지하기 위해 공기 발생장치(Hwanghae 3 Phase Ring Blower Motor (HRB-902)) 외에도 액체산소를 주입하였다.
본 실험은 대조구와 BFT 실험구에서 대농갱이의 생존율, 성장률 및 사료효율 등은 독립표본 T 검정을 실시하였고, 수질분석 결과는 One-way ANOVA test의 Duncan's multiple range test를 실시하여 p<0.05에서 통계적 유의성을 판단하였다.
결과 및 고찰
수중의 질소 성분의 다양한 형태들인 TAN (Total ammonia nitrogen), NO2, NO3 및 TKN (Total kjeldahl nitrogen)은 미생물의 대사활동에 이용되어 제거될 수 있지만(Abakari et al., 2021), 양식생물의 사육 과정에서 발생하는 과도한 오염물질의 양을 제거하기 위해서는 추가적인 방법이 요구된다. 유기질소(Organic nitrogen)는 바실러스를 포함한 다양한 미생물에 의해서 암모늄 이온(NH4+-N)과 암모니아(NH3)로 전환된다. 암모늄 이온(NH4+-N)은 Nitrosomonas에 의해서 아질산 이온(NO2--N)으로 전환되고, Nitrobacter에 의해서 질산 이온(NO3--N)으로 변환된다. 마지막으로 질산 이온(NO3--N)은 질소 가스(N2)로 대기 중으로 되돌아간다(Bernhard, 2010).
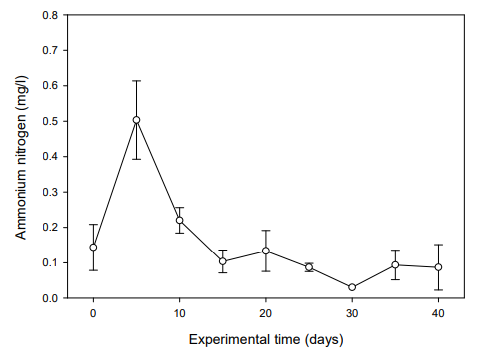
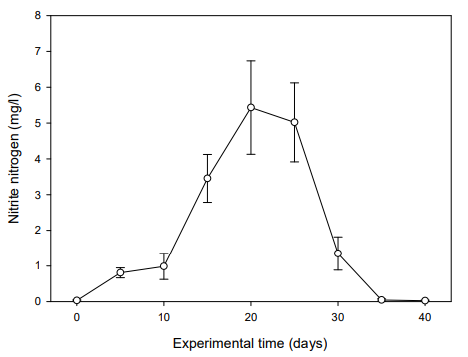
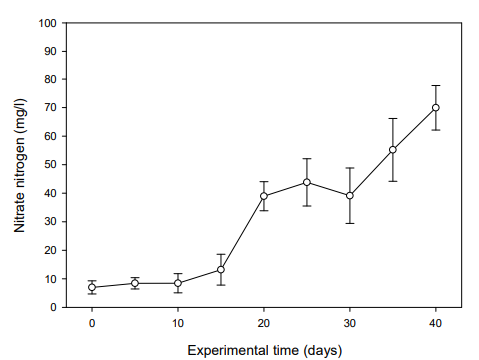
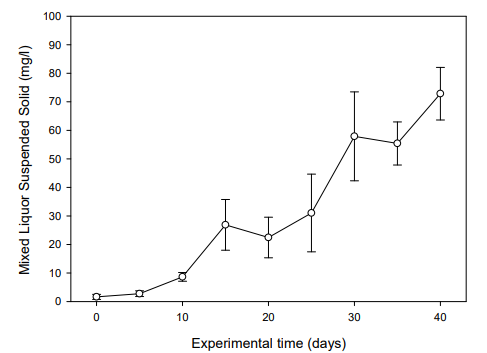
실험어를 입식하기 전 BFT 수 제조 과정을 위해 40일간의 안정화 기간을 두고 수질의 변화를 측정하였다. NH4+-N은 실험 5일째 0.50 mg/l으로 최고치를 나타내다가 실험 10일째부터는 점차 감소하여 안정화되었다(Fig. 1). NO2--N은 실험 20일째 5.43 mg/l으로 가장 높은 수치를 보이다가 실험 40일째부터는 0.02 mg/l 수준을 유지하였고(Fig. 2), NO3--N은 실험기간 동안 지속적으로 증가하여 실험 40일째는 69.94 mg/l까지 상승하였다(Fig. 3). MLSS는 미생물 증식으로 인해 실험 5일째부터 상승하여 실험 40일째는 728.49 mg/l까지 증가하였다(Fig. 4). 따라서 B. subtilis를 활용한 BFT 수 제조 과정에서 어류에 독성을 유발시킬 수 있는 NH4+-N와 NO2--N 수치가 안정화되는 것을 확인할 수 있었다(Fig. 1, 2).
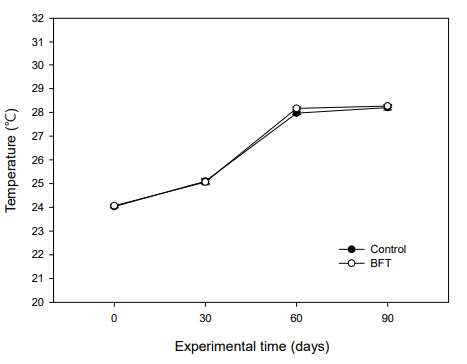
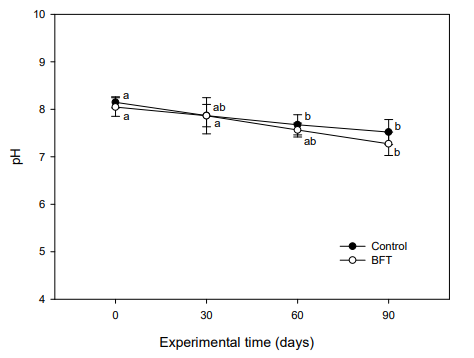
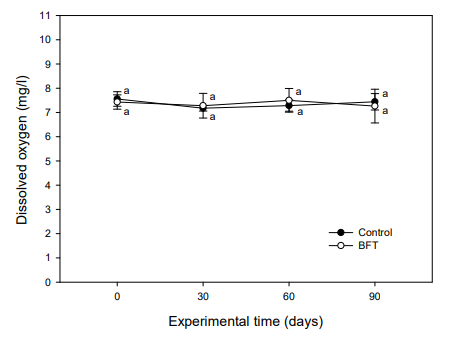
안정화된 BFT 수가 담긴 실험수조에 대농갱이를 입식하고 90일간 수질 변화를 조사하였다. 본 실험은 6~8월 사이에 실시하였기 때문에 수온은 24℃에서 28℃까지 상승하였다(Fig. 5). pH는 실험초기 8.05~8.15 수준이었으나 대조구에서는 실험 60일째부터 7.67±0.21로 유의적인 감소를 보였으며, 실험종료 시에는 7.52±0.26를 보였다. BFT 실험구의 경우, 실험 90일째 7.27±0.25로 나타나 유의한 감소를 보였다(Fig. 6). 용존산소는 실험기간 동안 7.4~ 7.6 mg/l 수준을 유지하였는데, 그 이유는 수온이 상승하고 미생 물 증식량이 커질수록 용존산소가 감소하는 것을 대비하여 액화산소를 사육수로 주입하였기 때문이다(Fig. 7).
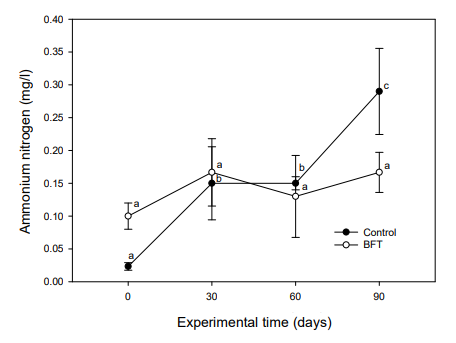
바실러스 속 미생물은 암모니아화 반응(ammonification), 질산화 반응(nitrification) 및 탈질화 반응(denitrification)으로 이어지는 순환 고리에서 질소를 제거하는데 중요한 역할을 한다(Verbaendert et al., 2011; Rout et al., 2017; Hui et al., 2019). 또한, 바실러스는 부유물질에 대한 흡착성 및 점착성이 있어 floc이 잘 형성되며, 분해를 촉진시키고 암모니아, 황화수소 등을 직접 섭취 또는 분해하는 것으로 알려져 있어 하수처리 공정 시 질소, 인 및 악취제거에 유용하게 사용되고 있다(Ahn et al., 2001). 본 실험에서 NH4+-N는 대조구의 경우 실험시작 시 0.02±0.01 mg/l이었으나, 실험 30일째부터 유의적으로 증가되었고, 실험 90일째는 0.29±0.07 mg/l으로 증가하였다. BFT 실험구에서는 실험기간 동안 0.10~0.17 mg/l으로 큰 변화를 나타내지 않았다(Fig. 8). NO2--N은 대조구의 경우, 실험초기 0.16±0.02 mg/l으로 측정되었으며, 실험 30일째 0.31±0.08 mg/l로 증가하였고, 실험 60일째는 0.26±0.08 mg/l으로 약간 감소하다가 실험 90일째는 0.38±0.12 mg/l까지 상승하였다. 그러나 BFT 실험구에서는 0.16~0.22 mg/l로 조사되었고, 실험기간 동안 상승하는 경향을 보였으나, 유의적인 차이는 나타나지 않았다(Fig. 9).
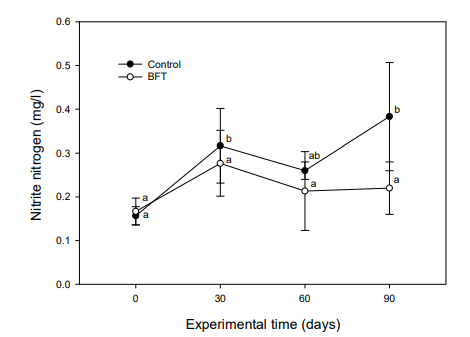
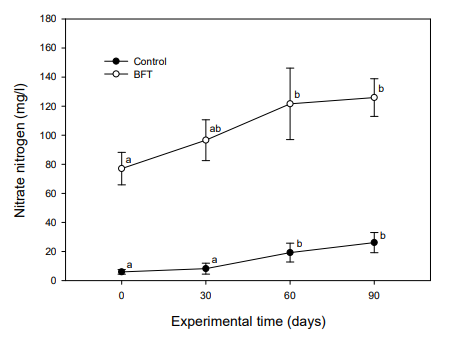
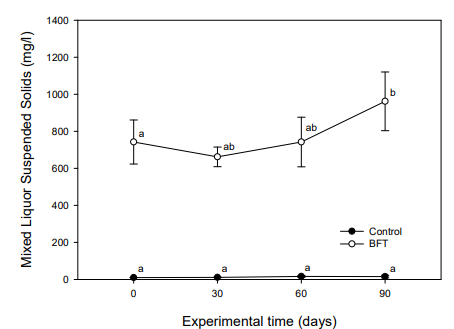
NO3--N의 경우, 대조구에서 실험초기 6.0±1.6 mg/l이었으나 실험 30일째부터 19.25±6.49 mg/l으로 유의적인 증가를 보였으며, 실험 90일째는 26.12±6.95 mg/l까지 증가하는 경향을 보였다. BFT 실험구에서는 실험초기 77.06±11.19 mg/l이었으나 실험기간 동안 계속 증가하여 실험 60일째 121.61±24.58 mg/l, 실험종료 시에는 125.90±12.96 mg/l로 증가하였다(Fig. 10). MLSS는 대조구에서 10.2~16.2 mg/l로 큰 변화를 보이지 않았으나, BFT 실험구는 실험기간 동안 증가하여 실험 90일째부터 유의적인 증가를 나타내었다(Fig. 11).
B. subtilis에 의한 양식장 수질 변화에 관한 연구는 많이 보고되고 있는데, 미생물의 증식으로 인해 수중의 용존산소(Gomes et al., 2008; Zink et al., 2011)와 pH (Gomes et al., 2008; Wu et al., 2016)는 감소된다고 보고하였다. 질소화합물의 경우 암모니아(Gomes et al., 2008; Zink et al., 2011; Zokaeifar et al., 2014; Naderi Samani et al., 2016)와 아질산성 질소(Zokaeifar et al., 2014; Wu et al., 2016)의 감소가 보고되고 있어 본 연구결과와 일치하는 경향을 보였다.
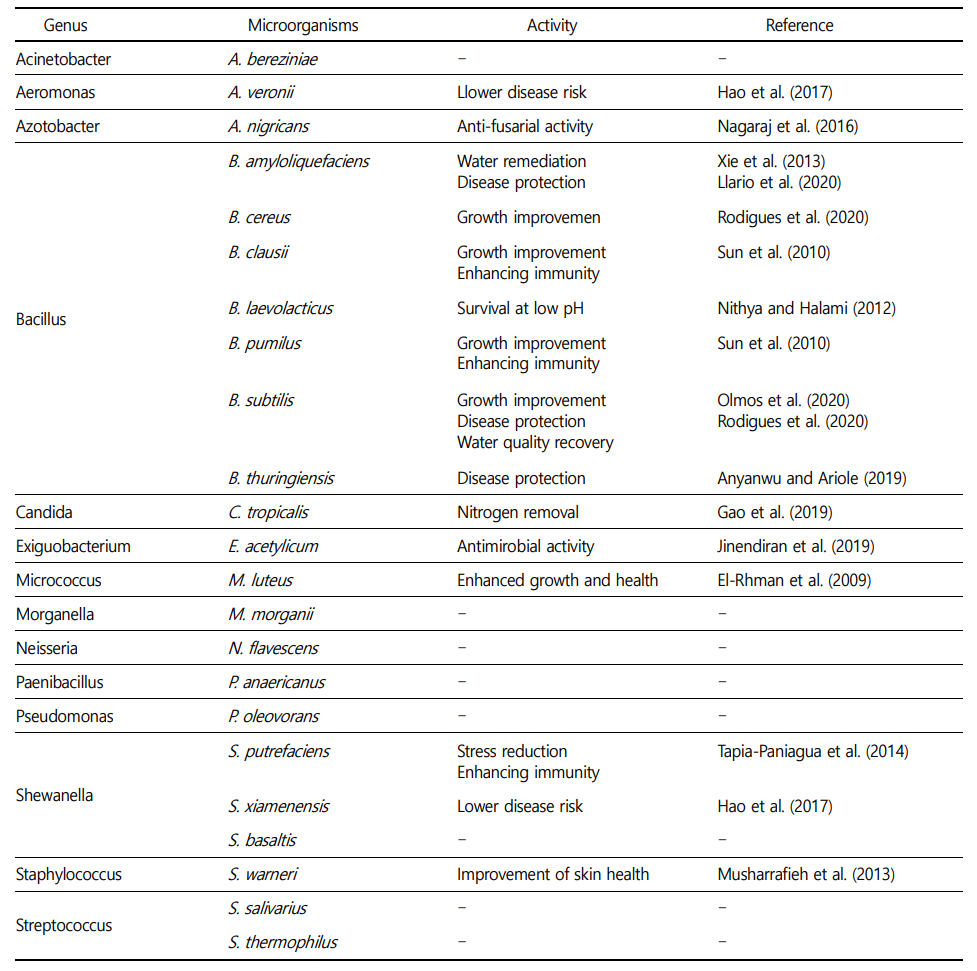
실험시작 시 BFT 실험구에는 B. subtilis 1종을 접종시켰는데, 실험종료 시에는 Bacillus 6종, Shewanella 3종 및 Streptococcus 2종이 검출되었고, Acinetobacter, Aeromonas, Azotobacter, Candida, Exiguobacterium, Micrococcus, Morganella, Neisseria, Paenibacillus 및 Pseudomonas 속은 각각 1종씩 검출되었다(Table 1). 이들 가운데 B. subtilis를 제외한 대부분의 미생물들은 실험사료와 실험어 등에 포함되었을 것으로 추정된다. Wu 등 (2016)은 새우 양식장에 B. subtilis를 추가할 경우 bacteria 또는 microalgae 등의 미생물 군집의 다양성이 증가하고 Vibrionaceae과 같은 병원성 미생물의 증가를 억제한다고 보고하였다.
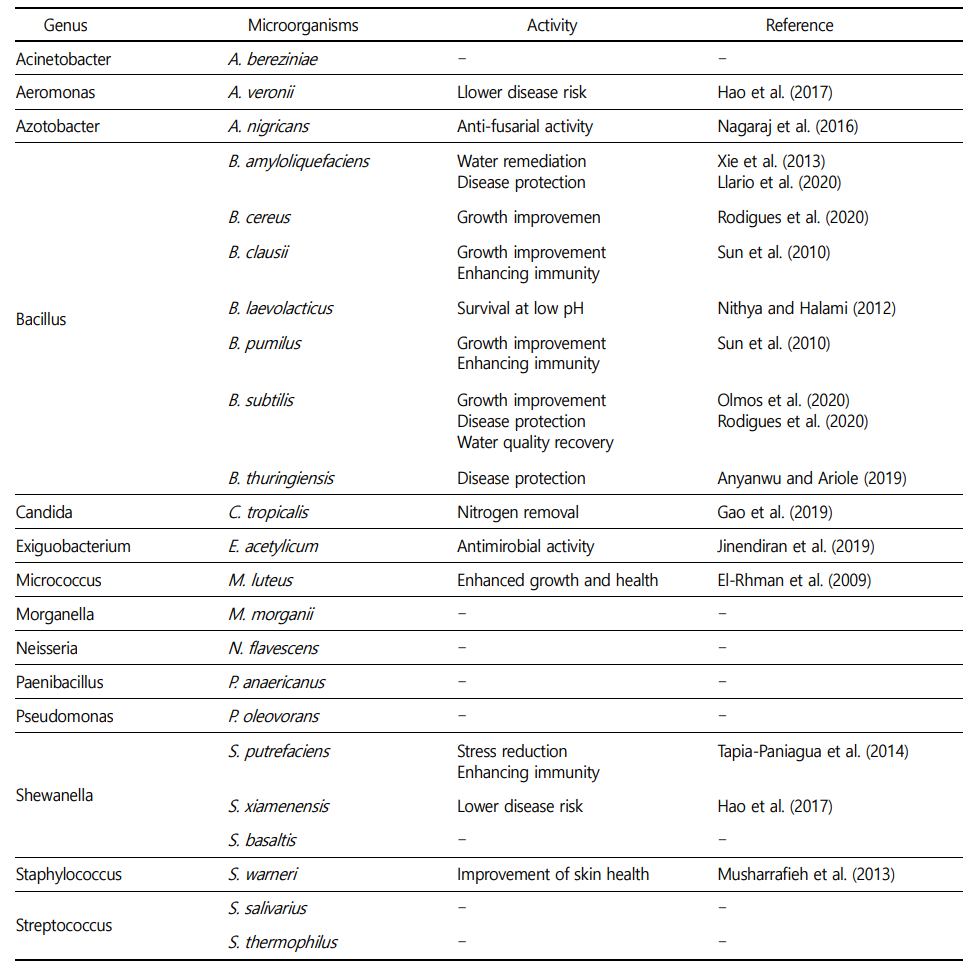
BFT 실험수조에서 검출된 Bacillus 속 미생물 가운데 B. subtilis, B. cereus, B. clausii, B. pumilus 및 B. thuringiensis는 양식장 수질개선 효과 뿐만 아니라, 양식생물의 성장률 및 생존율을 향상시키는 것으로 보고되었다(Sun et al., 2010; Nithya and Halami, 2012; Anyanwu and Ariole, 2019; Olmos et al., 2020; Rodigues et al., 2020). 또한 본 실험에서 동정된 B. laevolacticus는 양식 분야에서 적용된 연구사례가 미비하지만, pH 2.5에서도 유의적인 생존율을 보였기 때문에(Nithya and Halami, 2012), 향후 Probiotics로서 연구해야 할 필요가 있다고 생각한다.
대조구와 BFT 실험구에서 사육한 대농갱이의 생존율, 증체율, 일간 성장률 및 사료효율은 Table 2에 나타내었다. 실험종료 시 생존율은 대조구의 경우 92.7±3.2%이었고, BFT 실험구는 95.8±3.3%로 나타났으나 유의적인 차이는 없었다.
성장도 지수를 측정한 결과, 모든 항목에서 유의적인 차이를 보였다. 증체율 결과는 대조구 118.1±3.2%로 측정된 반면에 BFT 실험구는 197.2±15.6%로 측정되어 67% 더 높게 조사되었다. 일간 성장률은 대조구가 0.87±0.05%이고, BFT 실험구는 1.21±0.06%로 40% 정도 더 높았다. 사료효율 결과도 대조구 43.7±2.6%이었으나, BFT 실험구는 70.1±4.1%로 측정되어 60% 정도 더 높게 나타났다.
Honsheng (2010)에 따르면 B. subtilis에 의해 어류 장내에 소화효소가 증가됨에 따라 증체율과 사료효율이 증가한다고 보고하였고, Ridha와 Azad (2012)도 Bacillus sp.에 의해 장내 소화효소의 생산이 증가되어 소화력이 증진된 결과로 성장도 향상이 이루어질 수 있다고 보고하였다. Adorian 등 (2019)은 B. subtilis와 B. licheniformis를 투여하였을 때 Asian sea bass의 성장도가 개선되었다고 보고하였다. 또한 Xue 등 (2015)은 Litopenaeus vannamei larvae에 B. subtilis를 투여했을 때 생존율이 향상되었다고 보고하였고, John 등 (2018)은 Macrobrachium malcolmsonii에 B. subtilis를 투여했을 때 증체율이 증가했다고 보고하였다.
Bisht 등 (2012)은 Cyprini carpio에 B. subtilis를 투여했을 때 소화기계 효소가 활성화되었고 성장률도 증가하였음을 보고하였고, Purwandari과 Chen (2013)은 Epinephelus coioides에서 B. subtilis의 투여는 장내 미생물량의 증가를 유도했음을 보고하여 본 연구결과와 유사한 결과를 보였다.
본 실험을 통해 B. subtilis를 활용한 BFT의 적용 결과, 수중의 질소화합물을 효과적으로 제거할 수 있었고, 대농갱이의 증체율, 일간 성장률 및 사료효율 등 양식 효율성이 개선되었음을 확인할 수 있었다. 결론적으로 B. subtilis를 이용한 바이오플락 기술은 사용방법이 단순하고, 운용 비용이 저렴할 뿐만 아니라 수질오염 방지 및 성장률 향상 등 긍정적인 측면이 있어 향후 대농갱이 양식을 성공시킬 수 있는 양식방법으로 사료된다.
- References
-
1. Abakari G, Luo G, Kombatde EO. 2021. Dynamics of nitrogenous compounds and their control in biofloc technology (BFT) systems: A Review 6: 441-447.
-
2. Adorian TJ, Jamali H, Farsani HG, Darvishi P, Hasanpour S, Bagheri T, Roozbehfar R. 2019. Effects of Probiotic Bacteria Bacillus on Growth Performance, Digestive Enzyme Activity, and Hematological Parameters of Asian Sea Bass, Lates calcarifer (Bloch). Probiotics Antimicrob Proteins 11: 248-255.
-
3. Ahn TS, Hong SH, Kim OS, Yoo JJ, Jeon SO, Choi SI. 2001. The changes of Bacillus spp. in municipal waste water treatment plant with B3 process. Kor J Microbiol 37: 209-213.
-
4. Anyanwu NG, Ariole CN. 2019. Probiotic Potential of an Indi- genous Marine Bacillus thuringiensis on Shrimp (Penaeus monodon) Culture Infected with Vibrio mimicus. Journal of Applied Sciences 19: 173-179.
-
5. APHA, American Public Health Association. 1989. Standard methods for the examination of water and wastewater. 17th edition. American Public Health Association/American Water Works Association/Water Environment Federation, Washington DC 3030.
-
6. Avnimelech Y. 1999. Carbon/nitrogen ratio as a control element in aquaculture systems. Aquaculture 176: 227-235.
-
7. Bernhard A. 2010. The Nitrogen Cycle: Processes, Players, and Human Impact. Nature Education Knowledge 3: 25.
-
8. Bisht A, Singh UP, Pandey NN. 2012. Bacillus subtilis as a potent probiotic for enhancing growth in fingerlings of common carp (Cyprinus carpio Linnaeus). Indian Journal of Fisheries 59: 103-107.
-
9. Crab R, Defoirdt T, Bossier P, Verstraete W. 2012. Biofloc technology in aquaculture: beneficial effects and future challenges. Aquaculture 356: 351-356.
-
10. Decamp O, Conquest L, Cody J, Forster I. 2007. Effect of shrimp stocking density on size-fractionated phytoplankton and ecological groups of ciliated protozoa wiithin zero-water exchange shrimp culture systems. J World Aquacult Soc 38: 395-406.
-
11. Devaraja T, Banerjee S, Yusoff F, Shariff M, Khatoon H. 2013. A holistic approach for selection of Bacillus spp. As a bio- remediator for shrimp postlarvae culture. Turk J Biol 37: 92-100.
-
12. El-Rhman AMA, Khattab YA, Shalaby AM. 2009. Micrococcus luteus and Pseudomonas species as probiotics for promoting the growth performance and health of Nile tilapia, Oreochromis niloticus. Fish Shellfish Immuno 27: 175-180.
-
13. Emerenciano M, Gaxiola G, Cuzon G. 2013. Biofloc Technology (BFT): A Review for Aquaculture Application and Animal Food Industry. Biomass Now, Cultivation and Utilization 12: 301-328.
-
14. Gao F, Liao S, Liu S, Bai H, Wang A, Ye J. 2019. The combination use of Candida tropicalis HH8 and Pseudomonas stutzeri LZX301 on nitrogen removal, biofloc formation and microbial communities in aquaculture. Aquaculture 500: 50-56.
-
15. Gomes LC, Brinn RP, Marcon JL, Dantas LA, Brandão FR, de Abreu J, McComb DM, Baldisserotto B. 2008. Using Efinol®L during transportation of marbled hatchetfish, Carnegiella strigata (Günther) Aquac Res 39: 1292-1298.
-
16. Hao K, Wu ZQ, Li DL, Yu XB, Wang GX, Ling F. 2017. Effects of Dietary Administration of Shewanella xiamenensis A-1, Aero- monas veronii A-7, and Bacillus subtilis, Single or Combined, on the Grass Carp (Ctenopharyngodon idella) Intestinal Microbiota. Probiotics Antimicrob Proteins 9: 386-396.
-
17. Herath S, Satoh S. 2015. Environmental impact of phosphorus and nitrogen from aquaculture. In book: Feed and Feeding Practices in Aquaculture 369-386.
-
18. Honsheng M. 2010. Effects of probiotics on activities of digestive enzyme for tilapia. Journal of South China Normal University 2: 10-15.
-
19. Hoseinifar SH, Sun YZ, Wang A, Zhou Z. 2018. Probiotics as Means of Diseases Control in Aquaculture, a Review of Current Knowledge and Future Perspectives. Front Microbiol 9: 1-18.
-
20. Hui C, Wei R, Jiang H, Jiang Y, Xu L. 2019. Characterization of the ammonification, the relevant protease production and activity in a high-efficiency ammonifier Bacillus amyloliquefaciens DT. International Biodeterioration & Biodegradation 142: 11-17.
-
21. Jang IK, Kim JS, Seo HC, Cho KJ. 2009. Intensive Culture of the Pacific White Shrimp Litopenaeus vannamei, under Limited Water Exchange - II. Indoor Post-Nursery Culture of Juvenile Shrimp. J Aquaculture 22: 42-50.
-
22. Jinendiran S, Boopathi S, Sivakumar N, Selvakumar G. 2019. Functional Characterization of Probiotic Potential of Novel Pigmented Bacterial Strains for Aquaculture Applications. Probiotics Antimicrob Proteins 11: 186-197.
-
23. John G, Mohamed RR, Kolanchinathan P, Balasundaram A. 2018. Nutritional Value of Two Bacterial Strains Bacillus subtilis RCMB21 and Pseudomonas fluorescens RCMB39 as Feed Supplement for Freshwater Prawn Macrobrachium malcolm- sonii. Asian Journal of Animal and Veterinary Advances 13: 282-294.
-
24. Kuebutornye FKA, Abarike ED, Lu Y. 2019. A review on the appli- cation of Bacillus as probiotics in aquaculture. Fish Shellfish Immunol 87: 820-828.
-
25. Lalloo R, Ramchuran S, Ramduth D, Görgens J, Gardiner N. 2007. Isolation and selection of Bacillus spp. as potential biological agents for enhancement of water quality in culture of orna- mental fish. J Applied Microbiol 103: 1471-1479.
-
26. Lee CL, Kim IS. 1990. A taxonomic revision of the family bagridae (Pisces, Siluriformes) from Korea. Korean J Ichthyol 2: 117-137.
-
27. Llario F, Romano LA, Rodilla M, Sebastia-Frasquet MT, Poersch LH. 2020. Application of Bacillus amyloliquefaciens as pro- biotic for Litopenaeus vannamei (Boone, 1931) cultivated in a biofloc system. Iranian Journal of Fisheries Sciences 19: 904-920.
-
28. Morata T, Falco S, Gadea I, Sospedra J, Rodilla M. 2015. Environ- mental effects of a marine fish farm of gilthead seabream (Sparus aurata) in the NW Mediterranean Sea on water column and sediment. Aquaculture Reasearch 46: 59-74.
-
29. Musharrafieh R, Tacchi L, Trujeque J, Lapatra S. 2013. Staphylo- coccus warneri, a resident skin commensal of rainbow trout (Oncorhynchus mykiss) with pathobiont characteristics. Vet Microbiol 169: 80-88.
-
30. Naderi Samani M, Jafaryan H, Gholipour H, Harsij M, Farhangi M. 2016. Effect of different concentration of profitable Bacillus on bioremediation of common carp (Cyprinus carpio) pond discharge. Iran J Aquat Anim Heal 2: 44-54.
-
31. Nagaraj H, Gurikar C, Rakesh S, Nalk MK. 2016. Anti-fusaral activity of Azotobacter nigricans against trichothecene producing Fusarium species associated with cereals. Food Sci Biotechnol 25: 1197-1204.
-
32. Nithya V, Halami PM. 2012. Evaluation of the probiotic char- acteristics of Bacillus species isolated from different food source. Annals of Microbiology 63: 129-137.
-
33. Olmos J, Acosta M, Mendoza G, Pitones V. 2020. Bacillus subtilis, an ideal probiotic bacterium to shrimp and fish aquaculture that increase feed digestibility, prevent microbial diseases, and avoid water pollution. Arch Microbiol 202: 427-435.
-
34. Purwandari AR, Chen HY. 2013. Effects of probiotic Bacillus subtilis on intestinal microbial diversity and immunity of orange spotted grouper (Epinephelus coioides). J Appl Biotechnol. 1: 25-36.
-
35. Ridha MT, Azad IS. 2012. Preliminary evalua-tion of growth per- formance and immune response of Nile tilapia Oreochromis niloticus supplemented with two putative probiotic bacteria. Aquaculture Research 43: 843-852.
-
36. Rodigues ML, Damasceno DZ, Gomes RLM, Sosa BDS, Moro EB, Boscolo WR, Bittencourt F, Signor A. 2020. Probiotic effects (Bacillus cereus and Bacillus subtilis) on growth and physio- logical parameters of silver catfish (Rhamdia quelen). Aqua- culture Nutrition 27: 454-467.
-
37. Rout PR, Bhunia P, Dash RR. 2017. Simultaneous removal of nitrogen and phosphorous from domestic wastewater using Bacillus cereus GS-5 strain exhibiting heterotrophic nitrification, aerobic denitrification and denitrifying phosphorous removal Bioresour Technol 244: 484-495.
-
38. Soltani M, Ghosh K, Hoseinifar SH, Kumar V, Lymbery AJ, Roy S, Ringø E. 2019. Genus Bacillus, promising probiotics in aqua- culture: aquatic animal origin, bio-active components, bio- remediation and efficacy in fish and shellfish. Rev Fish Sci Aquac 1-49.
-
39. Sun Y, Yang HL, Ma RL, Lin WY. 2010. Probiotic applications of two dominant gut Bacillus strains with antagonistic activity improved the growth performance and immune responses of grouper Epinephelus coioides. Fish & Shellfish Immunology 29: 803-809.
-
40. Tapia-Paniagua ST, Vidala S, Lobo C, Prieto-Álamo MJ, Jurado J, Cordero H, Cerezuela R, Banda IGDL, Esteban MA, Balebona MC, Moriñigo MA. 2014. The treatment with the probiotic Shewanella putrefaciens Pdp11 of specimens of Solea sene- galensis exposed to high stocking densities to enhance their resistance to disease. Fish Shellfish Immuno 41: 209-221.
-
41. Van Rijn J. 2013. Waste treatment in recirculating aquaculture systems. Aquacultural Engineering 53: 49-56.
-
42. Verbaendert I, Boon N, De Vos P, Heylen K. 2011. Denitrification is a common feature among members of the genus Bacillus. Systematic and Applied Microbiology 34: 385-391.
-
43. Wu DX, Zhao SM, Peng N, Xu CP, Wang J, Liang YX. 2016. Effects of a probiotic (Bacillus subtilis FY99-01) on the bacterial community structure and composition of shrimp (Litopenaeus vannamei, Boone) culture water assessed by denaturing gradient gel electrophoresis and high-throughput sequencing. Aquac Res 47: 857-869.
-
44. Xie F, Zhu T, Zhang F, Zhou K, Zhao Y, Li Z. 2013. Using Bacillus amyloliquefaciens for remediation of aquaculture water. Springer Plus 2: 119.
-
45. Xue M, Wen C, Liang H, Ding M, Wu Y, Li X. 2015. In vivo evaluation of the effects of commercial Bacillus probiotics on survival and development of Litopenaeus vannamei larvae during the early hatchery period. Aquaculture Research 47: 1661-1669.
-
46. Zink IC, Benetti DD, Douillet PA, Margulies D, Scholey VP. 2011. Improvement of Water Chemistry with Bacillus Probiotics Inclusion during Simulated Transport of Yellowfin Tuna Yolk Sac Larvae. N Am J Aquac 73: 42-48.
-
47. Zokaeifar H, Babaei N, Saad CR, Kamarudin MS, Sijam K, Balcazar JL. 2014. Administration of Bacillus subtilis strains in the rearing water enhances the water quality, growth performance, immune response, and resistance against Vibrio harveyi infection in juvenile white shrimp, Litopenaeus vannamei. Fish Shellfish Immunol 36: 68-74.












