JMLS 2022 December;7(2):187-195. 10.23005/ksmls.2022.7.2.187 Epub 2022 December 14
Copyright © 2022 by The Korean Society of Marine Life Science
Effects of Artificial Infection with Aeromonas hydrophila on Survival Rate, Hematological Parameters and Plasma Components of Crucian Carp, Carassius carassius
Su-Min Hong; Sun Moon University, Department of Aquatic Life and Medical Science, Asan 31460, Korea
Kyung-Tae Hyun; Sun Moon University, Department of Aquatic Life and Medical Science, Asan 31460, Korea
A-Hyun Jo; Sun Moon University, Department of Aquatic Life and Medical Science, Asan 31460, Korea
Ji-Ho Jeong; Sun Moon University, Department of Aquatic Life and Medical Science, Asan 31460, Korea
Yun-A Ryu; Sun Moon University, Department of Aquatic Life and Medical Science, Asan 31460, Korea
Seock-Won Jo; Sun Moon University, Department of Aquatic Life and Medical Science, Asan 31460, Korea
Se-Rin Choi; Sun Moon University, Department of Aquatic Life and Medical Science, Asan 31460, Korea
Jae-Hee Song; South East Sea Fisheries Research Institute, NIFS, Tongyeong 39769, Korea
Jun-Hwan Kim; Sun Moon University, Department of Aquatic Life and Medical Science, Asan 31460, Korea
- Abstract
붕어(무게 28.1±3.7 g, 길이 10.0±1.0 cm)에 0, 2.0×104, 2.0×105, 2.0×106, 2.0×107 CFU/ml의 Aeromonas hydrophila를 주사 후 2주간 실험을 실시하였다. A. hydrophila로 인위감염한 Carassius carassius의 2주 뒤 반수치사농도는 19.776×105 CFU/ml이었다. 혈액학적 지표에서는 A. hydrophila에 의해 혈색소와 적혈구 수가 유의하게 감소한 반면, 적혈구 용적은 유의적 변화가 없었다. 마그네슘, 칼슘과 같은 혈장 무기 성분은 유의적으로 감소하였다. 유기 혈장 성분에서 A. hydrophila 인위감염에 의해 혈장 포도당과 콜레스테롤이 유의하게 증가한 반면, 총 단백질은 유의하게 감소하였다. 혈장 효소 성분인 ALP는 A. hydrophila 인위감염에 의해 유의하게 증가하였다. 본 연구의 결과는 C. carassius에 대한 A. hydrophila의 인위감염이 치명적인 병원성 세균으로 혈액학적 성상 및 혈장 성분에 유의한 생리학적 변화를 유도하였음을 의미한다.
Crucian carp, Carassius carassius (Weight 28.1±3.7 g, Length 10.0±1.0 cm) were challenged with Aeromonas hydrophila at 0, 2.0×104, 2.0×105, 2.0×106, 2.0×107 CFU/ml for 2 weeks. The lethal concentration 50 (LC50) at 2 weeks of C. carassius challenged with A. hydrophila was 19.776×105 CFU/ml. In hematological parameters, the hemoglobin and RBC counts were significantly decreased by A. hydrophila challenge, whereas there was no significant change in hematocrit. The inorganic plasma components such as magnesium and calcium were significantly decreased. In organic plasma components, glucose and cholesterol were significantly increased by A. hydrophila challenge, whereas total protein was significantly decreased. In enzymatic plasma components, ALP (Alkaline phosphatase) were significantly increased by A. hydrophila challenge. The results of this study suggest that the A. hydrophila challenge to C. carassius induced the significant physiological changes in the hematological parameters and plasma components as deadly pathogenic bacteria.
Keywords: Aeromonas hydrophila(에로모나스병) Crucian carp(붕어) LC50(반수치사농도) Hematological parameters(혈액 성상) Plasma components(혈장 성분)
Correspondence to: Jun-Hwan Kim; Sun Moon University, Department of Aquatic Life and Medical Science, Asan 31460, Korea
- Received
- 24 November 2022;
- Revised
- 28 November 2022;
- Accepted
- 1 December 2022.
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Language: Korean/English,
Full Text:

서 론
Aeromonas hydrophila은 Aeromonas 속 Aeromonadaceae계에 속하는 그람음성 세균이며, 통성 혐기성 단일 편모가 있는 간균이다(Pachanawas et al., 2008). A. hydrophila은 어류 뿐만 아니라 인간을 포함한 포유류에게도 감염을 일으킬 수 있어 패혈증, 위장염 및 복막염을 유발하는 인수공통전염병으로 알려져 있다(AlYahya et al., 2018; Li et al., 2011). A. hydrophila는 담수 생태계에서 주로 존재하는 병원체로, 잉어와 붕어와 같은 담수 어종에게 감염되어 막대한 경제적 손실을 일으킬 수 있다(Giri et al., 2015). A. hydro- phila는 영양, pH, 염도, 온도 등과 같은 환경 요인에 따라 감염성 및 치명률은 다르게 나타날 수 있으며(Maalej et al., 2003), 일반적으로 Aeromonas spp.에 감염된 어류는 1~2주 이내에 출혈성 패혈증을 유발하여 급속한 폐사가 발생하며, 담수 양식장에서 생산량의 감소를 초래한다(Woo et al., 2022).
A. hydrophila에 감염된 어류는 안구 돌출, 피부 발적 및 진피 궤양 형성 등의 임상징후를 나타내며, 급성 감염이 된 경우에는 패혈증을 동반한다(Pachanawan et al., 2008). 급성 패혈증의 표적 기관은 간과 신장으로, 간은 창백해지고 신장은 부풀어 오르는 특징이 있다(Yardimci and AYDIN, 2011). 어류의 A. hydrophila 감염은 Flavobacterium columnare 및 기생충과 같은 병원체에 1차적으로 감염된 어류에서 더욱 쉽게 2차 감염으로 피해가 발생하며, 저산소 상태 및 수질 오염과 같은 환경이 좋지 않을 때, 어류의 면역 반응 감소로 인해 더욱 심각한 피해를 유발할 수 있다(Woo et al., 2022). A. hydrophila는 다양한 환경에서 생존하기 위해, 생물막 형성 및 DNA 손상 복구 등 다양한 생리 기작을 가지고, 지속적으로 변이하여 항생제에 대한 저항성을 가지고 있어, 쉽게 구제되기 어려우며, 어류에게 항생제 내생문제를 유발할 수 있다(Awan et al., 2018).
반수 치사량(Lethal Dose 50%, LD50)은 생물의 위해성을 나타내는 주요 물질에 대한 감염 및 노출로 인해 절반의 개체가 폐사사는 정도를 나타내는 지표로, 독성물질의 경구 투여, 흡입 및 주사와 같은 노출에 의한 독성평가 뿐만 아니라, 병원성 세균의 노출에 의한 어류의 감염 중증도 및 영향을 평가하는 주요한 지표로 사용될 수 있다(Raj et al., 2013). A. hydrophila의 노출에 의한 어류의 폐사율은 생물학적 요인, 수질환경적 요인 및 세균의 증식 조건에 따라 다양하게 나타날 수 있으며, 세균 노출에 의한 어류의 반수 치사량의 산정은 감염 생물에 대한 세균의 중증도 및 위해성을 확인하여 병원체 발생 및 감염에 따른 대응 및 구제를 위한 중요한 정보를 제공해 줄 것이다(Dias et al., 2016). 따라서, A. hydrophila에 대한 반수 치사량은 담수어류 양식 시 질병대응 기준을 제시할 수 있는 중요한 지표가 될 수 있다(Samayanpaulraj et al., 2019).
A. hydrophila는 아가미 및 피부를 통해 어류 순환기계로 유입되어, 1차적으로 조혈기관에 영향(ex. 패혈성 빈혈)을 미칠 수 있기 때문에, 혈액학적 성상 및 혈장 성분의 변화를 확인하는 것은 A. hydrophila 감염에 의한 영향을 평가하는 신속하고 정확한 지표가 될 것이다(Harikrishnan et al., 2003). 또한, A. hydrophila는 혈액독성을 유발하여 헤모글로빈 함량 감소에 의한 hypochromic microcytic anemia을 유발할 수 있으며, 이에 따른 거대세포증 및 신상 손상으로 이어져 단백질 생산의 저해 등 생리기능의 장애를 초래할 수 있다(Junior et al., 2018). 어류의 생리 및 신진대사는 병원성 세균 감염에 의해 직접적으로 영향을 받아 헤모글로빈농도 및 적혈구 수에 변화를 줄 수 있으며, 어류 혈액의 O2 및 CO2 수송 불균형을 초래하고 세균 감염 유발 빈혈로 인한 산소수송에 영향을 미칠 수 있다(Kim et al., 2021). 따라서 A. hydrophila에 감염된 어류의 혈액학적 및 혈장 성분의 변화를 통해 어류의 스트레스를 신속하게 평가할 수 있으며, 어류 양식 시 질병 발생에 따른 어류 건강도 평가를 위한 기준 지표를 제시할 수 있다(Fazio, 2019; Kader et al., 2012; Kreutz et al., 2011).
붕어, Carassius carassius는 잉어과에 속하는 민물고기로, 전 세계적으로 널리 분포하는 어종으로, 환경에 대한 적응성이 높아, 호소 또는 논 뿐만 아니라 수초가 많은 작은 웅덩이에서도 잘 생존한다. 또한 우리나라 수생태계에 널리 분포하고 있어 다양한 질병이나 오염을 평가할 수 있는 생태지표 종이며, 저수지와 댐과 같은 지역에서 못 양식으로 널리 양식이 이루어지고 있는 대표 양식 어종이다. A. hydrophila는 다양한 담수 어류, 특히 붕어에 높은 종 특이성을 가지고 피해를 줄 수 있는 병원체이다. 하지만, A. hydrophila가 붕어에 미치는 병리적 영향에 대한 연구는 거의 이루어지지 않고 있다. 따라서, 본 연구의 목적은 A. hydrophila 인위감염이 붕어의 생존율, 혈액학적 성상 및 혈장 성분에 미치는 영향을 확인하여, A. hydrophila 병원체가 어류에게 미치는 영향에 대한 지표를 제시하고, 어류에게 폐사를 유발하는 정도를 평가하는 기준을 마련하는데 있다.
재료 및 방법
1. 실험어 및 실험 환경
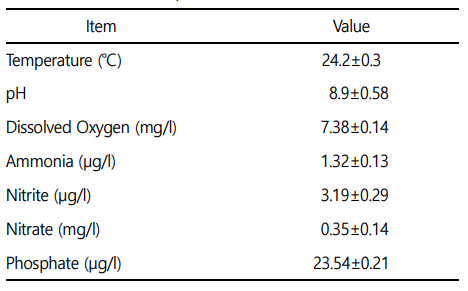
본 실험에 이용된 붕어(무게 28.1±3.7 g, 전장 10.0±1.0 cm)는 충남 아산 인근의 양식장에서 분양받아 실험실 환경에서 사육 양성한 개체를 이용하였다. 실험은 실험 전 2주간 실험실 환경에서 순치를 실시하였으며(Table 1), 실험수조는 30 ℓ 유리 사각수조를 이용하여, 6개의 인위감염 구간(0, 2.0×104, 2.0×105, 2.0×106, 2.0×107 CFU/ml)으로 2주간 노출을 실시하였다. 실험은 총 36마리 (인위감염 구간 6개 × 실험구간당 6마리)를 이용하여 노출을 진행하였으며, 실험 기간 중 수질(수온, 용존산소 및 pH)은 휴대용 수질 분석기(YSI-Professional plus, YSI Inc., USA)를 이용하여 측정하였으며, 암모니아, 아질산, 질산 및 인산염은 수질환경 분석법(해양수산부)을 이용하여 분석을 실시하였다(Table 1).
2. Aeromonas hydrophila 배양 및 접종
A. hydrophila의 균을 배양하기 위해 37℃에서 16시간 동안 LB배지에 배양하고, 분광 광도계를 사용하여 600 nm에서 1이된 균을 6,000 x g에서 10분 동안 원심분리하여 실험에 이용했다. 분리한 균을 pH 7.4의 인산완충식염수에 현탁하여 2.0×10-8 CFU/ml의 농도의 질병 원액을 희석하였다. 이후 원액을 10배씩 희석하여, 2.0×104, 2.0×105, 2.0×106, 2.0×107 CFU/ml의 농도로 만들어 실험구별 100 μl씩 복강 내 주사하였다. 대조구는 인산완충식염수만 100 μl씩 복강 내 주사하였다.
3. 반수 치사량(LD50)
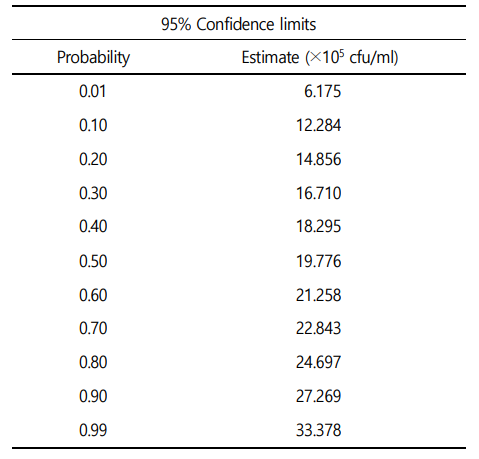
A. hydrophila를 접종한 실험구간 별로 반수 치사량을 확인하기 위해, Chidiebere, 2019에 의하여 인위감염 구간 별 A. hydrophila의 인위감염 후 0, 1, 3, 6, 12, 24, 48, 72 및 96시간 이후 실험 2주까지 매일 생존율을 확인하고 수조 별 폐사 유무를 확인하였으며, 폐사 개체는 관찰 즉시 제거해주었다. Ebrahimpour et al., 2010에서 설명한 대로 인위감염 2주 후 A. hydrophila 감염에 의한 최종 폐사 개체를 바탕으로 통계 프로그램(SPSS Inc, Chicago, IL, USA, probit model)에서 회귀분석에 있는 프로빗(Probit)을 이용하여 반수치사농도 수치를 산출하였다.
4. 혈액성상
혈액학적 분석은 A. hydrophila에 인위감염 96시간 후 살아있는 개체를 이용하여 채혈을 실시하였다. 채혈은 헤파린(Sigma Chemical, St. Louis, MO, USA) 처리된 주사기를 사용하였으며, 채혈 직후 헤모글로빈(Hemoglobin), 적혈구 용적(Hematocrit) 및 적혈구 수(RBC count)를 즉시 분석하였다. Hemoglobin 수치는 임상용 kit (Asan Pharm. Co., Ltd)를 이용하여 Cyan-methemoglobin 법으로 측정하였다. Hematocrit는 모세관 내로 혈액을 넣어, Micro- hematocrit centrifuge (VS-12000, Korea)에서 12,000 rpm, 10분간 원심분리 후 Micro-hematocrit reader를 이용하여 측정하였다. RBC count는 Hendrick's diluting solution으로 혈액을 400배 희석 후, hemo-cytometer (Improved Neubauer, Germany)를 이용하여 광학현미경으로 계수하였다.
Hemoglobin, hematocrit 및 RBC count 결과를 바탕으로 Praveena et al., 2013의 방법을 이용하여 평균적혈구용적(MCV: mean cor- puscular volume), 평균적혈구혈색소량(MCH: mean corpuscular hemoglobin) 및 평균적혈구헤모글로빈농도(MCHC: mean corpus- cular hemoglobin concentration)는 아래의 방식으로 산출하였다.
MCV (μl) = Hematocrit (%) / 적혈구 수(106/ μl) × 10
MCH (pg) = Hemoglobin (g/dl) / 적혈구 수(106/ μl) × 10
MCHC (%) = Hemoglobin (g/dl) / Hematocrit (%) × 100
5. 혈장성분 분석
A. hydrophila의 인위감염에 따른 혈장 성분의 변화를 분석하기 위해 Kim et al., 2021 방법을 이용하였으며, 채취한 혈액을 4℃에서 3,000 x g로 15분간 원심분리 후 혈장을 분리하였다. 혈장 무기 성분으로 칼슘(Calcium), 마그네슘(Magnesium)을 측정하였다. 칼슘은 OCPC법, 마그네슘은 Xylidyl blue-I 법에 따라 임상용 V를 이용하여 측정하였다. 혈장 유기 성분으로 혈당(Glucose), 콜레스테롤(Cholesterol) 및 총 단백질(Total protein)을 측정하였다. 혈당은 GOD/POD법, 콜레스테롤은 비색법, 총 단백질은 Biuret 법에 의해 시판되고 있는 임상용 kit (Asan Pharm. Co., Ltd)를 이용하였다. 혈장 효소활성으로 AST (Aspartate aminotransferase) 및 ALP (Alkaline phosphatase)를 측정하였다. AST는 505 nm에서 Reitman-Frankel 법, ALP는 King-King 법으로 500 nm에서 임상용 kit (Asan Pharm. Co., Ltd)를 이용하여 분석하였다.
6. 통계분석 방법
본 실험분석은 A. hydrophila 각 농도구간에서 6마리를 분석에 이용하였고, 모든 실험은 3반복 분석으로 이루어졌다. 실험분석 결과에 대한 통계학적 유의성은 SPSS 통계 프로그램(SPSS Inc.)을 이용하여 ANOVA test를 실시하여 Tukey's multiple range test를 통해 p < 0.05일 때 유의성이 있는 것으로 간주하였다.
결 과
1. 생존율 및 반수치사농도(LC50)
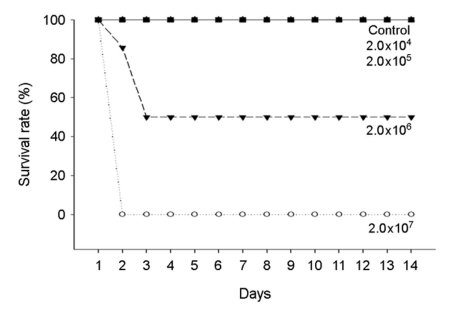
A. hydrophila 인위감염에 의한 붕어의 생존율은 Fig. 1에 나타내었다. 대조구, 2.0×104 및 2.0×105 CFU/ml에서는 100% 생존율을 보였으며, 2.0×106 CFU/ml에서는 인위감염 3시간부터 폐사가 발생하여 50% 생존율을 나타내었다. A. hydrophila 인위감염 2.0×107 CFU/ml에서는 인위감염 2시간부터 100% 전량 폐사가 발생하였다. A. hydrophila 인위감염에 의한 C. carassius의 반수치사농도는 19.993×105 CFU/ml로 나타났다(Table 2).
2. 혈액학적 성상
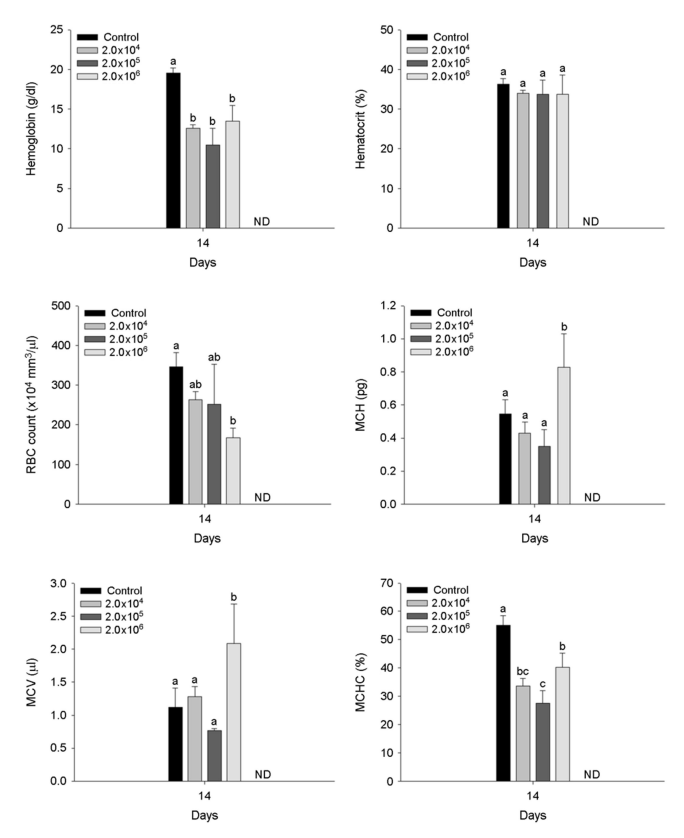
A. hydrophila 인위감염에 의한 붕어의 혈액학적 성상은 Fig. 2에 나타내었다. 붕어의 hemoglobin은 2×104 이상의 A. hydrophila에서 유의적 감소를 나타냈었으며, RBC counts는 2×106 CFU/ml의 A. hydrophila에서 유의적 감소를 나타내었다(p < 0.05). 반면, 붕어의 hematocrit는 A. hydrophila의 인위감염에 의해 유의적인 변화는 나타나지 않았다. 붕어의 MCH (pg) 및 MCV (μl)는 2×106 CFU /ml의 A. hydrophila에서 유의적 증가를 나타내었으며, MCHC (%)는 2×104 CFU/ml 이상의 A. hydrophila에서 유의적 감소를 나타내었다(p < 0.05).
3. 혈장 성분
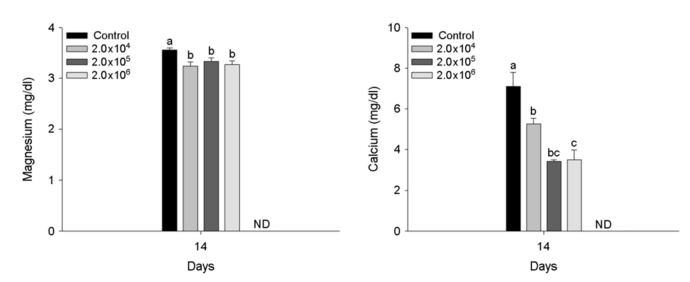
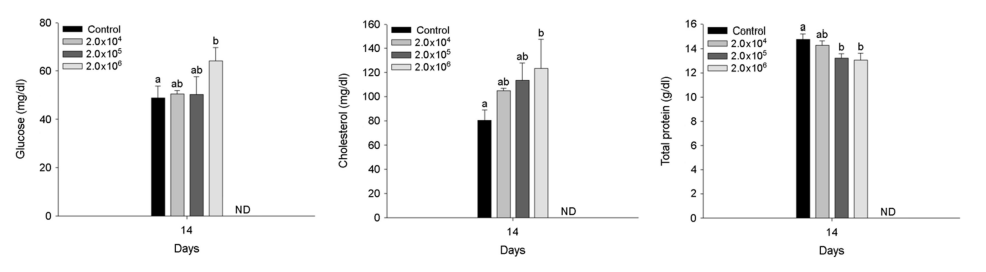
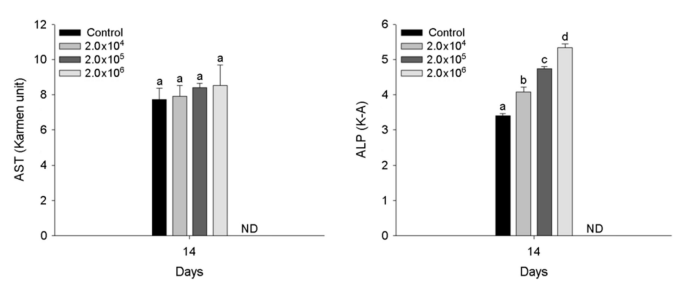
A. hydrophila 인위감염에 의한 붕어의 혈장 성분은 Fig. 3~5에 나타내었다. 혈장 무기 성분인 magnesium과 calcium은 2×104 CFU/ml 이상의 A. hydrophila에서 유의적인 감소를 나타내었다(p < 0.05). 혈장 유기 성분인 glucose 및 cholesterol은 2×106 CFU /ml의 A. hydrophila 인위감염에 의해 유의적인 증가를 나타내었다(p < 0.05). 반면, 혈장 total protein은 2×105 CFU/ml 이상의 A. hydrophila에서 유의적인 감소를 나타내었다(p < 0.05). 혈장 효소 성분인 AST는 A. hydrophila의 인위감염에 의해 유의적인 변화는 나타나지 않았다. 하지만, ALP는 2×104 CFU/ml 이상의 A. hydrophila에서 유의적인 증가를 나타내었다(p < 0.05).
고 찰
A. hydrophila는 어류 숙주조직에 진입하고 증식하여 조직 손상을 유발하고, 다양한 독성영향을 미쳐 어류 면역 시스템을 교란시키고 대량 폐사를 유발할 수 있는 병원체이다(Bi et al., 2007). A. hydrophila가 어류에 미치는 영향은 감염에 대한 저항력, 면역 체계 또는 세균 독성, 어류의 크기, 수질 환경, 감염 방법 및 기타 여러 실험 조건에 따라 달라질 수 있습니다(Van et al., 2013). 본 연구에서 A. hydrophila 인위감염은 붕어, C. carassius의 높은 폐사를 유발하였으며, 반수치사농도는 19.776×105 CFU/ml로 나타났다. Pauzi et al. (2020)는 red hybrid tilapia, Oreochromis niloticus × Oreochromis mossambicus가 A. hydrophila 인위감염에 높은 취약성을 나타내었으며, 1.1×104 CFU/ml의 반수치사농도를 보고하였다. Rodríguez et al. (2008)는 zebrafish, Danio rerio의 A. hydrophila 인위감염에 의한 폐사를 보고했으며, 4.0×105 CFU/ml의 반수치사농도를 보고하였으며, 이는 A. hydrophila 균주의 독성이 세포 외 독소 및 효소 생성에 치명적인 영향에 의한 것이라고 주장했다. Harikrishnan et al. (2010)는 A. hydrophila의 인위감염이 goldfish, Carassius auratus의 높은 폐사를 유발했다고 보고했으며, 2.3×104 CFU/ml 농도에서 18일째 30% 폐사가 발생했으며, 30일에서 36일 사이에 폐사율이 50%로 증가했다고 보고했다. Kreutz et al. (2010)는 A. hydrophila 인위감염에 의한 Nile tilapia, Oreochromis niloticus의 반수치사농도가 1.63×108 CFU/ml이었다고 보고했다. 또한, Dias et al. (2016)는 Pirarucu, Arapaima gigas는 A. hydrophila에 높은 치사율을 나타내었으며, 1.8×108 CFU/ml의 반수치사농도를 보고하였다. A. hydrophila 인위감염에 의한 질병 감수성은 어종에 따라 다양하게 나타났으며, 인위감염에 의한 반수치사농도는 질병에 대한 치명율을 확인하고 질병에 대한 대응을 하기 위한 주요한 기준을 제시해 줄 것이다.
어류의 혈액학적 성상은 세균성 병원균에 감염에 의해 직접적인 영향을 미칠 수 있으며, 어류의 적혈구 및 헤모글로빈 함량이 세균 감염에 의해 현저하게 감소하여 hypochromic microcytic anemia를 초래할 수 있다(Pratheepa et al., 2010). A. hydrophila는 적혈구 용혈을 유도하는 proteases를 생산하기 때문에 병원체에 감염된 어류는 혈액학적 성상에 직접적인 영향을 주며, 빈혈을 초래할 수 있다(da Cunha et al., 2018). 본 연구에서 A. hydrophila 인위감염은 붕어, C. carassius의 hemoglobin 농도 및 RBC counts를 유의적으로 감소시켰다. 어류의 hemoglobin은 산소를 결합하여 에너지를 생성하는 이화작용과정에 관여하며, 질병 감염에 의한 감소된 hemoglobin 수치는 신진대사율과 에너지 생성을 감소시킨다고 알려져 있다(Aisiah et al., 2020). Harikrishnan et al. (2010)는 A. hydrophila 인위감염이 C. auratus의 hemoglobin, hematocrit 및 RBC counts의 유의적 감소를 보고했으며, 이는 세균 감염에 의한 적혈구 세포가 파괴되어 빈혈을 유발에 의한 것이라고 주장했다. Talpur et al. (2014)는 A. hydrophila 감염이 snakehead, Channa striata의 RBC count 및 hematocrit의 감소를 보고했으며, 이는 병원균 감염의 결과로 백혈구 활성 증가 및 erythroblastosis으로 빈혈이 일어남에 의한 결과이다.
본 연구에서 A. hydrophila 인위감염에 따른 붕어, C. carassius의 MCH (pg) 및 MCV (μl)는 유의적으로 증가가 나타났으며, MCHC (%)는 유의적 감소가 나타났다. MCH (pg)는 각 적혈구에서 발견되는 hemoglobin의 평균 양으로 정의되며 hemoglobin을 RBC로 나누어 결정되며, MCV (μl)는 각 적혈구에서 발견되는 hematocrit를 RBC로 나누어 결정되며, 적혈구의 상태 또는 크기를 나타내는 지표로 적혈구 생성 동안 비정상적/정상적 세포 분열을 반영한다(Alwan et al., 2009). Saglam and Yonar (2009)는 MCH (pg) 및 MCV (μl)의 증가는 거대적혈구성 빈혈과 과색소성 빈혈과 직접적인 연관이 있다고 주장하였다. MCHC (%)는 각 적혈구 용적의 헤모글로빈 양을 의미하며, A. hydrophila의 감염에 의한 감소는 병원체에 의한 저색소성 빈혈에 의한 것으로 판단된다(Munir et al., 2018). Haniffa and Mydeen (2011)는 striped snakehead, Channa striatus가 A. hydrophila 감염 후 MCHC (%)의 현저한 감소를 보고했으며, 이는 적혈구 세포 팽창 또는 hemoglobin 합성 감소에 의한 것이라고 주장했다.
혈장 magnesium 및 calcium 수치는 혈장 이온 조절에 중요한 역할을 하며, 세균성 질병 감염에 의한 스트레스 조건 하에서 어류의 생리적 변화를 나타내는 지표로 이용된다(Kim et al., 2020). 본 연구에서 A. hydrophila 인위감염에 따른 붕어, C. carassius의 혈장 magnesium 및 calcium 수치는 유의적인 감소가 나타났으며, 이러한 감소는 A. hydrophila이 실험어의 이온 항상성 교란 및 장애를 유발할 수 있음을 의미한다. Kim et al. (2021)는 Streptococcus iniae에 노출이 olive flounder, Paralichthys olivaceus의 혈장 calcium의 유의적 감소를 보고했으며, 이러한 변화는 항상성 유지를 위한 이온조절능력의 교란에 의한 것이라고 주장했다. 혈장 glucose 수준은 포도당 생성과 항상성을 확립하는 글리코겐 형태의 포도당 저장 사이의 균형에 의해 유지되며, 다양한 스트레스에 의해 유의적으로 증가할 수 있다(Roda et al., 2020). 당분해는 ATP 합성의 주요 경로 중 하나이며, 혈중 glucose 수치는 질병 감염 시 어류의 스트레스에 대응하기 위한 높은 에너지 요구 사항에 의해 변화할 수 있다(Ramesh et al., 2018). 본 연구에서 A. hydrophila 인위감염에 따른 붕어, C. carassius의 혈장 glucose는 유의적인 증가가 나타났으며, 이러한 증가는 A. hydrophila 감염에 의한 스트레스에 대응하기 위한 에너지 요구에 대한 반응으로 판단된다. Banaee et al. (2017)는 A. hydrophila에 감염된 common carp, Cyprinus carpio의 혈장 glucose가 유의적으로 증가되었다고 보고했으며, 이러한 증가는 A. hydrophila가 분비하는 독소를 중화하기 위한 에너지 요구량 증가를 반영한다고 주장했다.
동물성 지방에서 발생하는 가장 중요한 sterol인 혈장 chole- sterol은 어류 세포막의 주요한 구성요소이며, 모든 스테로이드 호르몬의 전구체로, 어류 건강도를 평가하는 주요한 지표이다(Kim et al., 2020). 본 연구에서 A. hydrophila 인위감염에 따른 붕어, C. carassius의 혈장 cholesterol은 유의적인 증가가 나타났다. Chen et al. (2004)는 Vibrio vulnificus 및 Streptococcus iniae에 감염된 O. niloticus의 혈장 cholesterol이 유의적 변화가 나타났다고 보고했으며, 이는 질병저항성이 낮아짐에 의한 결과라고 주장했다. 간에서 합성되는 중요한 혈장 단백질을 나타내는 총 단백질의 함량은 간 손상을 평가할 때 중요한 것으로 간주된다(Kim et al., 2020). 본 연구에서 A. hydrophila 인위감염에 따른 붕어, C. carassius의 혈장 total protein은 유의적인 감소가 나타났으며, 이는 감염에 의한 단백질 손실과 합성 감소에 의한 것으로 판단된다. Řehulka and Minařík (2007)는 Flavobacterium columnare 인위감염이 brook trout, Salvelinus fontinalis의 저단백질혈증을 유발했으며, 이는 질병 감염에 의한 피부병변으로 인한 단백질 손실과 급성 염증 동안 단백질 이화작용 증가 또는 간병증으로 인한 단백질 합성 감소에 의한 것이라고 주장했다. Yu et al. (2010)는 Edwardsiella tarda 인위감염이 Korean catfish, Silurus asotus의 혈장 total protein의 유의적 감소를 보고했으며, 이러한 감소는 질염 감염에 의한 신장을 통한 알부민 손실에 의한 저단백혈증에 의한 것이라고 주장했다.
간, 혈청 및 혈액에서 AST 및 ALP 활동의 변화는 어류의 간 손상, 괴사 및 세포막의 건강 상태에 대한 예측을 제공할 수 있다. 건강한 어류에서 AST 및 ALP 수치가 낮지만, 간 손상이 있는 어류의 혈액에서는 수치가 높아질 수 있으며, 이는 간 손상 및 장애를 의미한다(Çiçek and Özoğul, 2021). Yildirim-Aksoy et al. (2020)는 세균성 질병이 혈중 AST 및 ALP 수치를 유의적으로 증가시킬 수 있으며, 이러한 상승은 질병 감염에 의한 간 손상과 관련이 있다고 주장했다. 본 연구에서 A. hydrophila 인위감염에 따른 붕어, C. carassius의 혈장 ALP의 유의적인 증가가 나타났으며, A. hydrophila 감염이 실험어의 간 손상을 유발할 수 있음을 의미한다.
본 연구에서 A. hydrophila 인위감염은 붕어에 치명적인 병원성으로 높은 폐사를 초래했으며, A. hydrophila 인위감염에 따른 붕어의 2주 반수치사농도는 19.776×105 CFU/ml로 나타났다. A. hydrophila 인위감염은 hemoglobin 및 RBC count와 같은 혈액학적 성상의 감소를 초래하여, 용혈로 인한 빈혈을 유발할 수 있음을 확인하였다. 또한 A. hydrophila 인위감염은 magnesium, cal- cium, glucose, cholesterol, total protein 및 ALP 등 어류 주요 혈장 성분에서 유의적 변화를 초래하여 어류의 항상성 유지에 치명적인 영향 및 조직의 손상을 미치는 것을 확인하였다. 본 연구의 결과는 A. hydrophila 인위감염에 의해 폐사를 미치는 병원체를 정량 기준을 제시하며, A. hydrophila 병원균이 생물에 미치는 병원성 기작에 대한 기준 지표를 제시해 줄 것이다.
- References
-
1. Aisiah S, Prajitno A, Maftuch M, Yuniarti A. 2020. Effect of Nauclea subdita (Korth.) Steud. leaf extract on hematological and histopathological changes in liver and kidney of striped catfish infected by Aeromonas hydrophila. Veterinary World 13: 47.
-
2. Alwan SF, Hadi AA, Shokr AE. 2009. Alterations in hematological parameters of fresh water fish, Tilapia zillii, exposed to alu- minum. Journal of Science and its Applications 3: 12-19.
-
3. AlYahya SA, Ameen F, Al-Niaeem KS, Al-Sa'adi BA, Hadi S, Mostafa AA. 2018. Histopathological studies of experimental Aero- monas hydrophila infection in blue tilapia, Oreochromis aureus. Saudi Journal of Biological Sciences 25: 182-185.
-
4. Awan F, Dong Y, Wang N, Liu J, Ma K, Liu Y. 2018. The fight for invincibility: environmental stress response mechanisms and Aeromonas hydrophila. Microbial Pathogenesis 116: 135-145.
-
5. Banaee M, Soleimany V, Haghi BN. 2017. Therapeutic effects of marshmallow (Althaea officinalis L.) extract on plasma bio- chemical parameters of common carp infected with Aero- monas hydrophila. In Veterinary Research Forum 8. Faculty of Veterinary Medicine, Urmia University, Urmia, pp 145 (in Iran).
-
6. Bi ZX, Liu YJ, Lu CP. 2007. Contribution of AhyR to virulence of Aeromonas hydrophila J-1. Research in Veterinary Science 83: 150-156.
-
7. Chen CY, Wooster GA, Bowser PR. 2004. Comparative blood chemistry and histopathology of tilapia infected with Vibrio vulnificus or Streptococcus iniae or exposed to carbon tetra- chloride, gentamicin, or copper sulfate. Aquaculture 239: 421-443.
-
8. Chidiebere EE. 2019. Acute toxicity of copper and zinc and their lethal concentration on Clarias gariepinus (cat fish). Biomed J Sci Tech Res 17: 13160-13166.
-
9. Çiçek S, Özoğul FATİH. 2021. Effects of selenium nanoparticles on growth performance, hematological, serum biochemical para- meters, and antioxidant status in fish. Animal Feed Science and Technology 281: 115099.
-
10. da Cunha JA, de Ávila Scheeren C, Fausto VP, de Melo LDW, Henneman B, Frizzo CP, Baldisserotto B. 2018. The anti- bacterial and physiological effects of pure and nanoencap- sulated Origanum majorana essential oil on fish infected with Aeromonas hydrophila. Microbial Pathogenesis 124: 116-121.
-
11. Dias MK, Sampaio LS, Proietti-Junior AA, Yoshioka ET, Rodrigues DP, Rodriguez AF, Tavares-Dias M. 2016. Lethal dose and clinical signs of Aeromonas hydrophila in Arapaima gigas (Arapaimidae), the giant fish from Amazon. Veterinary Micro- biology 188: 12-15.
-
12. Ebrahimpour M, Alipour H, Rakhshah S. 2010. Influence of water hardness on acute toxicity of copper and zinc on fish. Toxicology and Industrial Health 26: 361-365.
-
13. Fazio F. 2019. Fish hematology analysis as an important tool of aquaculture: a review. Aquaculture 500: 237-242.
-
14. Giri SS, Sen SS, Chi C, Kim HJ, Yun S, Park SC, Sukumaran V. 2015. Effect of guava leaves on the growth performance and cytokine gene expression of Labeo rohita and its suscep- tibility to Aeromonas hydrophila infection. Fish & Shellfish Immunology 46: 217-224.
-
15. Haniffa MA, Mydeen AK. 2011. Hematological changes in Channa striatus experimentally infected by Aeromonas hydrophila. Biores Bull 4: 246-253.
-
16. Harikrishnan R, Rani MN, Balasundaram C. 2003. Hematological and biochemical parameters in common carp, Cyprinus carpio, following herbal treatment for Aeromonas hydrophila in- fection. Aquaculture 221: 41-50.
-
17. Harikrishnan R, Balasundaram C, Moon YG, Kim MC, Kim JS, Dharaneedharan S, Heo MS. 2010. Phytotherapy of ulcerative dermatitis induced by Aeromonas hydrophila infection in goldfish (Carassius auratus). Acta Veterinaria Hungarica 58: 29-37.
-
18. Junior GB, Dos Santos AC, de Freitas Souza C, Baldissera MD, dos Santos Moreira KL, da Veiga ML, Baldisserotto B. 2018. Citrobacter freundii infection in silver catfish (Rhamdia quelen): hematological and histological alterations. Microbial Patho- genesis 125: 276-280.
-
19. Kader MA, Bulbul M, Koshio S, Ishikawa M, Yokoyama S, Nguyen BT, Komilus CF. 2012. Effect of complete replacement of fishmeal by dehulled soybean meal with crude attractants supplementation in diets for red sea bream, Pagrus major. Aquaculture 350: 109-116.
-
20. Kim JH, Sohn S, Kim SK, Hur YB. 2020. Effects on hematological parameters, antioxidant and immune responses, AChE, and stress indicators of olive flounders, Paralichthys olivaceus, raised in bio-floc and seawater challenged by Edwardsiella tarda. Fish & Shellfish Immunology 97: 194-203.
-
21. Kim JH, Sohn S, Kim SK, Kim SR, Kim SK, Kim SM, Kim NY, Hur YB. 2021. Effects on the survival rates, hematological parameters, and neurotransmitters in olive flounders, Paralichthys oli- vaceus, reared in bio-floc and seawater by Streptococcus iniae challenge. Fish & Shellfish Immunology 113: 79-85.
-
22. Kreutz LC, Barcellos LJG, Marteninghe A, Dos Santos ED, Zanatta R. 2010. Exposure to sublethal concentration of glyphosate or atrazine-based herbicides alters the phagocytic function and increases the susceptibility of silver catfish fingerlings (Rhamdia quelen) to Aeromonas hydrophila challenge. Fish & Shellfish Immunology 29: 694-697.
-
23. Kreutz LC, Barcellos LJG, de Faria Valle S, de Oliveira Silva T, Anziliero D, dos Santos ED, Zanatta R. 2011. Altered hema- tological and immunological parameters in silver catfish (Rhamdia quelen) following short term exposure to sublethal concentration of glyphosate. Fish & Shellfish Immunology 30: 51-57.
-
24. Li J, Ni XD, Liu YJ, Lu CP. 2011. Detection of three virulence genes alt, ahp and aerA in Aeromonas hydrophila and their rela- tionship with actual virulence to zebrafish. Journal of Applied Microbiology 110: 823-830.
-
25. Maalej S, Mahjoubi A, Elazri C, Dukan S. 2003. Simultaneous effects of environmental factors on motile Aeromonas dynamics in an urban effluent and in the natural seawater. Water Research 37: 2865-2874.
-
26. Munir MB, Hashim R, Nor SAM, Marsh TL. 2018. Effect of dietary prebiotics and probiotics on snakehead (Channa striata) health: Haematology and disease resistance parameters against Aeromonas hydrophila. Fish & Shellfish Immunology 75: 99-108.
-
27. Pachanawan A, Phumkhachorn P, Rattanachaikunsopon P. 2008. Potential of Psidium guajava supplemented fish diets in controlling Aeromonas hydrophila infection in tilapia (Oreo- chromis niloticus). Journal of Bioscience and Bioengineering 106: 419-424.
-
28. Pauzi NA, Mohamad N, Azzam-Sayuti M, Yasin ISM, Saad MZ, Nasruddin NS, Azmai MNA. 2020. Antibiotic susceptibility and pathogenicity of Aeromonas hydrophila isolated from red hybrid tilapia (Oreochromis niloticus × Oreochromis mossambicus) in Malaysia. Veterinary World 13: 2166.
-
29. Pratheepa V, Ramesh S, Sukumaran N. 2010. Immunomodulatory effect of Aegle marmelos leaf extract on freshwater fish Cyprinus carpio infected by bacterial pathogen Aeromonas hydrophila. Pharmaceutical Biology 48: 1224-1239.
-
30. Praveena M, Sandeep V, Kavitha N, Jayantha Rao K. 2013. Impact of tannery effluent, chromium on hematological parameters in a fresh water fish, Labeo rohita (Hamilton). Research Journal of Animal, Veterinary and Fishery Sciences 1: 1-5.
-
31. Raj J, Chandra M, Dogra TD, Pahuja M, Raina A. 2013. Deter- mination of median lethal dose of combination of endo- sulfan and cypermethrin in wistar rat. Toxicology International 20: 1.
-
32. Ramesh M, Thilagavathi T, Rathika R, Poopal RK. 2018. Antioxidant status, biochemical, and hematological responses in a cul- tivable fish Cirrhinus mrigala exposed to an aquaculture antibiotic Sulfamethazine. Aquaculture 491: 10-19.
-
33. Řehulka J, Minařík B. 2007. Blood parameters in brook trout Salvelinus fontinalis (Mitchill, 1815), affected by columnaris disease. Aquaculture Research 38: 1182-1197.
-
34. Roda JFB, Lauer MM, Risso WE, dos Reis Martinez CB. 2020. Microplastics and copper effects on the neotropical teleost Prochilodus lineatus: Is there any interaction?. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology 242: 110659.
-
35. Rodríguez I, Novoa B, Figueras A. 2008. Immune response of zebrafish (Danio rerio) against a newly isolated bacterial pathogen Aeromonas hydrophila. Fish & Shellfish Immu- nology 25: 239-249.
-
36. Saglam N, Yonar ME. 2009. Effects of sulfamerazine on selected haematological and immunological parameters in rainbow trout (Onchorhynchus mykiss, Walbaum, 1792). Aquaculture Research, 40: 395-404.
-
37. Samayanpaulraj V, Velu V, Uthandakalaipandiyan R. 2019. Deter- mination of lethal dose of Aeromonas hydrophila Ah17 strain in snake head fish Channa striata. Microbial Pathogenesis 127: 7-11.
-
38. Talpur AD, Munir MB, Mary A, Hashim R. 2014. Dietary probiotics and prebiotics improved food acceptability, growth per- formance, haematology and immunological parameters and disease resistance against Aeromonas hydrophila in snake- head (Channa striata) fingerlings. Aquaculture 426: 14-20.
-
39. Van Doan H, Doolgindachabaporn S, Suksri A. 2013. The LD50 of Asian Catfish (Pangasius bocourti, Sauvage 1870) challenge to pathogen Aeromonas hydrophila FW52 strain. Pensee 75: 287-293.
-
40. Woo SJ, Kim MS, Jeong MG, Do MY, Hwang SD, Kim WJ. 2022. Establishment of Epidemiological Cut-Off Values and the Distribution of Resistance Genes in Aeromonas hydrophila and Aeromonas veronii Isolated from Aquatic Animals. Antibiotics 11: 343.
-
41. Yardimci B, AYDIN Y. 2011. Pathological findings of experimental Aeromonas hydrophila infection in Nile tilapia (Oreochromis niloticus). Ankara Üniversitesi Veteriner Fakültesi Dergisi 58: 47-54.
-
42. Yildirim-Aksoy M, Eljack R, Schrimsher C, Beck BH. 2020. Use of dietary frass from black soldier fly larvae, Hermetia illucens, in hybrid tilapia (Nile × Mozambique, Oreocromis niloticus × O. mozambique) diets improves growth and resistance to bacterial diseases. Aquaculture Reports 17: 100373.
-
43. Yu JH, Han JJ, Park SW. 2010. Haematological and biochemical alterations in Korean catfish, Silurus asotus, experimentally infected with Edwardsiella tarda. Aquaculture Research 41: 295-302.












