JMLS 2022 December;7(2):145-153. 10.23005/ksmls.2022.7.2.145 Epub 2022 December 14
Copyright © 2022 by The Korean Society of Marine Life Science
Transcriptional Modulation of Metabolism-Related Genes in Brackish Water Flea Diaphanosoma celebensis Exposed to Mercury
Min Jeong Jeon; Department of Biotechnology, College of Convergence Engineering, Sangmyung University, Seoul 03016, Korea
Je-Won Yoo; Department of Biotechnology, College of Convergence Engineering, Sangmyung University, Seoul 03016, Korea
Young-Mi Lee; Department of Biotechnology, College of Convergence Engineering, Sangmyung University, Seoul 03016, Korea
- Abstract
수은은 생물 축적과 먹이사슬을 통한 생물 농축되며, 미량에서도 유해한 영향을 나타내기 때문에 해양 환경 내에서 중요한 문제가 되고 있다. 그러나 해양 소형 갑각류에 대한 수은의 생물 영향은 다른 금속에 비해 연구가 미흡하다. 본 연구에서는 기수산 물벼룩 Diaphanosoma celebensis을 아치사 농도(0.2, 0.4, 0.8 μg/l)의 무기 수은(HgCl2)에 48시간 노출시킨 후, 대사 관련 유전자의 발현 양상을 조사하였다. 해독효소 유전자 5종(cytochrome P450; cyp360A1, cyp361A1, cyp4AP3, cyp4C122, cyp370C5)과 소화효소 6종(alpha amylase (AMY), alpha amylase related protein (AMY-like), trypsin (TRYP), chymotrypsin-like protein (CHY), lipase (LIP), pancreatic lipase-related protein (PLRP))의 유전자 발현을 quantitative real time reverse transcription polymerase chain reaction (qRT-PCR)을 이용하여 분석하였다. Cyp 유전자의 경우 clan2에 속하는 cyp370C5와 clan4에 속하는 cyp4AP3 유전자의 발현이 농도 의존적으로 유의하게 증가하였다. 한편 소화효소 유전자 중에서는 단백질 소화와 관련 있는 TRYP 유전자의 발현이 농도 의존적으로 증가하였다. 이러한 결과는 cyp370C5와 cyp4AP3가 수은 독성을 해독하는 과정에서 중요한 역할을 담당할 것으로 보이며, 수은이 소화효소 유전자의 발현을 조절함으로써 에너지 대사에 영향을 미칠 수 있음을 제시한다. 본 연구는 해양 소형 갑각류에서 수은에 대한 분자 수준의 영향을 이해하는데 도움이 될 것이다.
Mercury (Hg) is a major concern in marine environment because of their bioaccumulation and biomagnification properties, and adverse effects to aquatic organisms at even a trace amount. However, little information on the effects of Hg, compared to other heavy metals, is available in marine small crustaceans. Here, we investigated the transcriptional modulation of metabolism-related genes in the brackish water flea, Diaphanosoma celebensis after exposure to sublethal concentration (0.2, 0.4, 0.8 μg/l) of HgCl2 for 48 h. Relative mRNA expression levels of five detoxification enzyme-coding genes (cytochrome P450; cyp360A1, cyp361A1, cyp4AP3, cyp4C122, and cyp370C5) and six digestive enzyme-coding genes [alpha amylase (AMY), alpha amylase related protein (AMY-like), trypsin (TRYP), chymotrypsin-like protein (CHY), lipase (LIP), pancreatic lipase-related protein (PLRP)] were analyzed using quantitative real time reverse transcription polymerase chain reaction (qRT-PCR). As results, Hg increased the mRNA level of cyp370C5 (clan2) and cyp4AP3 (clan4) in a concentration dependent manner. A significant increase in TRYP mRNA was also concentration-dependently observed after exposure to Hg. These findings suggest that cyp370C5 and cyp4AP3 play a key role in Hg detoxification in D. celebensis, and Hg can affect energy metabolism by modulating the transcription of digestive enzyme. This study will provide better understanding the molecular effects of Hg in marine small crustacean.
Keywords: Cytochrome P450(시토크롬 P450) Digestive enzyme(소화효소) Mercury(수은) Gene expression(유전자 발현) Water flea(물벼룩)
Correspondence to: Young-Mi Lee; Department of Biotechnology, College of Convergence Engineering, Sangmyung University, Seoul 03016, Korea
- Received
- 14 November 2022;
- Revised
- 18 November 2022;
- Accepted
- 29 November 2022.
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Language: Korean/English,
Full Text:

서 론
수은은 해양 환경에서 미량의 농도에서도 생물에게 높은 독성을 나타내는 것으로 알려져 있으며, 높은 생물 축적과 먹이사슬을 통한 생물 농축되는 성질로 인해 해양 환경 내의 대표적인 오염물질로 간주된다(Bai et al., 2021; Gworek et al., 2016; Sharma et al., 2015). 환경 중 수은은 무기, 유기 및 원소 수은의 형태로 존재하며, 특히 해양 환경에서는 염소 이온 (Cl-)이 결합된 무기 수은의 형태가 가장 지배적인 형태이다 (Neff, 2002). 세포 내부로 유입된 수은은 쉽게 배출되지 않고 높은 반응성을 가짐으로써 다양한 생체 고분자 물질의 황화 수소기(-SH)에 결합하여 이들을 손상시켜 산화스트레스, 생식 독성 및 에너지 대사의 장애를 포함한 다양한 독성 영향을 유발할 수 있다(Zheng et al., 2019).
Cytochrome P450 (CYP)은 해독의 초기단계에 작용하는 1상 대사효소로써 다양한 생물에서 환경 오염물질의 초기 위해성 평가를 위한 유용한 분자적 마커로 활용되어 왔다(Wu et al., 2019). 선행 연구들은 카드뮴, 벤조[a]피렌 및 미세플라스틱 등에 노출된 해양 생물에서 CYP 유전자 발현 및 효소 활성을 보고하였다(Wu et al., 2019; Zhang et al., 2019). 또한 스트레스 상황에서 생물은 이에 대응하기 위해 해독작용을 포함한 다양한 방어 기작을 활성화하는데 이 때 많은 에너지가 요구된다(Wang et al., 2021). 대부분의 생물은 섭식 활동과 소화작용을 통해 에너지를 얻으며, 이 과정에서 고분자 물질을 분해하기 위해 다양한 소화효소를 분비한다(Lee and Lee, 2020). 선행 연구에서는 다양한 오염물질에 노출된 생물에서 에너지 요구가 증가됨에 따라 소화효소의 활성이 변화되는 것을 보고 함으로써, 소화효소 활성의 변화가 수환경 오염을 평가하는 데 유용한 지표임을 제시한 바 있다(Sonawane, 2017; Huang et al., 2020; Lee and Lee, 2020; Tariang et al., 2019).
기수산 물벼룩 Diaphanosoma celebensis는 해양 생태계의 1차 소비자로써 상위 영양단계의 생물에게 에너지를 전달하는 중요한 역할을 담당한다(Lee and Lee, 2020). 또한 독성물질에 대한 높은 민감성, 실험실 환경에서의 배양의 용이성, 약 4~5일의 짧은 생활사, 단성생식(parthenogenesis)으로 인한 개체 간의 유전적 동질성 등의 장점으로 인해 기존 연구들에서 생태독성연구를 위한 모델 생물 종으로 활용되어 왔다(Lee and Lee, 2020; Yoo et al., 2022).
본 연구에서는 대표적인 해양 오염물질인 수은(HgCl2)이 기수산 물벼룩 Diaphanosoma celebensis의 대사 관련 효소 유전자 전사 수준에서의 발현에 미치는 영향을 확인하고자 한다. 이를 위하여 수은을 48시간 동안 농도별로 처리한 후 해독 및 소화효소 mRNA의 발현의 변화를 확인하였다. 이는 해양 동물성 플랑크톤에 대한 미세플라스틱과 수은의 분자적 수준에서의 영향을 이해하는데 도움이 될 것이다.
재료 및 방법
1. 시험 생물
기수산 물벼룩 Diaphanosoma celebensis의 배양은 인공 해수염(Instant Ocean, Aquarium system, France)을 증류수에 녹인 후 0.2 μm 필터(Whatman, Maidstone, Kent, UK)를 이용해 여과하여 15 psu의 염도의 인공해수로 제조한 배양수를 사용하였다. 사육 조건은 생물 배양기를 통해 수온 25℃, 광주기 12:12 (light:dark)로 유지되었으며, 먹이원으로 해양 녹조류 Tetraselmis suecica를 1.0~2.0×107 cells/l의 농도로 매일 공급하였다.
2. 시험물질
실험에 사용한 수은은 mercury (II) chloride (HgCl2, 순도 ≥ 99.5%, Sigma-Aldrich, Louis, MO, USA) 입자 형태의 수은을 증류수에 녹여 1 mg/ml의 stock solution을 제조한 후 실험에 사용하였다.
3. 노출시험
수은의 노출에 따른 해독 및 소화효소 유전자의 mRNA 발현을 확인하기 위해 기수산 물벼룩 유생(< 24 h)을 3일 간 배양하여 4일 차 개체를 기존 급성독성시험 결과(Yoo et al., 2022)를 토대로 아치사 농도의 수은 용액에 노출하였다. 노출 그룹 당 200마리의 기수산 물벼룩이 사용되었으며, 0.2, 0.4 및 0.8 μg/l의 HgCl2 노출 용액(200 ml)에 48시간 노출되었다.
4. Quantitative real-time polymerase chain reaction (qRT-PCR)
수은에 48시간 노출된 기수산 물벼룩은 1.5 ml microtube에 옮겨 500 μl의 TRIzol 용액(Thermo Fisher Scientific Inc., USA)을 이용해 균질화 하였으며, 이후 제조사의 방법에 따라 total RNA를 추출하였다. Total RNA의 순도 및 농도는 NanoDrop (MaestroNano Pro, NaestroGen Inc., Taiwan)과 agarose gel electrophoresis를 통해 확인하였으며, A260/A280 비율이 1.7~2.0인 RNA를 실험에 사용하였다. cDNA는 ReverTra Ace qPCR RT Master Mix (Toyobo Co., Osaka, Japan)를 사용하여 제조사의 방법에 따라 총 500 ng의 RNA를 이용해 합성하였으며, 이후 TE buffer를 이용해 10배 희석하여 유전자 분석에 사용하였다.
기수산 물벼룩의 해독 효소 유전자 5종(cyp360A1, cyp361A1, cyp4AP3, cyp4C122, cyp370C5)과 소화효소 6종 [alpha amylase (AMY), alpha amylase related protein (AMY-like), trypsin (TRYP), chymotrypsin-like protein (CHY), lipase (LIP), pancreatic lipase-related protein (PLRP)]의 발현은 SYBR Master Mix (KAPA Bioassay System, USA)를 사용하여 CFX Connect Thermal Cycler (Bio-Rad Inc., Hercules, CA, USA)에서 분석하였다. Cyp 유전자의 프라이머 정보는 Table 1에 나타냈고, 소화효소 유전자 증폭을 위한 프라이머는 Lee와 Lee (2020)의 것을 사용하였다. qRT-PCR의 반응은 95℃에서 15초 변성 후, 95℃에서 10분과 60℃에서 1분씩 총 30 cycle을 진행하였다. 각 유전자의 qRT-PCR은 샘플 당 3회 반복하여 진행되었으며, 타겟 유전자의 상대적 발현은 housekeeping 유전자인 EF-1을 이용하여 보정하였으며, 2-ΔΔCt method (Livak and Schmittgen, 2001)에 의해 계산되었다.

5. 통계분석
해독 및 소화효소 유전자의 mRNA 발현은 SigmaPlot version 12.0 소프트웨어를 이용하여(Systat Software Inc., San Jose, CA, USA) 평균(mean) ± 표준편차(standard deviation, SD)로 표시하였으며, 각 노출물질에 대해 서로 다른 농도의 그룹간 통계적 유의성은 SPSS version 23.0 소프트웨어를 이용하여(SPSS Inc., Chicago, IL, USA) one-way analysis of variance (one-way ANOVA)로 비교하였다. 통계분석에서 통계적 유의성은 p < 0.05로 설정하였다.
결 과
1. CYP 유전자 발현의 변화
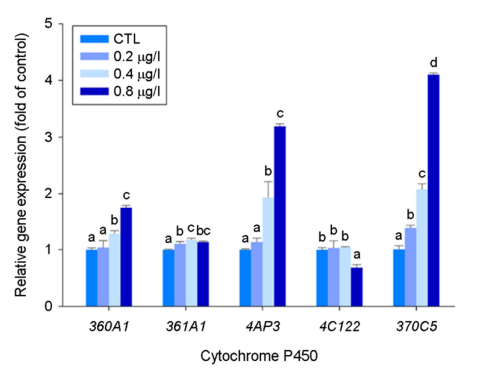
본 연구에서는 기수산 물벼룩의 cyp 유전자 5종에 대해 수은 노출에 따른 mRNA 발현 양상을 분석하였다. 그 결과 수은 노출은 cyp360A1, cyp4AP3, cyp370C5 mRNA의 발현을 농도 의존적으로 증가시켰으며, 특히 가장 높은 수은 농도(0.8 μg/l)에서 cyp4AP3과 cyp370C5 mRNA는 3배 이상 증가하는 양상을 보였다 (p < 0.05) (Fig. 1).
2. 소화효소 유전자 발현의 변화
수은 노출이 소화 경로에 미치는 영향을 조사하기 위하여 탄수화물(AMY, AMY-like), 단백질(TRYP, CHY), 지질(LIP, PLRP)을 분해하는 소화효소를 암호화하는 유전자 6종에 대한 mRNA 발현 변화를 분석하였다(Fig. 2). 수은을 노출한 결과 TRYP mRNA가 농도 의존적으로 가장 많이 발현되었고(p < 0.05), AMY와 CHY mRNA가 약간씩 유의적으로 증가하는 양상을 보였다. 반면 LIP과 PLRP mRNA는 수은 노출에 따라 농도 의존적으로 감소하는 양상을 보였다.

고 찰
CYP는 세포 내 다양한 물질(예, 스테로이드, 지방산, 호르몬)뿐 아니라 외부에서 유입되는 여러 화학물질 및 오염물질의 대사에 관여하는 해독효소이며, 일부 CYP 유전자는 steroidogenesis 경로에도 참여하는 것으로 알려져 있다(Nelson et al., 2004; Baldwin et al., 2009). 탈피 동물의 CYP 유전자는 4개의 clan 즉, clan2, clan3, clan4, 그리고 mitochondrial clan을 형성한다. 최근 Kim 등 (2021)은 기수산 물벼룩의 genome 분석을 통해 총 70개의 CYP 유전자를 동정하였고, 이들 유전자 모두 4개의 clan에 분포되어 있으며 진화적으로 잘 보존되어 있음을 보고한 바 있다.
본 연구에서는 Han과 Lee (2021)과 Kim 등 (2021)의 결과를 토대로 해독과 지방 대사에 관여하는 5종의 subfamily를 선정하여 수은 노출에 따른 발현 변화를 분석하였다. Cyp360과 cyp361은 clan3에 속하며 이에 속하는 cyp family는 해독에 관여하는 것으로 알려져 있다. 특히 cyp360 subfamily는 외부 유래물질의 해독 대사에 관여하는 대표적인 유전자이다. Cyp4AP3과 cyp4C122는 clan4에 속하는데 clan4는 xenobiotics의 대사뿐만 아니라 프로스타글란딘, 아라키돈산 등을 포함하는 여러 지방산의 대사에 관여하며, xenobiotics의 해독 뿐만 아니라 염증반응, 호르몬 합성 및 에너지 대사에 중요한 역할을 하는 것으로 알려져 있다(Hardwick 2008). Cyp370C5는 clan2에 속하는 유전자로 cyp370 subfamily는 cyp4와 함께 기수산 물벼룩에서 유전자 중복이 매우 많아 상대적으로 해독 과정에서 중요한 역할을 담당할 것으로 예상된다(Kim et al., 2021). 또한 cyp370 subfamily는 곤충에서 methyl farnesoate (MF)로부터 juvenile hormone III를 생성하는데 필수 적인 cyp15와 관련이 있다고 알려져 있다(Helvig et al., 2004). 그러나 갑각류에서는 MF가 최종 산물로 알려져 있어 cyp370 family의 역할은 연구가 필요하다(Baldwin et al., 2009).
기존 연구에서 중금속 노출에 따른 cyp 유전자의 발현 변화에 대해 보고된 바 있다(Table 2). 예를 들어, 중금속(카드뮴, 구리)과 벤조피렌에 노출된 D. celebensis에서 CYP360A1, CYP370A15, CYP4C122 등 유전자의 발현이 증가되는 양상을 보였다(Han and Lee, 2021). 요각류 Pseudodiaptomus annandalei에 카드뮴 노출 후 전사체 분석 결과 CYP mRNA의 발현이 증가하는 양상을 보였다(Kadiene et al., 2020). 붉은 늪 가재 Procambarus clarkii에 무기 수은을 노출시킨 후 전사체 분석을 한 결과 해독 과정에 Cyp1, 2, 4 superfamily의 mRNA 발현을 증가시킴으로써 Cyp가 수은의 해독에 중요한 역할을 할 것으로 제시한 바 있다(Zhang et al., 2022). 본 연구에서 수은 노출 후 cyp4AP3와 cyp370C5의 mRNA 발현이 증가함에 따라 상기 연구 결과와 함께 clan2와 clan4에 속하는 cyp 유전자가 금속의 해독 과정에서 중요한 역할을 담당할 것으로 보여진다.
에너지 대사는 생물의 성장, 발생, 생식에 필수적이며, 에너지 획득의 첫 단계는 갑각류에서 midgut gland의 특수 세포에서 생성되는 아밀라아제, 트립신, 리파아제 등과 같은 소화효소에 의해 조절된다(Watling and Thiel, 2013). 알파-아밀라아제는 탄수화물 소화에 중요한 기능을 수행하고, 트립신과 키모 트립신은 단백질 대사에 관여하며, 리파아제는 지방산과 글리세린에서 triglyceride의 분해에 관여한다(Lee and Lee, 2020).
Lee와 Lee (2020)의 보고에 따르면 수은을 포함한 여러 중금속 노출이 다양한 수서 무척추 생물의 소화효소 활성에 영향을 미친다. 그 중에 Daphnia magna에 수은을 48시간 노출 시 amylase의 활성이 증가하고, trypsin은 감소한 반면, 96시간 노출 시에는 큰 변화를 보이지 않았다. 한편 Chinese mitten crab Eriocheir sinensis의 경우 40일 간 수은 노출에 의해 amylase, tryptase 등 효소 활성이 감소하는 양상을 보였다(Zhao et al., 2010). 이와 관련하여 저자들은 수은 이온이 소화효소를 분비하는 hepatopancreas의 F 세포를 손상시킨 결과일 것으로 추정하였다. 기존의 대부분의 연구는 주로 소화효소의 활성에 초점이 맞춰져 있어서 유전자 발현에 대한 비교할 만한 자료가 부족하다. 본 연구에서 수은 노출은 유전자 수준에서 TRYP mRNA의 발현이 농도 의존적으로 크게 증가한 결과를 보였다. 최근 실험에서 비소에 노출된 기수산 물벼룩에서 트립신 활성이 감소한 반면, TRYP mRNA의 발현이 농도 의존적으로 유의하게 증가하는 양상을 보인 바 있다(unpublished data). 이는 금속 노출에 의한 독성으로부터 에너지 항상성 유지를 위해 trypsin 활성이 감소함에 따라 이를 보충하기 위한 기작으로 유전자 발현이 증가한 것으로 보여진다. 이와 유사하게 카드뮴에 노출된 D. magna에서도 소화효소 유전자의 mRNA 발현이 증가되었는데, 이에 대해 감소된 에너지 효율에 대한 보상 기전과 관련이 있다고 보고한 바 있다(Soetaert et al., 2007).
한편 지질 대사와 관련한 기수산 물벼룩 LIP과 PLRP mRNA는 농도 의존적으로 감소하는 양상을 보였다. 수은이 지질 대사 과정을 방해한다는 결과가 척추 동물에서 보고된 바 있다(Shi et al., 2018). 최근 수은에 노출된 기수산 물벼룩의 대사체 분석 결과에서도 수은이 산화적 스트레스로부터 막 손상을 보호하기 위해 지방산 대사 산물을 사용함에 따라 지방산 대사 산물의 양이 감소했다고 보고했다(Yoo et al., in press). 또한 비소에 노출된 기수산 물벼룩에서도 lipid 함량이 감소하였고, lipase 활성은 증가하였으며, 이때 LIP와 PLRP mRNA 발현양이 감소하는 경향을 보였다(unpublished data). mRNA 발현 양상과 단백질 활성은 반드시 일치하는 것은 아니기 때문에(Pradet-Balade et al., 2001), mRNA 발현 양상 만으로 수은의 영향을 설명하기는 어렵다. 그럼에도 불구하고 본 연구의 결과는 수은이 소화효소 유전자의 mRNA 발현을 조절함으로써 에너지 대사에 영향을 미칠 수 있음을 제시한다. 그러나 Table 3에서 보는 바와 같이 처리물질의 노출 시간, 농도 및 종에 따라 소화효소의 활성이 서로 다르게 반응하는 것으로 보아 향후 추가적인 연구가 필요하다.
본 연구에서는 무기 수은이 기수산 물벼룩의 대사에 관여하는 해독 효소와 소화효소 유전자의 발현에 미치는 영향을 분석하였다. 해독 효소 중에서는 clan2와 clan4에 속하는 유전자 cyp370C5와 cyp4AP3가 수은 해독에서 중요한 역할을 담당할 것으로 보인다. 한편 소화효소의 경우 특히 TRYP mRNA의 발현이 농도 의존적으로 증가함에 따라 수은이 에너지 대사에 영향을 미칠 수 있음을 제시한다.
- References
-
1. Bai Z, Wang N, Wang M. 2021. Effects of microplastics on marine copepods. Ecotoxicol Environ Saf 217: 112243.
-
2. Baldwin WS, Marko PB, Nelson DR. 2009. The cytochrome P450 (CYP) gene superfamily in Daphnia pulex. BMC Genom 10: 169.
-
3. Dai W, Du H, Fu L, Jin C, Xu Z, Liu H. 2008. Effects of Dietary Pb on Accumulation, Histopathology, and Digestive Enzyme Activities in the Digestive System of Tilapia (Oreochromis niloticus). Biol Trace Elem Res 127: 124-131.
-
4. De Coen W, Janssen C. 1997. The use of biomarkers in Daphnia magna toxicity testing II. Digestive enzyme activity in Daphnia magna exposed to sublethal concentrations of cadmium, chromium and mercury. Chemosphere 35: 1053-1067.
-
5. Feng W, Su S, Song C, Yu F, Zhou J, Li J, Jia R, Xu P, Tang Y. 2022. Effects of Copper Exposure on Oxidative Stress, Apoptosis, Endoplasmic Reticulum Stress, Autophagy and Immune Re- sponse in Different Tissues of Chinese Mitten Crab (Eriocheir sinensis). Antioxidants 11: 2029.
-
6. Gworek B, Bemowska-Kałabun O, Kijeńska M, Wrzosek-Jakubowska J. 2016. Mercury in Marine and Oceanic Waters—a Review. Water Air Soil Pollut 227: 371.
-
7. Gworek B, Bemowska-Kałabun O, Kijeńska M, Wrzosek-Jakubowska J. 2016. Mercury in Marine and Oceanic Waters—a Review. Water Air Soil Pollut 227: 371.
-
8. Han J, Lee KW. 2021. Identification and response of cytochrome P450 genes in the brackish water flea Diaphanosoma cele- bensis after exposure to benzo[α]pyrene and heavy metals. Mol Biol Rep 48: 657-664.
-
9. Hani YMI, Turies C, Palluel O, Delahaut L, Gaillet V, Bado-Nilles A, Porcher JM, Geffard A, Dedourge-Geffard O. 2018. Effects of chronic exposure to cadmium and temperature, alone or combined, on the threespine stickleback (Gasterosteus aculeatus): Interest of digestive enzymes as biomarkers. Aquat Toxicol 199: 252-262.
-
10. Helvig C, Koener JF, Unnithan GC, Feyereisen R. 2004. CYP15A1, the cytochrome P450 that catalyzes epoxidation of methyl farnesoate to juvenile hormone III in cockroach Corpora allata. Proc Natl Acad Sci USA 101: 4024-4029.
-
11. Henczová M, Deér AK, Filla A, Komlósi V, Mink J. 2008. Effects of Cu2+ and Pb2+ on different fish species: Liver cytochrome P450-dependent monooxygenase activities and FTIR spectra. Comp Biochem Physiol Part - C: Toxicol Pharmacol 148: 53-60.
-
12. Huang JN, Wen B, Zhu JG, Zhang YS, Gao JZ, Chen ZZ. 2020. Exposure to microplastics impairs digestive performance, stimulates immune response and induces microbiota dys- biosis in the gut of juvenile guppy (Poecilia reticulata). Sci Total Environ 733: 138929.
-
13. Kadiene EU, Ouddane B, Gong HY, Kim MS, Lee JS, Pan YJ, Hwang JS, Souissi S. 2020. Differential gene expression profile of male and female copepods in response to cadmium ex- posure. Ecotoxicol Environ Saf 204: 111048.
-
14. Kim DH, Choi BS, Kang HM, Park JC, Kim MS, Hagiwara A, Lee JS. 2021. The genome of the marine water flea Diaphanosoma celebensis: Identification of phase I, II, and III detoxification genes and potential applications in marine molecular ecotoxi- cology. Comp Biochem Physiol Part D Genomics Proteomics 37: 100787.
-
15. Lee J, Lee YM. 2020. Effects of heavy metals on the expression of digestive enzyme-coding genes in the brackish water flea Diaphanosoma celebensis. Toxicol Environ Health Sci 12: 363-370.
-
16. Li JS, Li JL, Wu TT. 2007. The effects of copper, iron and zinc on digestive enzyme activity in the hybrid tilapia Oreochromis niloticus (L.) × Oreochromis aureus (Steindachner). J Fish Biol 71: 1788-1798.
-
17. Li N, Zhao Y, Yang J. 2008. Effects of Water-Borne Copper on Digestive and Metabolic Enzymes of the Giant Freshwater Prawn Macrobrachium rosenbergii. Arch Environ Contam Toxicol 55: 86-93.
-
18. Livak, KJ, Schmittgen TD. 2001. Analysis of Relative Gene Expres- sion Data Using Real-Time Quantitative PCR and the 2-ΔΔCT Method. Methods 25: 402-408.
-
19. Neff JM. 2002. Mercury in the Ocean. Neff JM (ed.), Bioaccu- mulation in Marine Organisms. Elsevier, pp 103-130.
-
20. Nelson DR, Zeldin DC, Hoffman SM, Maltais LJ, Wain HM, Nebert DW. 2004. Comparison of cytochrome P450 (CYP) genes from the mouse and human genomes, including nomenclature recommendations for genes, pseudogenes and alternative-splice variants. Pharmacogenetics 14: 1-18.
-
21. Pradet-Balade B, Boulmé F, Beug H, Müllner EW, Garcia-Sanz JA. 2001. Translation control: bridging the gap between genomics and proteomics? Trends Biochem Sci 26: 225-229.
-
22. Sharma A, Sharma A, Arya RK. 2015. Removal of mercury (II) from aqueous solution: a review of recent work. Sep Sci Technol 50: 1310-1320.
-
23. Shi Q, Sun N, Kou H, Wang H, Zhao H. 2018. Chronic effects of mercury on Bufo gargarizans larvae: Thyroid disruption, liver damage, oxidative stress and lipid metabolism disorder. Ecotoxicol Environ Saf 164: 500-509.
-
24. Soetaert A, Vandenbrouck T, van der Ven K, Maras M, van Remortel P, Blust R, De Coen WM. 2007. Molecular responses during cadmium-induced stress in Daphnia magna: Integration of differential gene expression with higher-level effects. Aquat Toxicol 83: 212-222.
-
25. Sonawane SM. 2017. Effect of heavy metals on Digestive enzymes protease and invertase of Bivalve L. marginalis. IOSR Journal of Pharmacy 7: 25-31.
-
26. Tang QQ, Feng L, Jiang WD, Liu Y, Jiang J, Li SH, Kuang SY, Tang L, Zhou XQ. 2013. Effects of Dietary Copper on Growth, Digestive, and Brush Border Enzyme Activities and Antioxidant Defense of Hepatopancreas and Intestine for Young Grass Carp (Ctenopharyngodon idella). Biol Trace Elem Res 155: 370-380.
-
27. Tariang K, Ramanujam SN, Das B. 2019. Effect of arsenic (As) and lead (Pb) on glycogen content and on the activities of selected enzymes involved in carbohydrate metabolism in freshwater catfish, Heteropneustes fossilis. Int Aquat Res 11: 253-266.
-
28. Wang T, Long X, Cheng Y, Liu Z, Yan S. 2015. A Comparison Effect of Copper Nanoparticles versus Copper Sulphate on Juvenile Epinephelus coioides: Growth Parameters, Digestive Enzymes, Body Composition, and Histology as Biomarkers. Int J Genomics 2015: 1-10.
-
29. Wang T, Yang C, Zhang T, Liang H, Ma Y, Wu Z, Sun W. 2021. Immune defense, detoxification, and metabolic changes in juvenile Eriocheir sinensis exposed to acute ammonia. Aquat Toxicol 240: 105989.
-
30. Watling L, Thiel M. 2013. Feeding and digestive system. Watling L (ed.), Functional morphology and diversity. Oxford University Press, Oxford, pp 237-260.
-
31. Wu D, Liu Z, Cai M, Jiao Y, Li Y, Chen Q, Zhao Y. 2019. Molecular characterisation of cytochrome P450 enzymes in waterflea (Daphnia pulex) and their expression regulation by poly- styrene nanoplastics. Aquatic Toxicology 217: 105350.
-
32. Wu H, Xuan R, Li Y, Zhang X, Wang Q, Wang L. 2012. Effects of cadmium exposure on digestive enzymes, antioxidant en- zymes, and lipid peroxidation in the freshwater crab Sino- potamon henanense. Environ Sci Pollut Res Int 20: 4085-4092.
-
33. Xie D, Li Y, Liu Z, Chen Q. 2019a. Inhibitory effect of cadmium exposure on digestive activity, antioxidant capacity and immune defense in the intestine of yellow catfish (Pelteo- bagrus fulvidraco). Comp Biochem Physiol Part - C: Toxicol Pharmacol 222: 65-73.
-
34. Xie Z, Luan H, Zhang Y, Wang M, Cao D, Yang J, Tang J, Fan S, We X, Hua R. 2019b. Interactive effects of diclofenac and copper on bioconcentration and multiple biomarkers in crucian carp (Carassius auratus). Chemosphere 242: 125141.
-
35. Yan T, Teo LH, Sin YM. 1996. Effects of metals on α-amylase activity in the digestive gland of the green mussel, Perna viridis L. Bull Environ Contam Toxicol 56: 677-682.
-
36. Yang J, Liu D, Jing W, Dahms HU, Wang L. 2013. Effects of Cad- mium on Lipid Storage and Metabolism in the Freshwater Crab Sinopotamon henanense. PLoS ONE 8: e77569.
-
37. Yoo JW, Bae HJ, Jeon MJ, Jong TY, Lee YM. 2022. Metabolomic analysis of combined exposure to microplastics and methyl- mercury in the brackish water flea Diaphanosoma celebensis. Environ Geochm Health. 10.1007/s10653-022-01435-1.
-
38. Yoo JW, Jeon MJ, Lee KW, Jung JH, Jeong CB, Lee YM. 2022. The single and combined effects of mercury and polystyrene plastic beads on antioxidant-related systems in the brackish water flea: toxicological interaction depending on mercury species and plastic bead size. Aquat Toxiol 252: 106325.
-
39. Zhang J, He Y, Yan X, Qu C, Li J, Zhao S, Wang X, Guo B, Liu H, Qi P. 2019. Two novel CYP3A isoforms in marine mussel Mytilus coruscus: identification and response to cadmium and benzo[a]pyrene. Aquat Toxicol 214: 105239.
-
40. Zhang L, Gan J, Ke C, Liu X, Zhao J, You L, Yu J, Wu H. 2012. Iden- tification and expression profile of a new cytochrome P450 isoform (CYP414A1) in the hepatopancreas of Venerupis (Ruditapes) philippinarum exposed to benzo[a]pyrene, cad- mium and copper. Environ Toxicol Pharmacol 33: 85-91.
-
41. Zhang L, Zhou Y, Song Z, Liang H, Zhong S, Yu Y, Liu T, Sha H, He L, Gan, J. 2022. Mercury Induced Tissue Damage, Redox Metabolism, Ion Transport, Apoptosis, and Intestinal Micro- biota Change in Red Swamp Crayfish (Procambarus clarkii): Application of Multi-Omics Analysis in Risk Assessment of Hg. Antioxidants 11: 1944.
-
42. Zhao Y, Wang X, Qin Y, Zheng B. 2010. Mercury (Hg2+) effect on enzyme activities and hepatopancreas histostructures of juvenile Chinese mitten crab Eriocheir sinensis. Chin J Oceanol Limnol 28: 427-434.
-
43. Zheng N, Wang S, Dong W, Hua X, Li Y, Song X, Chu Q, Hou S, Li Y. 2019. The Toxicological Effects of Mercury Exposure in Marine Fish. Bull Environ Contam Toxicol 102: 714-720.
-
44. Hardwick JP. 2008. Cytochrome P450 omega hydroxylase (CYP4) function in fatty acid metabolism and metabolic diseases. Biochem Pharmacol 75: 2263-2275.












