JMLS 2022 December;7(2):129-138. 10.23005/ksmls.2022.7.2.129 Epub 2022 December 14
Copyright © 2022 by The Korean Society of Marine Life Science
Effects on Lethal Concentration 50%, Hematological Parameters and Plasma Components of Crucian carp, Carassius carassius Exposed to Waterborne Zinc
Ji-Ho Jeong; Sun Moon University, Department of Aquatic Life and Medical Science, Asan 31460, Korea
Chang-Hoon Joo; Sun Moon University, Department of Aquatic Life and Medical Science, Asan 31460, Korea
A-Hyun Jo; Sun Moon University, Department of Aquatic Life and Medical Science, Asan 31460, Korea
Su-Min Hong; Sun Moon University, Department of Aquatic Life and Medical Science, Asan 31460, Korea
Yun-A Ryu; Sun Moon University, Department of Aquatic Life and Medical Science, Asan 31460, Korea
Seock-Won Jo; Sun Moon University, Department of Aquatic Life and Medical Science, Asan 31460, Korea
Jun-Hwan Kim; Sun Moon University, Department of Aquatic Life and Medical Science, Asan 31460, Korea
- Abstract
붕어(무게 42.4 ± 9.0 g, 길이 15.0 ± 1.0 cm)를 96시간 동안 0, 5, 10, 20, 40 및 80 mg Zn2+/l의 수인성 아연에 노출시켰다. 수인성 아연에 노출된 붕어의 96시간 반수치사농도(LC50)는 51.58 mg Zn2+/l였다. 혈액학적 지표에서 48시간에 40 mg Zn2+/l 농도에서 RBC 수치가 유의하게 감소한 반면, 헤마토크릿은 아연 노출에 의해 유의하게 증가하였다. MCV (μl)와 MCH (pg)는 40 mg Zn2+/l 농도에서 48시간에 유의하게 증가하였다. 칼슘, 마그네슘, 포도당, 콜레스테롤, 총 단백질 및 ALT와 같은 혈장 성분은 아연 노출에 의해 크게 변화되었다. 본 연구의 결과는 붕어에 대한 아연 노출이 독성으로서 혈액학적 매개변수 및 혈장 성분의 유의한 생리학적 변화를 유발함을 시사한다.
Crucian carp, Carassius carassius (Weight 42.4 ± 9.0 g, Length 15.0 ± 1.0 cm) were exposed to waterborne zinc at 0, 5, 10, 20, 40 and 80 mg Zn2+/l for 96 hours. The lethal concentration 50 (LC50) at 96 hours of crucian carp, C. carassius exposed to waterborne zinc was 51.58 mg Zn2+/l. In hematological parameters, the RBC count was significantly decreased in the concentration of 40 mg Zn2+/l at 48 hours, whereas the hematocrit was significantly increased by zinc exposure. The MCV (mean corpuscular volume) (µl) and MCH (mean corpuscular hemoglobin) (pg) were significantly increased in the concentration of 40 mg Zn2+/l at 48 hours. The plasma components such as calcium, magnesium, glucose, cholesterol, total protein and ALT (Alanine aminotransminase) were significantly changed by zinc exposure. The results of this study suggest that the zinc exposure to C. carassius induced the significant physiological changes in the hematological parameters and plasma components as toxicity.
Keywords: Zinc exposure(아연 노출) LC50(반수치사농도) Hematological parameters(혈액 성상) Plasma components(혈장 성분) Mirror carp(붕어)
Correspondence to: Jun-Hwan Kim; Sun Moon University, Department of Aquatic Life and Medical Science, Asan 31460, Korea
- Received
- 17 October 2022;
- Revised
- 31 October 2022;
- Accepted
- 17 November 2022.
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Language: Korean/English,
Full Text:

서 론
아연은 지표면에 다량 존재하는 성분으로 자연적으로 발생하기도 하지만, 최근 급속히 진행되고 있는 화력 발전소, 광산 배수, 산업 및 도시 폐기물과 같은 인위적인 산업활동에 의해 수중 환경으로 유입되고 있다(Sankhla et al., 2019). 아연은 대부분의 생물체의 필수 미량 금속으로 탄산무수화효소, 카복시 펩티데이스 및 수소화 효소에 필요하며, 아미노산 측쇄에 결합된 금속 생체 분자의 촉매로 체내에서 사용되어 아연 금속 단백질과 금속 효소를 형성하고, 산화방지 및 항염증 작용과 전사 인자, 면역 조절, 성장 및 세포 보호의 기능을 한다(Franco et al., 2006; Andres et al., 2000). 아연은 우리나라 수환경에서 다양한 분포를 보이며, 방류수 수질기준은 1 mg/l으로 지정되어있지만, 배관에서 용출된 아연에 의하여 수돗물에서 높은 수준으로 존재할 수 있다(Kim, 2004; Yu et al., 2008). 수중 환경에서 높은 수준의 아연의 노출은 수인성, 경구 및 퇴적물 등의 경로를 통해 어류의 주요 조직 내에 유입되어 축적될 수 있으며, 기준치 이상의 아연은 어류에게 독성으로 작용할 수 있다(Canli and Atli, 2003; Shah, 2017; Velcheva, 2006).
아연과 같은 금속의 과도한 노출은 어류의 주요 장기에 축적되어 어류의 행동학적 장애를 유발하며, 고농도로 축적된 금속은 효소, DNA, RNA 및 세포 단백질 등과 반응하여 어류의 생리적 활동에 독성 영향을 미친다(Shah et al., 2020). 또한 높은 수준의 아연 노출은 어류의 다양한 대사 과정에 악영향을 미쳐 발달 지연, 형태학적 및 기능학적 기형을 유발하고(Sfakianakis et al., 2015), 삼투기능 장애와 조직의 형태 변화를 일으킬 수 있다(Qu et al., 2014). 낮은 수준의 아연은 금속 결합 단백질인 metallothionein에 의해 독성을 차단하지만, 높은 수준의 아연 노출은 어류의 칼슘흡수방해로 인한 저칼슘혈증 및 Na/K-ATPase를 억제로 인한 산-염기 항상성 교란 등 생리적 독성으로 작용할 수 있다(Hogstrand et al., 2002; McRae et al., 2016).
반수치사농도(LC50, Lethal Concentration 50%)는 독성 노출실험에서 노출 기간 내에 실험어의 50% 폐사를 일으키는 물질의 농도를 의미하며, 이는 실험어의 생존에 대한 잠재적 영향을 통해서 환경에 대한 어류의 영향을 판단할 수 있게 한다(Rufli, 2012). 반수치사농도를 통해 독성물질 노출에 따른 독성 영향을 평가할 수 있으며, 실험생물의 독성물질에 대한 내성한계 및 실험생물과 독성물질의 상관관계에 대한 기준을 정립할 수 있다. 아연 노출에 의한 독성 영향은 생물학적 요인(어체의 크기, 성별, 연령, 식성, 생리적 상태), 수질 환경적 요인(수온, pH, 용존 산소 농도, 부유물질), 독성물질의 요인(노출 농도, 화학적 구조, 특성(지용성 또는 수용성) 등)에 의해 영향을 받는다(Elnabris et al., 2013). 따라서, 다양한 환경적 변수를 고려한 반수치사농도의 정확한 산정은 독성물질에 대한 이해와 기준을 제시해주는 주요한 지표가 될 것이다.
어류에서 혈액학적 성상은 일반적인 건강 상태를 확인하는 중요한 생리적 지표로 작용할 수 있으며, 다양한 환경성, 영양성 및 감염성 질병으로 인한 스트레스 및 생리적 교란을 평가할 수 있는 가장 민감하고 신뢰성 높은 지표이다(Fazio, 2019). 일반적으로 아연과 같은 독성물질이 수중에 존재하면, 아가미 및 장 상피세포를 통해 어류 체내로 유입이 일어나게 되고, 이후 순환계로 들어와 혈액학적 성상에 직접적인 영향을 유발하게 된다(Modesto and Martinez, 2010; Saravanan et al., 2011). 높은 수준의 아연 노출은 어류 혈액 성상에 치명적인 독성으로 상피세포 변형 및 아가미 조직 곤봉화와 같은 형태학적 변화로 인해 저산소증, 가스 교환 장애 및 이온 교란 등을 초래할 수 있다(Kim et al., 2019). 따라서 혈액학적 성상의 확인을 통해 아연 노출이 어류에 미치는 독성생리에 대한 분석 및 이해가 가능할 것이다.
붕어(Crucian carp, Carassius carassius)는 전 세계 널리 분포하며 다양한 수중 환경에서 서식하고 적응력이 강하여 작은 호수나 연못 등에서 흔하게 발견되는 어종이다(Vøllestad et al., 2004). 붕어는 환경내성이 높은 민물성 잡식 어종으로 육질이 좋고, 영양 성분이 높아 양식 어종으로 많이 이용되고 있다(Yang et al., 2021). 그리고 최근에는 낚시와 같은 레저활동이 늘어나면서 식용으로의 생산 뿐만 아니라 취미로 이용되고 있어 붕어에 대한 경제적 가치는 점점 더 높아지고 있다(Harper et al., 2019). 하지만 붕어의 수인성 아연 급성 노출에 따른 독성 기준 지표에 대한 연구는 거의 이루어지지 않고 있다. 따라서 본 실험의 목적은 수인성 아연 급성 노출에 의한 붕어의 혈액학적 성상 및 혈장 성분을 통해 생리적 독성 영향을 평가하고, 반수치사농도의 확인을 통해 수인성 아연 독성에 대한 내성한계 및 기준을 제시하는 데 있다.
재료 및 방법
1. 실험어 및 실험 환경
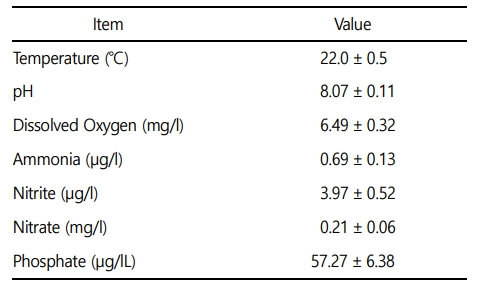
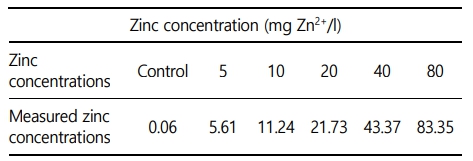
본 실험에 이용된 붕어(무게 42.4 ± 9.0 g, 전장 15.0 ± 1.0 cm)는 충남 아산 인근의 양식장에서 분양받아 실험실 환경에서 사육 양성한 개체를 이용하였다. 실험은 실험 전 2주간 실험실 환경에서 순치를 실시하였으며, 실험수조는 30 ℓ 유리 사각수조를 이용하여, 6개의 농도 구간(0, 5, 10, 20, 40 및 80 mg Zn2+/l)으로 96시간 급성 노출을 실시하였다. 실제 환경에서 수중 아연의 농도는 본 실험의 농도보다 매우 낮은 정도이지만, 아연 독성에 대한 생물 독성 기준 지표를 수립하고, 독성 영향을 평가하기 위해 사전 노출실험을 통해 영향 농도로 농도 구간을 설정하였다(Papagiannis et al., 2004). 실험은 총 60마리(아연 농도 구간 6개 × 실험 구간 당 5마리 × 반복구 2개)를 이용하여 노출을 진행하였으며, 실험 기간 중 수질(수온, 용존 산소 및 pH)은 휴대용 수질 분석기(YSI- Professional plus, YSI Inc., USA)를 이용하여 측정하였으며, 암모니아, 아질산, 질산 및 인산염은 수질환경분석법(해양수산부)을 이용하여 분석을 실시하였다(Table 1). 본 연구에서 아연 노출은 염화아연(ZnCl2, Zinc chloride)을 이용하여, 표준원액 10,000 mg Zn2+/l를 만들었으며 각 수조에 농도에 맞게 노출을 실시하였으며, 아연 농도 구간별 실제 아연 농도는 Table 2와 같다.
2. 반수치사농도(LC50)
수인성 아연의 반수치사농도를 결정하기 위해서 50%의 폐사를 유발하는 독성 영향 농도를 추정해야 하며, 이를 위해 사전 노출실험을 진행하여 실험 농도를 설정하였다(Vidya and Chitra, 2017). 수인성 아연 노출 후 0, 1, 3, 6, 12, 24, 48, 72 및 96시간 수조 별 폐사 유무를 확인하였으며, 폐사 개체는 관찰 즉시 제거해주었다. 96시간 후 아연 노출에 의한 최종 폐사 개체를 바탕으로 통계프로그램(SPSS Inc, Chicago, IL, USA, probit model)을 이용하여 반수치사농도 수치를 산출하였다.
3. 혈액 성상
혈액학적 분석은 수인성 아연 노출 96시간 후 살아있는 개체를 이용하여 채혈을 실시하였다. 채혈은 헤파린(Sigma Chemical, St. Louis, MO, USA) 처리된 주사기를 사용하였으며, 채혈 직후 헤모글로빈(Hemoglobin), 적혈구 용적(Hematocrit) 및 적혈구수(RBC count)를 즉시 분석하였다. Hemoglobin 수치는 임상용 kit (Asan Pharm. Co., Ltd)를 이용하여 Cyan-methemoglobin 법으로 측정하였다. Hematocrit는 모세관 내로 혈액을 넣어, Microhematocrit centrifuge (VS-12000, Korea)에서 12,000 rpm, 10분간 원심분리 후 Micro-hematocrit reader를 이용하여 측정하였다. RBC count는 Hendrick's diluting solution으로 혈액을 400배 희석 후, hemo-cytometer (Improved Neubauer, Germany)를 이용하여 광학현미경으로 계수하였다.
Hemoglobin, hematocrit 및 RBC count 결과를 바탕으로 평균적혈구용적(MCV: mean corpuscular volume), 평균적혈구혈색소량(MCH: mean corpuscular hemoglobin) 및 평균적혈구헤모글로빈농도(MCHC: mean corpuscular hemoglobin concentration)는 아래의 방식으로 산출하였다.
MCV (µl) = Hematocrit (%) / 적혈구수(107/ µl) × 10
MCH (pg) = Hemoglobin (g/dl) / 적혈구수(107/ µl) × 10
MCHC (%) = Hemoglobin (g/dl) / Hematocrit (%) × 100
4. 혈장성분 분석
수인성 아연 노출에 따른 혈장 성분의 변화를 분석하기 위해 채취한 혈액을 4℃에서 3000 x g로 15분간 원심분리 후 혈장을 분리하였다. 혈장 무기성분으로 칼슘(Calcium), 마그네슘(Magnesium)을 측정하였다. 칼슘은 OCPC법, 마그네슘은 Xylidyl blue-I 법에 따라 임상용 kit (Asan Pharm. Co., Ltd)를 이용하여 측정하였다. 혈장 유기성분으로 혈당(Glucose), 콜레스테롤(Cholesterol) 및 총 단백질(Total protein)을 측정하였다. 혈당은 GOD/POD법, 콜레스테롤은 비색법, 총 단백질은 Biuret법에 의해 시판되고 있는 임상용 kit (Asan Pharm. Co., Ltd)를 이용하였다. 혈장 효소활성으로 ALT (Alanine aminotransminase) 및 ALP (Alkaline phosphatase)를 측정하였다. ALT는 505 nm에서 Reitman-Frankel법, ALP는 King-King법으로 500 nm에서 임상용 kit (Asan Pharm. Co., Ltd)를 이용하여 분석하였다.
5. 통계분석 방법
본 실험분석은 수인성 아연 각 농도 구간에서 5마리를 분석에 이용하였고, 모든 실험분석은 3반복 분석으로 이루어졌다. 실험분석 결과에 대한 통계학적 유의성은 SPSS 통계 프로그램(SPSS Inc.)을 이용하여 ANOVA test를 실시하여 Duncan's multiple range test를 통해 p < 0.05 일 때 유의성이 있는 것으로 간주하였다.
6. 동물실험윤리 승인
본 실험은 선문대학교 동물실험윤리위원회를 통해 실험방법 및 진행이 동물실험윤리에 적합하다는 승인(SM-2022-04-01)을 통해 연구가 수행되었으며, 연구 참가자들은 동물복지 및 동물실험에 대한 교육을 받았습니다.
결 과
1. 생존율 및 반수치사농도(LC50)
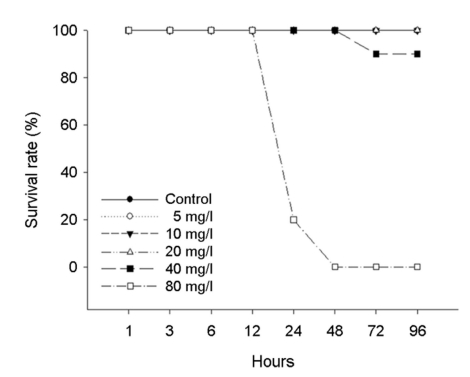
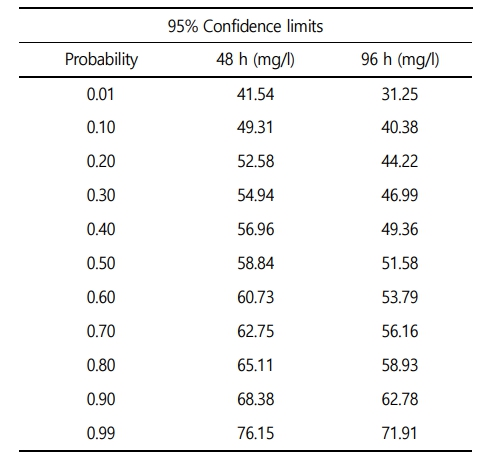
수인성 아연 노출에 따른 붕어의 생존율은 Fig. 1에 나타내었다. 대조구에서 20 mg Zn2+/l의 노출에서는 폐사 개체는 발견되지 않았으며, 40 mg Zn2+/l의 아연 노출에서는 노출 72시간에 10%의 폐사가 관찰되었다. 그리고 80 mg Zn2+/l의 아연 노출에서는 노출 24시간에 80%가 폐사했으며, 노출 48시간에 100% 폐사를 나타내었다. 수인성 아연 노출에 따른 붕어의 반수치사농도(Lethal concentration 50, LC50)는 Table 3에 나타내었다. 수인성 아연 노출에 따른 붕어의 96시간 반수치사농도는 51.58 mg Zn2+/l로 나타났다.
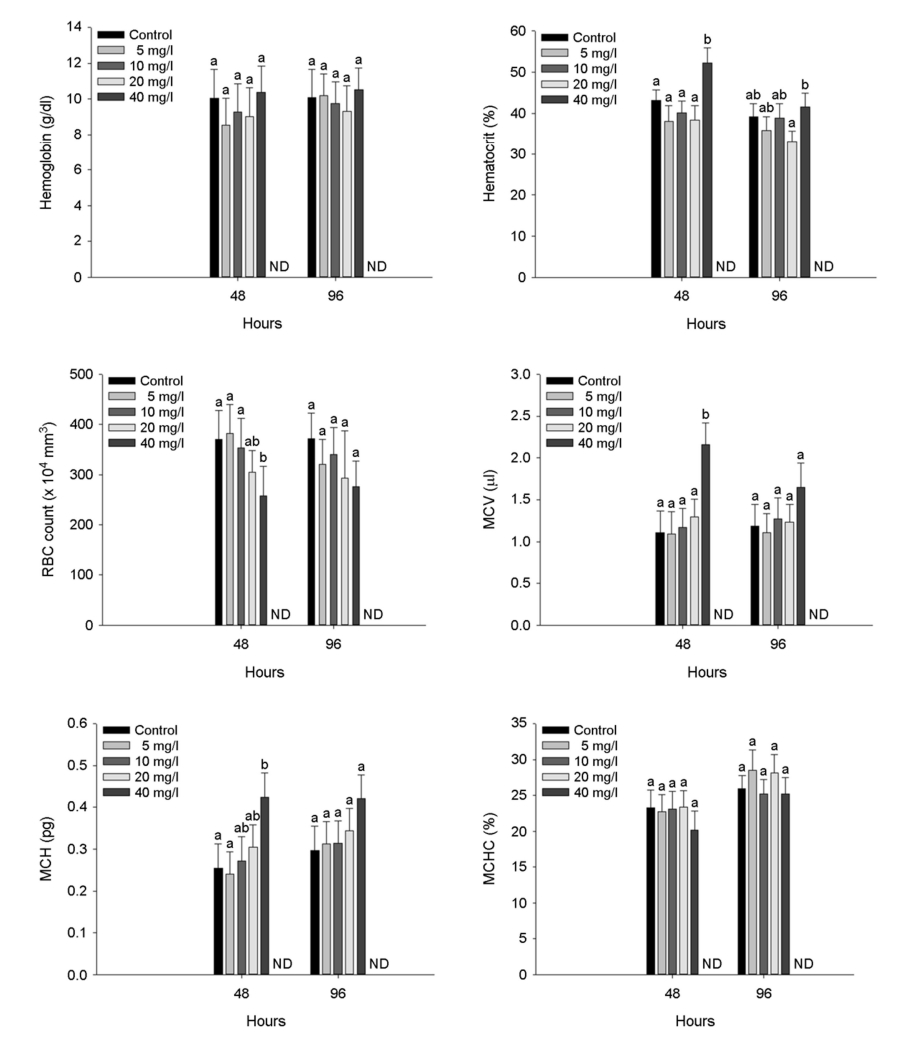
2. 혈액학적 성상
수인성 아연 노출에 따른 붕어의 혈액학적 성상은 Fig. 2에 나타내었다. 붕어의 hemoglobin concentration은 수인성 아연 노출에 의한 유의적 변화는 나타나지 않았다. 하지만, 붕어의 hematocrit value는 수인성 아연 노출에 의해 유의적인 증가가 나타났다(p < 0.05). RBC count는 48시간 수인성 아연 노출 40 mg Zn2+/l에서 유의적인 감소가 나타났으나(p < 0.05), 노출 96시간에서는 유의적인 변화는 나타나지 않았다. Hemoglobin, hematocrit 및 RBC count 결과를 바탕으로 MCV (µl)는 40 mg Zn2+/l에서 유의적 증가가 나타났으며, MCH (pg)은 노출 48시간에서만 유의적 증가가 나타났다(p < 0.05). 하지만, MCHC (%)는 수인성 아연 노출에 따른 유의적인 변화는 나타나지 않았다.
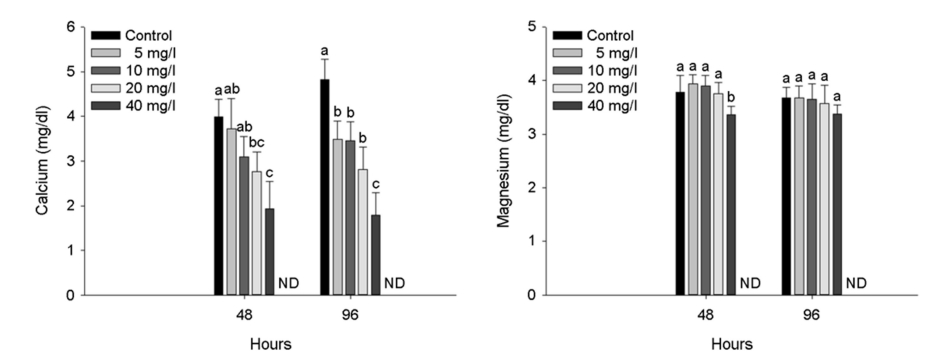
3. 혈장 성분
수인성 아연 노출에 따른 붕어의 혈장 무기성분은 Fig. 3에 나타내었다. 혈장 calcium은 수인성 아연 노출에 따른 유의적인 감소가 나타났다(p < 0.05). 하지만, 혈장 magnesium에서는 노출 48시간 아연 노출 40 mg Zn2+/l에서 유의적인 감소가 나타났지만(p < 0.05), 노출 96시간에서는 노출에 따른 유의적인 변화는 나타나지 않았다.
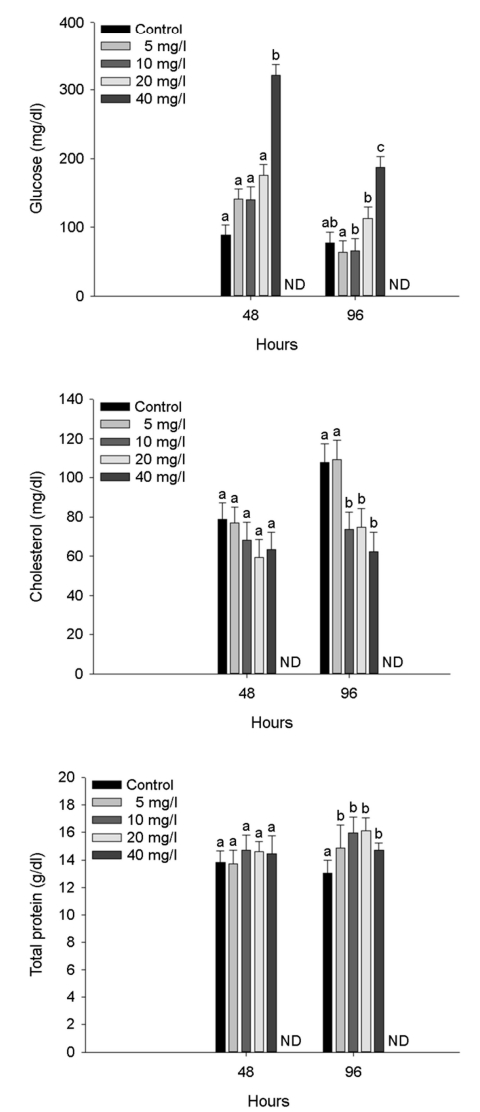
수인성 아연 노출에 따른 붕어의 혈장 유기성분은 Fig. 4에 나타내었다. 혈장 glucose는 아연 노출 48시간 40 mg Zn2+/l 및 노출 96시간 20 mg Zn2+/l 이상의 농도에서 유의적인 증가가 나타났다(p < 0.05). 혈장 cholesterol은 아연 노출 96시간 10 mg Zn2+/l 이상의 농도에서 유의적인 감소가 나타났다(p < 0.05). 혈장 total protein은 아연 노출 96시간 5 mg Zn2+/l 이상의 농도에서 유의적인 증가를 나타내었다(p < 0.05).
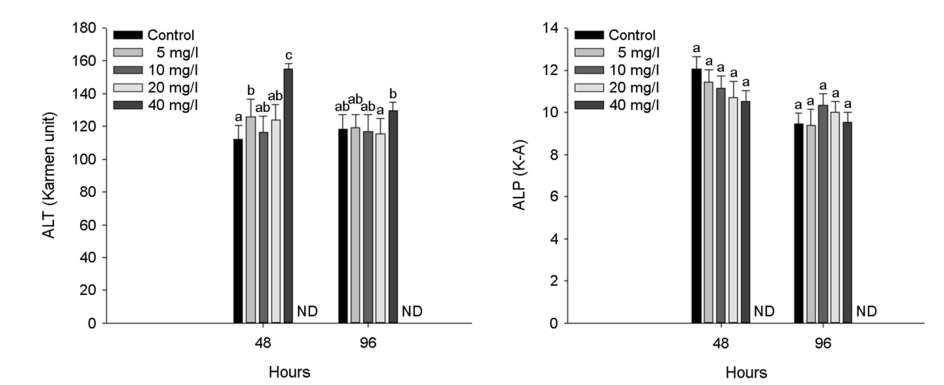
수인성 아연 노출에 따른 붕어의 혈장 효소성분은 Fig. 5에 나타내었다. 혈장 ALT는 아연 노출 48시간 5 mg Zn2+/l 이상의 농도에서 유의적인 증가를 나타내었으며, 아연 노출 96시간 40 mg Zn2+/l의 농도에서 유의적인 증가를 나타내었다(p < 0.05).
고 찰
아연은 어류의 필수 구성요소로 작용하여 생리적 작용에 필수요소이지만, 수생태계 높은 수준의 아연은 어류의 산-염기 및 이온 조절 장애, 아가미 조직 파괴 및 저산소증 등 다양한 잠재적인 독성물질로 작용한다(Javed et al., 2008). 본 연구에서 수인성 아연 노출에 따른 붕어의 폐사는 40 mg Zn2+/l에서부터 나타났으며, 80 mg Zn2+/l에서 100% 폐사를 나타내었다. 48시간 수인성 아연 노출에 따른 붕어의 반수치사농도는 58.84 mg Zn2+/l로 나타났고, 96시간 수인성 아연 노출에 따른 붕어의 반수치사농도는 51.58 mg Zn2+/l로 나타났다. Abdel-Warith et al. (2011)는 Nile tilapia, Oreochromis niloticus (L.) (weight 4.6 ± 0.2 g)의 수인성 아연 노출에 따른 96시간 반수치사농도가 63.98 mg Zn2+/l이라고 보고했다. Palaniappan et al. (2010)은 Indian major carp, Labeo rohita (length 6 ± 1 cm, weight 7 ± 1 g)의 수인성 아연 노출에 따른 따른 96시간 반수치사농도가 29.40 mg Zn2+/l이라고 보고했다. 이와 유사하게 많은 어류에서 비슷한 수준의 96시간 반수치사농도 결과[African catfish, Clarias gariepinus (length 18.1~22.7 cm, weight 50.6~97.4 g): 36.70 mg Zn2+/l; Javeline goby, Synechogobius hasta (weight 35.83 ± 3.79 g): 72.00 mg Zn2+/l]를 보고하였다(Ololade and Ogini, 2009; Zheng et al., 2011). 하지만, 초기 단계의 어류에서는 낮은 수준의 반수치사농도[Indian major carp, Labeo rohita fry: 6.60 mg Zn2+/l; zebrafish, Danio rerio embryo: 2.31 mg Zn2+/l]를 보고하였다(Horie et al., 2020; Madhusudan et al., 2003). 수인성 아연 노출에 따른 어류의 반수치사농도는 어류의 종, 발달단계 및 크기에 의해 다양하게 보고되고 있다. 수인성 아연 노출에 따른 독성 영향은 같은 종 및 크기라고 하더라도, 수온, pH, 경도 등 수질 환경적 요소에 의해 영향을 받을 수 있기 때문에, 환경적 요소를 고려한 독성평가가 필요할 것이다.
어류의 혈액학적 성상은 독성물질의 노출에 의한 비정상적인 반응 및 병적 증상을 판단할 수 있는 신속하고도 신뢰성 높은 지표이며, 특히 아연 노출은 어류의 조혈활성과 밀접한 연관성을 통해 혈액학적 성상에 직접적인 영향을 미칠 수 있다(Khan et al., 2022). 본 연구에서 수인성 아연 노출에 따른 붕어의 혈액학적 성상 중 hematocrit value는 유의적 증가를 나타내었다. 적혈구 용적은 다양한 스트레스 반응에 의해 삼투압 불균형 및 항상성 변화에 의한 팽창이 일어나거나, 반대로 혈농축에 의해 감소될 수 있다(Ololade and Ogini, 2009). 하지만, 수인성 아연 노출에 따른 붕어의 RBC count는 노출 48시간 유의적 감소를 나타내었지만, 이후 96시간 노출에서는 유의적 변화는 나타나지 않았다. 독성물질 노출에 따른 적혈구 수의 감소는 적혈구 용해 및 생성 억제에 따른 것으로 판단되며, Kim and Kang (2015) 역시 납 노출에 따른 rock fish, Sebastes schlegelii의 적혈구의 감소를 보고하였다. 본 연구에서 수인성 아연에 노출된 붕어의 적혈구 수의 감소와 반대로 적혈구 용적은 증가하여, 평균적혈구용적 및 평균적혈구혈색소량은 유의적으로 증가하였다. Çelik et al. (2013) 역시 수인성 아연에 노출된 Mozambique tilapia, Oreochromis mossambicus의 적혈구 수 감소 및 적혈구 용적의 증가에 따른 MCV 및 MHC의 유의적 증가를 보고했으며, 이는 아연 노출에 따른 독성으로 적혈구 생성 억제 및 용혈로 인해 적혈구 수는 감소했지만, 적혈구 세포의 swelling에 따른 결과에 의한 것이라고 보고했다. Witeska (2005) 역시 금속 노출(납, 구리, 카드뮴 및 아연)에 따른 독성 영향으로 common carp, Cyprinus carpio에서 적혈구 수의 유의적 변화는 나타나지 않았지만, 적혈구 용적에서 유의적 증가가 나타남을 보고하였다. Remyla et al. (2008)는 어류에서 독성물질의 노출은 적혈구 생성 속도의 감소를 유발할 수 있으며, 헤모글로빈 함량의 증가는 아가미 손상에 따른 저산소증으로 인한 손상된 호흡 효율을 보상하기 위한 일시적인 과잉 생산이 일어날 수 있다고 주장했다. 본 연구에서 수인성 아연 노출에 따른 붕어의 감소된 적혈구 수에도 헤모글로빈 함량이 적정 수준을 유지한 것은 손상에 따른 보상효과로 인한 일시적인 증가에 의한 것으로 판단된다.
어류 혈장 calcium은 신경 자극, 소포 분비, 골격 재생뿐만 아니라 심박동에서 적절한 기능을 수행하며, 다양한 독성물질 노출에 의해 변화하여 독성 노출에 따른 생리적 변화를 평가하는 중요한 지표로 이용된다(Cao et al., 2020). 본 연구에서 수인성 아연 노출에 의한 붕어의 혈장 calcium은 유의적인 감소가 나타났다. McRae et al. (2016)는 수인성 아연 노출에 따른 galaxiid fish, Galaxias maculatus의 혈장 calcium의 유의적 감소를 보고했으며, 이는 수중의 아연이 어류의 칼슘 채널을 통한 수중의 칼슘의 유입을 경쟁적으로 작용하여 칼슘의 유입을 차단하며, 어류 체내로 유입된 칼슘 역시 아연이 Ca-ATPase를 억제함으로써 칼슘의 억제를 유발할 수 있다고 주장했다. Puar et al. (2020) 역시 수인성 아연이 초기 단계의 zebrafish, Danio rerio의 아가미에서 칼슘 수송경로에서 칼슘과 경쟁적으로 작용하여, 어류 체내의 칼슘 항상성 붕괴 및 저칼슘혈증을 유발한다고 보고했다.
어류 혈장 magnesium은 어류의 주요한 세포 내 혈장 무기성분으로, ATP 복합체를 형성하고, 단백질 합성, 세포 복제 및 에너지 대사뿐만 아니라 신경전도, 근육 수축 및 칼륨 수송에 관여하는 주요한 성분이다(Lall and Kaushik, 2021). 본 연구에서는 노출 48시간에서 일시적인 감소는 나타났지만, 노출 96시간 유의적 변화는 나타나지 않았다.
어류 혈장 glucose는 일반적으로 모든 어류의 탄수화물 대사에 중요한 역할로 독성 노출에 따른 어류의 스트레스를 평가하는 주요한 지표로, 어류의 glucocorticoids와 catecholamine은 스트레스 상황에서 더 많은 양이 분비되어 증가할 수 있다(Kim and Kang, 2015). Tuncsoya et al. (2016)는 수인성 아연에 따른 African sharp- tooth, Clarias gariepinus의 혈장 glucose 증가를 보고했으며, 이는 아연 노출에 따른 간과 근육의 글리코겐 분해의 증가에 의한 것이라고 보고했다. Tripathi et al. (2012) 역시 수인성 아연에 노출된 Giant gourami, Colisa fasciatus의 혈장 glucose 증가를 보고했으며, 이는 스트레스에 의한 증가라고 주장했다.
어류 혈장 cholesterol은 지단백, 담즙산 및 스테로이드 호르몬의 구조적 필수 구성요소이며, 금속과 같은 독성물질의 영향으로 지방 분해에 영향을 주어 변화할 수 있다(Tuncsoya et al., 2016). 금속 노출에 의한 스트레스로 인해 어류의 혈장 cholesterol은 증가할 수 있지만(Öner et al., 2008), 금속 노출에 의한 세포막 손상 및 콜레스테롤 합성 억제로 감소될 수도 있다(Atli et al., 2015). 본 연구에서 수인성 아연 노출에 따른 붕어의 혈장 cholesterol은 노출 96시간에 유의적 감소를 나타내었으며, 이는 아연 독성에 의한 콜레스테롤 대사 억제에 의한 것으로 판단된다.
어류 혈장 total protein은 어류의 다양한 생리적 대사를 위한 에너지를 공급하며, 환경성 질병과 같은 다양한 스트레스 요인에 의해 변화하여 독성물질 노출에 따른 어류의 건강 상태를 평가할 수 있는 중요한 요소이다(Mohiseni et al., 2017). 혈장 total protein의 수치는 독성물질의 노출에 의해 손상된 세포 및 조직 소기관 복구에 사용되는 지단백질 형성, 간경변과 같은 증후군으로 인한 단백질 분해에 의해 감소할 수 있는 반면, 독성 영향으로부터 어류를 보호하기 위한 기작으로 단백질 합성 속도의 증가로 인해 일시적으로 증가할 수도 있다(Remyla et al., 2008). 본 연구에서 수인성 아연 노출은 붕어의 혈장 total protein의 유의적 증가를 유발했으며, Javed and Usmani (2015) 역시 수환경 오염에 의한 스트레스로 the spotted snakehead, Channa punctata 혈장 total protein의 유의적 증가를 보고했다. 이러한 스트레스에 의한 혈장 total protein의 유의적 증가는 독성 노출에 의한 높은 에너지 수요를 충족시키기 위한 단백질 합성 증가에 의한 것으로 판단된다.
어류 혈장 ALT와 같은 transaminase는 단백질 및 아미노산 대사에서 중요한 역할을 하며, 금속 노출에 따른 독성으로 조직 손상 및 기능 장애가 발생할 시 혈장으로 방출되어 증가될 수 있다(Kaya et al., 2017). 어류 혈장 ALP 역시 금속에 노출된 어류의 독성 영향을 평가하는 주요한 혈장 효소 성분이다(Kim et al., 2019). 본 연구에서 수인성 아연 노출에 따른 붕어의 혈장 ALT는 유의적인 증가가 나타났으며, 이는 아연 독성에 의한 간 조직의 손상을 유발할 수 있음을 의미한다. Abdel-Tawwab (2016)은 수인성 아연 노출에 따른 Nile tilapia, Oreochromis niloticus L. 혈장 ALT의 유의적 증가를 보고했으며, 이는 아연 독성이 어류의 주요 장기, 특히 간과 신장에서 여러 병리적 증상을 유도했기 때문이라고 주장했다. 또한, 수인성 아연 노출에 따른 common carp, Cyprinus carpio L. 혈장 ALT의 유의적 증가가 보고되었으며, 이는 조직 손상 및 기능 장애에 의한 것으로 판단된다고 주장했다.
본 연구에서 높은 수준의 수인성 아연(> 40 mg Zn2+/l) 급성 노출은 붕어에 치명적인 독성으로 항상성 붕괴를 유발하여, 폐사를 초래했으며, 수인성 아연 노출에 따른 붕어의 96시간 반수치사농도는 51.58 mg Zn2+/l로 나타났다. 또한 수인성 아연(> 10 or 20 mg Zn2+/l)의 노출은 실험어인 붕어의 혈액학적 성상 및 혈장 성분의 생리적 변화를 초래하였다. 본 실험의 결과는 독성으로 작용할 수 있는 영향 농도에서는 붕어의 혈액학적 성상 및 혈장 성분의 유의적 변화를 초래하며, 한계 농도에서는 급성으로 대량 폐사를 유발할 수 있음을 확인하였다. 수인성 아연 노출에 따른 독성 영향은 다양한 환경 조건에 따라 다르게 나타날 수 있기 때문에, 향후 환경 조건 별 실험을 통해 아연 독성을 평가할 수 있는 다양한 지침이 마련되어야 할 것이다.
- References
-
1. Abdel-Warith AA, Younis EM, Al-Asgah NA, Wahbi OM. 2011. Effect of zinc toxicity on liver histology of Nile tilapia, Oreo- chromis niloticus. Scientific Research and Essays 6: 3760-3769.
-
2. Abdel-Tawwab M. 2016. Effect of feed availability on susceptibility of Nile tilapia, Oreochromis niloticus (L.) to environmental zinc toxicity: Growth performance, biochemical response, and zinc bioaccumulation. Aquaculture 464: 309-315.
-
3. Andres S, Ribeyre F, Tourencq JN, Boudou A. 2000. Interspecific comparison of cadmium and zinc contamination in the organs of four fish species along a polymetallic pollution gradient (Lot River, France). Science of the Total Environment 248: 11-25.
-
4. Atli G, Ariyurek SY, Kanak EG, Canli M. 2015. Alterations in the serum biomarkers belonging to different metabolic systems of fish (Oreochromis niloticus) after Cd and Pb exposures. Environ- mental Toxicology and Pharmacology 40: 508-515.
-
5. Canli M, Atli G. 2003. The relationships between heavy metal (Cd, Cr, Cu, Fe, Pb, Zn) levels and the size of six Mediterranean fish species. Environmental Pollution 121: 129-136.
-
6. Cao Q, Chu P, Gu J, Zhang H, Feng R, Wen X, Yin S. 2020. The influence of Ca2+ concentration on voltage-dependent L-type calcium channels' expression in the marbled eel (Anguilla marmorata). Gene 722: 144101.
-
7. Çelik EŞ, Kaya H, Yilmaz S, Akbulut M, Tulgar A. 2013. Effects of zinc exposure on the accumulation, haematology and immunology of Mozambique tilapia, Oreochromis mossambicus. African Journal of Biotechnology 12: 744-753.
-
8. Elnabris KJ, Muzyed SK, El-Ashgar NM. 2013. Heavy metal con- centrations in some commercially important fishes and their contribution to heavy metals exposure in Palestinian people of Gaza Strip (Palestine). Journal of the Association of Arab Universities for Basic and Applied Sciences 13: 44-51.
-
9. Fazio F. 2019. Fish hematology analysis as an important tool of aquaculture: a review. Aquaculture 500: 237-242.
-
10. Franco JL, Trivella DB, Trevisan R, Dinslaken DF, Marques MR, Bainy AC, Dafre AL. 2006. Antioxidant status and stress proteins in the gills of the brown mussel Perna perna exposed to zinc. Chemico-Biological Interactions 160: 232-240.
-
11. Harper LR, Griffiths NP, Lawson Handley L, Sayer CD, Read DS, Harper KJ, Hänfling B. 2019. Development and application of environmental DNA surveillance for the threatened crucian carp (Carassius carassius). Freshwater Biology 64: 93-107.
-
12. Hogstrand C, Balesaria S, Glover CN. 2002. Application of genomics and proteomics for study of the integrated response to zinc exposure in a non-model fish species, the rainbow trout. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology 133: 523-535.
-
13. Horie Y, Yonekura K, Suzuki A, Takahashi C. 2020. Zinc chloride influences embryonic development, growth, and Gh/Igf-1 gene expression during the early life stage in zebrafish (Danio rerio). Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology 230: 108684.
-
14. Javed M, Shelke A, Ogundiran M. 2008. Bioaccumulation Pattern of Zinc in Freshwater Fish Channa punctatus (Bloch.) A er Chronic Exposure. Turkish Journal of Fisheries and Aquatic Sciences 8: 55-59.
-
15. Javed M, Usmani N. 2015. Stress response of biomolecules (carbo- hydrate, protein and lipid profiles) in fish Channa punctatus inhabiting river polluted by Thermal Power Plant effluent. Saudi Journal of Biological Sciences 22: 237-242.
-
16. Kaya H, Duysak M, Akbulut M, Yılmaz S, Gürkan M, Arslan Z, Ateş M. 2017. Effects of subchronic exposure to zinc nanoparticles on tissue accumulation, serum biochemistry, and histopath- ological changes in tilapia (Oreochromis niloticus). Environ- mental Toxicology 32: 1213-1225.
-
17. Khan GB, Akhtar N, Khan MF, Ullah Z, Tabassum S, Tedesse Z. 2022. Toxicological impact of zinc nano particles on tilapia fish (Oreochromis mossambicus). Saudi Journal of Biological Sciences 29: 1221-1226.
-
18. Kim JH, Kang JC. 2015. The lead accumulation and hematological findings in juvenile rock fish Sebastes schlegelii exposed to the dietary lead (II) concentrations. Ecotoxicology and Environ- mental Safety 115: 33-39.
-
19. Kim JH, Choi H, Sung G, Seo SA, Kim KI, Kang YJ, Kang JC. 2019. Toxic effects on hematological parameters and oxidative stress in juvenile olive flounder, Paralichthys olivaceus ex- posed to waterborne zinc. Aquaculture Reports 15: 100225.
-
20. Kim U. 2004. Seawater desalination to solve water problems and diversify water sources in island areas. Korea Water and Wastewater Works Association 58-69.
-
-
22. Madhusudan S, Liyaquat FATMA, Nadim CHISHTY. 2003. Bioaccu- mulation of zinc and cadmium in freshwater fishes. Indian Journal of Fisheries 50: 53-65.
-
23. McRae NK, Gaw S, Glover CN. 2016. Mechanisms of zinc toxicity in the galaxiid fish, Galaxias maculatus. Comparative Bio- chemistry and Physiology Part C: Toxicology & Pharmacology 179: 184-190.
-
24. Modesto KA, Martinez CB. 2010. Effects of Roundup Transorb on fish: hematology, antioxidant defenses and acetylcholin- esterase activity. Chemosphere 81: 781-787.
-
25. Mohiseni M, Sepidnameh M, Bagheri D, Banaee M, Nematdust Haghi B. 2017. Comparative effects of S hirazi thyme and vitamin E on some growth and plasma biochemical changes in common carp (Cyprinus carpio) during cadmium exposure. Aquaculture Research 48: 4811-4821.
-
26. Ololade IA, Ogini O. 2009. Behavioural and hematological effects of zinc on African catfish, Clarias gariepinus. International Journal of Fisheries and Aquaculture 1: 22-27.
-
27. Öner M, Atli G, Canli M. 2008. Changes in serum biochemical parameters of freshwater fish Oreochromis niloticus following prolonged metal (Ag, Cd, Cr, Cu, Zn) exposures. Environmental Toxicology and Chemistry: An International Journal 27: 360-366.
-
28. Palaniappan PR, Nishanth T, Renju VB. 2010. Bioconcentration of zinc and its effect on the biochemical constituents of the gill tissues of Labeo rohita: An FT-IR study. Infrared Physics & Technology 53: 103-111.
-
29. Papagiannis I, Kagalou I, Leonardos J, Petridis D, Kalfakakou V. 2004. Copper and zinc in four freshwater fish species from Lake Pamvotis (Greece). Environment International 30: 357-362.
-
30. Puar P, Niyogi S, Kwong RW. 2020. Regulation of metal homeo- stasis and zinc transporters in early-life stage zebrafish following sublethal waterborne zinc exposure. Aquatic Toxi- cology 225: 105524.
-
31. Qu R, Feng M, Wang X, Qin L, Wang C, Wang Z, Wang L. 2014. Metal accumulation and oxidative stress biomarkers in liver of freshwater fish Carassius auratus following in vivo ex- posure to waterborne zinc under different pH values. Aquatic Toxicology 150: 9-16.
-
32. Remyla SR, Ramesh M, Sajwan KS, Senthil Kumar K. 2008. In- fluence of zinc on cadmium induced haematological and biochemical responses in a freshwater teleost fish Catla catla. Fish Physiology and Biochemistry 34: 169-174.
-
33. Rufli H. 2012. Introduction of moribund category to OECD fish acute test and its effect on suffering and LC50 values. Environ- mental Toxicology and Chemistry 31: 1107-1112.
-
34. Sankhla MS, Kumar R, Prasad L. 2019. Zinc impurity in drinking water and its toxic effect on human health. Indian Congress of Forensic Medicine & Toxicology.
-
35. Saravanan M, Kumar KP, Ramesh M. 2011. Haematological and biochemical responses of freshwater teleost fish Cyprinus carpio (Actinopterygii: Cypriniformes) during acute and chronic sublethal exposure to lindane. Pesticide Biochemistry and Physiology 100: 206-211.
-
36. Sfakianakis DG, Renieri E, Kentouri M, Tsatsakis AM. 2015. Effect of heavy metals on fish larvae deformities: a review. Environ- mental Research 137: 246-255.
-
37. Shah AI. 2017. Heavy metal impact on aquatic life and human health–an over view. In IAIA17 Conference Proceedings| IA's Contribution in Addressing Climate Change 37th Annual Conference of the International Association for Impact Assessment.
-
38. Shah N, Khan A, Ali R, Marimuthu K, Uddin MN, Rizwan M, Khisroon M. 2020. Monitoring bioaccumulation (in gills and muscle tissues), hematology, and genotoxic alteration in Ctenopharyngodon idella exposed to selected heavy metals. BioMed Research International.
-
39. Tripathi S, Mishra BB, Tripathi SP. 2012. Impact of zinc sulphate on biochemical parameters in reproductive cycle of Colisa fasciatus. Int J of Bas and App Sci 1: 250-254.
-
40. Tuncsoya M, Durana S, Yesilbudaka B, Ayb O, Cicikb B, Erdem C. 2016. Short term effects of zinc on some sera biochemical parameters and tissue accumulation of Clarias gariepinus. Fres Environ Bull 2: 658-664.
-
41. Velcheva, IG. 2006. Zinc content in the organs and tissues of freshwater fish from the Kardjali and Studen Kladenets Dam Lakes in Bulgaria. Turkish Journal of Zoology 30: 1-7.
-
42. Vidya PV, Chitra KC. 2017. Assessment of acute toxicity (LC50-96 h) of aluminium oxide, silicon dioxide and titanium dioxide nanoparticles on the freshwater fish, Oreochromis mossambicus (Peters, 1852). International Journal of Fisheries and Aquatic Studies 5: 327-332.
-
43. Vøllestad LA, Varreng K, Poleo ABS. 2004. Body depth variation in crucian carp Carassius carassius: An experimental individual‐based study. Ecology of Freshwater Fish 13: 197-202.
-
44. Witeska M. 2005. Stress in fish-hematological and immunological effects of heavy metals. Electronic Journal of Ichthyology 1: 35-41.
-
45. Yang Z, Huang S, Kong W, Yu H, Li F, Khatoon Z, Akram W. 2021. Effect of different fish feeds on water quality and growth of crucian carp (Carassius carassius) in the presence and absence of prometryn. Ecotoxicology and Environmental Safety 227: 112914.
-
46. Yu SJ, Park SJ, Ahn KH, Kim HG, Kim CS, Jung IR, Park YB. 2008. The Corrosion Effect of the Water Pipelines in Buildings according to Drinking Water Quality. Korean Society on Water 24: 701-708.
-
47. Zheng JL, Luo Z, Chen QL, Liu X, Liu CX, Zhao YH, Gong Y. 2011. Effect of waterborne zinc exposure on metal accumulation, enzymatic activities and histology of Synechogobius hasta. Ecotoxicology and Environmental Safety 74: 1864-1873.