JMLS 2022 December;7(2):102-112. 10.23005/ksmls.2022.7.2.102 Epub 2022 December 14
Copyright © 2022 by The Korean Society of Marine Life Science
Toxic Effects on Lethal Concentration 50%, Heamatological Parameters and Plasma Components of Crucian carp, Carassius carassius by Acute Waterborne Nickel Exposure
Chang-Hoon Joo; Sun Moon University, Department of Aquatic Life and Medical Science, Asan 31460, Korea
A-Hyun Jo; Sun Moon University, Department of Aquatic Life and Medical Science, Asan 31460, Korea
Su-Min Hong; Sun Moon University, Department of Aquatic Life and Medical Science, Asan 31460, Korea
Ji-Ho Jeong; Sun Moon University, Department of Aquatic Life and Medical Science, Asan 31460, Korea
Yun-A Ryu; Sun Moon University, Department of Aquatic Life and Medical Science, Asan 31460, Korea
Seock-Won Jo; Sun Moon University, Department of Aquatic Life and Medical Science, Asan 31460, Korea
Jae-Hee Song; South East Sea Fisheries Research Institute, NIFS, Tongyeong 39769, Korea
Jun-Hwan Kim; Sun Moon University, Department of Aquatic Life and Medical Science, Asan 31460, Korea
- Abstract
본 실험은 붕어(Crucian carp, Carassius carassius)(무게 39.7±3.1 g, 전장 14.8±0.5 cm)의 수인성 니켈 0, 10, 20, 40, 80 및 160 mg Ni2+/l 농도로 96시간 급성 노출을 실시하였다. 수인성 니켈에 노출된 붕어의 반수치사농도(LC50)는 117.69 mg Ni2+/l으로 나타났다. 혈액학적 성상에서 RBC count는 수인성 니켈 96시간 급성 노출 중 48시간에서 유의적으로 증가한 반면, 96시간에서 유의적 감소가 나타났다. MCV와 MCH는 96시간에서 80 mg Ni2+/l 농도에서 유의적으로 증가했다. Calcium, magnesium, glucose, cholesterol, total protein, AST, ALT 및 ALP 와 같은 혈장 성분은 수인성 니켈 노출에 의해 유의적 변화가 나타났다. 이 연구의 결과는 수인성 니켈 노출에 따른 붕어의 생존율, 혈액학적 성상 및 혈장 성분의 변화를 확인하고 이는 수인성 니켈의 독성에 의한 것으로 판단했다.
Crucian carp, Carassius carassius (Weight 39.7±3.1 g, Length 14.8±0.5 cm) were exposed to waterborne nickel at 0, 10, 20, 40, 80 and 160 mg Ni2+/l. The lethal concentration 50 (LC50) of C. carassius exposed to waterborne nickel was 117.69 mg Ni2+/l. In hematological parameters, RBC counts was significantly increased at 48 hours, whereas a significant decrease was observed at 96 hours. The MCV and MCH were significantly increased in the concentration of 80 mg Ni2+/l at 96 hours. The plasma components such as calcium, magnesium, glucose, cholesterol, total protein, AST, ALT and ALP were significantly changed by waterbonre nickel exposure. The results of this study suggest that the nickel exposure to C. carassius affects the survival rates, hematological parameters and plasma components as toxicity.
Keywords: Nickel exposure(니켈 노출) Tolerance limits(내성 한계) Hematological parameters(혈액 성상) Plasma components(혈장 성분) Crucian carp(붕어)
Correspondence to: Jun-Hwan Kim; Sun Moon University, Department of Aquatic Life and Medical Science, Asan 31460, Korea
- Received
- 10 August 2022;
- Revised
- 26 August 2022;
- Accepted
- 21 September 2022.
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Language: Korean/English,
Full Text:

서 론
니켈은 전이금속원소로 수중 환경에서 미량으로 존재하는 물질이지만, 미량이라도 수 환경 및 생태계에 치명적인 독성으로 작용할 수 있다(Pourkhabbaz et al., 2011; Blewett and Leonard, 2017). 니켈은 항공 우주 산업과 같은 최첨단 산업에 많이 활용되고, 관련 산업에서의 필요의 증가에 따라 사용되는 니켈의 양은 꾸준히 증가하고 있으며 수중 환경에서 니켈 노출에 따른 위해성에 대한 우려도 함께 높아지고 있다(Cempel and Nikel, 2006; Kornik and Zug, 2008; Palermo et al., 2015). 니켈이 수중 환경에 노출되면 암석과 같은 물리적 환경에 침전되거나 흡착될 수 있으며, 수중으로 용해된 니켈은 자연적으로 제거되지 않으며 어류의 대사활동을 통해 체내로 유입되어 다양한 독성 영향을 나타낼 수 있다(Bielmyer et al., 2013; Karthikeyan et al., 2007; Pandey and Madhuri, 2014).
어류에게 기준지표 이상의 니켈 농도는 수중 생물에게 신경교란으로 인한 행동학적 장애를 유발하며, 산란어의 생식선에 축적되어 에스트로겐 및 테스토스테론의 분비를 감소를 유발해 번식에 영향을 미칠 수 있다(Jezierska et al., 2009; Verma, 2012). 어류에서 니켈 독성은 특히 발달 초기 단계에서 더욱 현저하게 나타날 수 있으며, 정자 및 난자를 오염시켜 배아 발달 과정에서 발달 지연 및 기형을 유발할 수 있다(Authman et al., 2015; Sfakianakis et al., 2015). 어류에서 높은 수준의 니켈 노출은 특정 장기에서 유의적 축적을 유발할 수 있으며, 행동학적 반응 장애로 인해 포식 능력 저하 등 서식지에서 생존 능력을 저하시킬 수 있다(Khayatzadeh and Abbasi, 2010). 또한, 수생태계의 높은 니켈 농도는 어류의 위장 염증을 유발하고, 조직 손상을 통해 질병저항성을 감소시킬 수 있어 감염성 질병에 더욱 취약할 수 있다(Pandey and Madhuri, 2014). 또한, 니켈 노출은 수중 생물의 아가미 상피세포의 부종, 증식 및 퇴행성 변화, 사구체 내의 용혈 및 신장 조직 내 관상 변성 등을 유발한다(Topal et al., 2017; Todorova et al., 2019).
수중 생물에게 독성물질의 대한 위해성을 결정하기 위해 사용되는 반수치사농도(LC50, Lethal Concentration 50%)는 급성 노출 실험에서 독성물질로 인해 50%의 수중 생물이 폐사하는 농도로, 수중 환경에서 독성물질의 위해성을 판단하고 독성에 대해 안전 농도를 정할 수 있는 중요한 평가 요소이다(Ullah et al., 2016; Bita et al., 2021). 급성 노출 실험에서 반수치사농도는 생물의 종, 성장 단계, 성별 등과 같은 생물학적 요인 뿐만 아니라 수온, pH등 환경적 요인에 의해서도 다양하게 변화할 수 있다(de Oliveira et al., 2011; Yunus et al., 2019). 니켈은 사람뿐만 아니라 설치류에서도 암을 유발하는 요인으로 알려져 있지만, 수중 생물에 대한 독성 영향은 명확하게 알려져 있지 않다(Svecevičius, 2010). 따라서 니켈 급성 노출에 따른 반수치사농도는 니켈 노출에 대한 독성 정도와 수중생태계에서의 영향 농도에 대한 기준지표를 제시해 줄 것이다.
혈액학적 성상은 어류의 건강상태를 나타내는 생리학적 지표로 이용되며, 독성물질에 노출된 어류의 생리적인 독성 영향을 판단하는 중요한 지표로 이용할 수 있다(Adhikari et al., 2004; Seriani et al., 2011). 혈액학적 성상은 연령, 종, 성별 등의 생물학적 요인 뿐만 아니라, 질병 및 독성물질의 노출 등에 의한 스트레스 의해서도 영향을 받을 수 있다(Kim et al., 2018; Molayemraftar et al., 2022). 수인성 니켈은 어류의 아가미를 통해서 순환계로 유입될 수 있으며, 이는 어류의 적혈구 용해 및 혈구 파괴를 유발하며 혈액 생리에 장애를 일으킨다(Brix et al., 2004). 또한 높은 수준의 니켈은 헤모글로빈의 산소와 결합하는 기능의 저하를 유발하여 저산소증을 유발할 수 있다(Vinodhini and Narayanan, 2009; Ololade and Oginni, 2010). 니켈의 노출은 어류의 근육과 간에서 글리코겐 농도의 감소, 혈액에서 젖산과 포도당의 동시 증가 및 혈관 평활 근의 수축, 적혈구 파괴 및 삼투압 불균형 등을 유발한다(Eisler, 1998; Witeska, 2005). 고농도의 니켈 노출은 어류 헤모글로빈의 Fe2+를 Fe3+로 산화시켜, 메트 헤모글로빈으로 전환하여 용혈성 빈혈 및 혈액 내 산소 농도 감소를 유발할 수 있다(Soldatov, 2021).
붕어(Crucian carp, Carassius carassius)는 우리나라 담수 전역에 서식하는 어종으로 수산 자원으로서 높은 가치를 가지고 있고, 양식을 했을 때 높은 수익성을 나타낼 수 있는 경제성 어종이다(Lee et al., 2013). 하지만, 다양한 독성물질 노출에 따른 기준지표 및 내성 한계에 대한 연구는 거의 이루어지지 않고 있다. 수중에 존재하는 니켈은 가장 독성이 강한 물질 중 하나로, 수생태계 대표 지표종인 붕어에게 치명적인 독성으로 작용할 수 있기 때문에, 니켈 노출에 따른 붕어의 독성 영향에 대한 연구가 필요하다. 따라서 본 연구의 목적은 수인성 니켈 노출에 따른 붕어의 혈액학적 성상 및 혈장 성분의 변화를 통해 니켈 독성에 의한 생리적 영향에 대해 확인하고, 반수치사농도를 통해 니켈 독성의 내성 한계에 대한 정확한 기준지표를 마련하는 데 있다.
재료 및 방법
1. 실험어 및 실험 환경
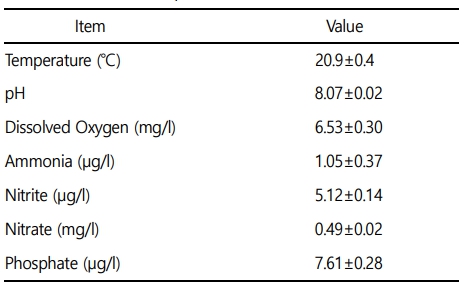
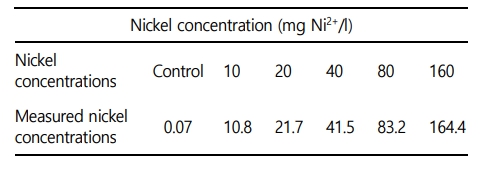
본 실험에 이용된 붕어(무게 39.7±3.1 g, 전장 14.8±0.5 cm)는 아산 인근의 종묘생산장에서 분양 받아 실험실 환경에서 사육 양성한 개체를 이용하였다. 실험은 실험 전 2주간 실험실 환경에서 순치를 실시하였으며, 실험수조는 40 ℓ 유리 사각수조를 이용하여, 6개의 농도구간(0, 10, 20, 40, 80 및 160 mg Ni2+/l)으로 96시간 급성 노출을 실시하였다. 일반적으로 아시아, 유럽 및 미국 등 다양한 국가에서 담수생태계의 니켈 기준지표는 4~200 μg/l 수준이며, 수중에 일반적으로 존재하는 농도도 본 연구의 실험 농도 보다 매우 낮은 수준이다(Wang et al., 2020). 하지만, 수중 생물에게 영향을 미치는 기준을 확립하기 위해 사전연구를 거쳐 영향이 있는 높은 농도구간을 설정하였다. 실험은 총 60마리(니켈 농도구간 6개 × 농도구간 별 5마리 × 노출시간 2개)를 이용하여 노출을 진행하였으며, 실험 기간 중 수질(수온, 용존산소 및 pH)은 휴대용 수질 분석기(YSI-Professnal plus, YSI Inc., USA)를 이용하여 측정하였으며, 암모니아, 아질산, 질산 및 인산염은 수질환경분석법(해양수산부)을 이용하여 분석을 실시하였다(Table 1). 본 연구에서 니켈 노출은 염화니켈(NiCl2, Nickel chloride)를 이용하여, 표준원액 80,000 mg Ni2+/l를 만들었으며 각 수조에 농도에 맞게 노출을 실시하였으며, 니켈 농도구간 별 실제 니켈 농도는 Table 2와 같다.
2. 반수치사농도(LC50)
수인성 니켈 노출에 의한 반수치사농도를 확인하기 위해, 니켈 노출 후 0, 1, 3, 6, 12, 24, 48, 72 및 96시간 수조 별 폐사 유무를 확인하였으며, 폐사 개체는 관찰 즉시 제거해주었다. 96시간 후 니켈 노출에 의한 최종 폐사 개체를 바탕으로 통계프로그램(SPSS Inc, Chicago, IL, USA, probit model)을 이용하여 반수치사농도 수치를 산출하였다.
3. 혈액성상
혈액학적 분석은 수인성 니켈 노출 96시간 후 살아있는 개체를 이용하여 채혈을 실시하였다. 혈액 샘플링은 대조구에서 80 mg Ni2+/l까지 모든 개체(농도구간 별 5마리)를 대상으로 실시하였다. 채혈은 헤파린(Sigma Chemical, St. Louis, MO, USA) 처리된 주사기를 사용하였으며, 채혈 직후 헤모글로빈(Hemoglobin), 적혈구 용적(Hematocrit) 및 적혈구 수(RBC count)를 즉시 분석하였다. Hemoglobin 수치는 임상용 kit (Asan Pharm. Co., Ltd)를 이용하여 Cyan-methemoglobin 법으로 측정하였다. Hematocrit는 모세관 내로 혈액을 넣어, Microhematocrit centrifuge (VS-12000, Korea)에서 12,000 rpm, 10분간 원심분리 후 Micro-hematocrit reader를 이용하여 측정하였다. RBC count는 Hendrick's diluting solution으로 혈액을 400배 희석 후, hemo-cytometer (Improved Neubauer, Germany)를 이용하여 광학현미경으로 계수하였다.
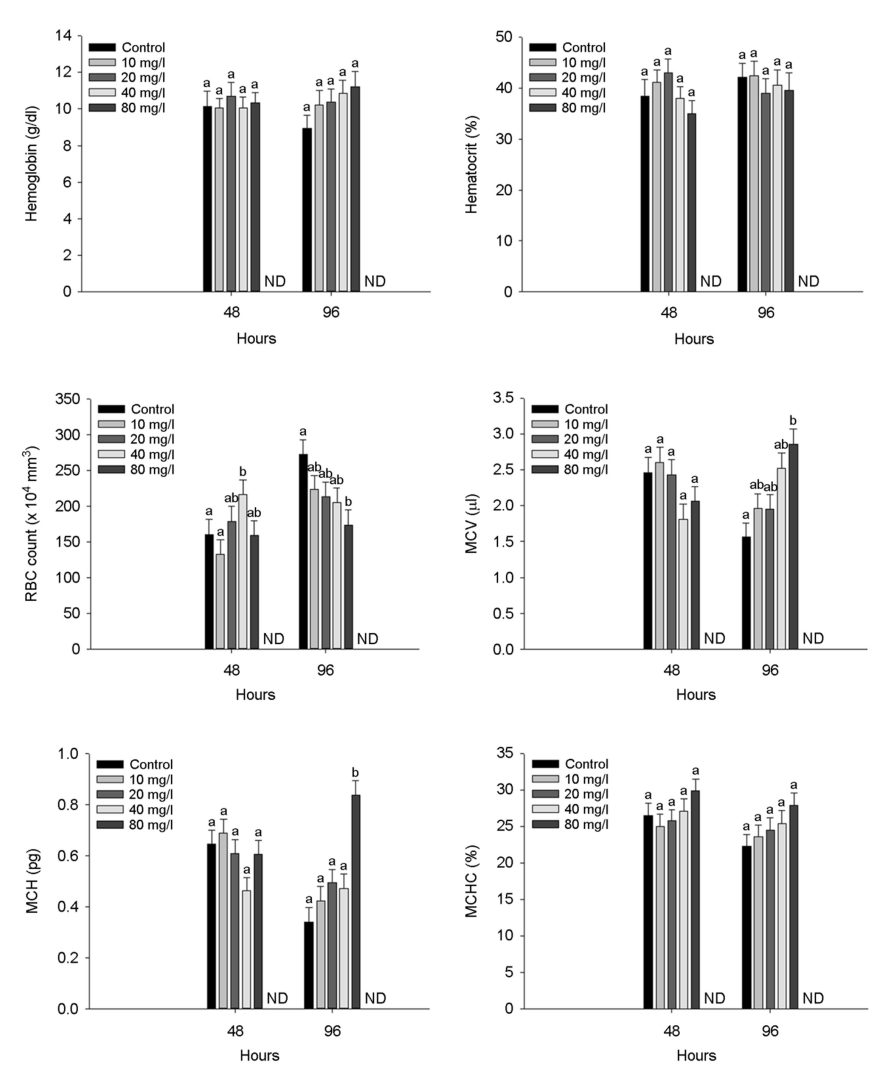
Hemoglobin, hematocrit 및 RBC count 결과를 바탕으로 평균적혈구용적(MCV: mean corpuscular volume), 평균적혈구혈색소량(MCH: mean corpuscular hemoglobin) 및 평균적혈구헤모글로빈농도(MCHC: mean corpuscular hemoglobin concentration)는 아래의 방식으로 산출하였다.
MCV (μl) = Hematocrit (%) / 적혈구수(106/μl) × 10
MCH (pg) = Hemoglobin (g/dl) / 적혈구수(106/μl) × 10
MCHC (%) = Hemoglobin (g/dl) / Hematocrit (%) × 100
4. 혈장성분 분석
수인성 니켈 노출에 따른 혈장 성분의 변화를 분석하기 위해 채취한 혈액을 4℃에서 3,000 x g로 15분간 원심분리 후 혈장을 분리하였다. 혈장 무기성분으로 칼슘(Calcium), 마그네슘(Magnesium)을 측정하였다. 칼슘은 OCPC법, 마그네슘은 Xylidyl blue-I 법에 따라 임상용 kit (Asan Pharm. Co., Ltd)를 이용하여 측정하였다. 혈장 유기성분으로 혈당(Glucose), 콜레스테롤(Cholesterol) 및 총 단백질(Total protein)을 측정하였다. 혈당은 GOD/POD법, 콜레스테롤은 비색법, 총 단백질은 Biuret법에 의해 시판되고 있는 임상용 kit (Asan Pharm. Co., Ltd)를 이용하였다. 혈장 효소활성으로 AST (Aspartate aminotransferase), ALT (Alanine aminotransminase) 및 ALP (Alkaline phosphatase)를 측정하였다. AST와 ALT는 505 nm에서 Reitman-Frankel법, ALP는 King-King 법으로 500 nm에서 임상용 kit (Asan Pharm. Co., Ltd)를 이용하여 분석하였다.
5. 통계분석 방법
본 실험분석은 수인성 니켈 각 농도구간에서 10마리를 분석에 이용하였고, 모든 실험은 3반복 분석으로 이루어졌다. 실험분석 결과에 대한 통계학적 유의성은 SPSS 통계 프로그램(SPSS Inc.)을 이용하여 ANOVA test를 실시하여 Tukey's multiple range test를 통해 p < 0.05일 때 유의성이 있는 것으로 간주하였다.
6. 동물실험윤리 승인
본 실험은 선문대학교 동물실험윤리위원회를 통해 실험방법 및 진행이 동물실험윤리에 적합하다는 승인(SM-2022-03-01)을 통해 연구가 수행되었으며, 연구 참가자들은 동물복지 및 동물 실험에 대한 교육을 받았다.
결 과
1. 생존율 및 반수치사농도(LC50)
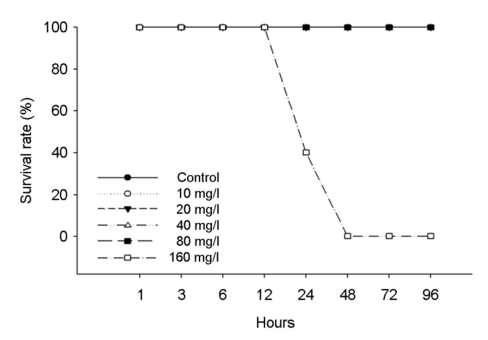
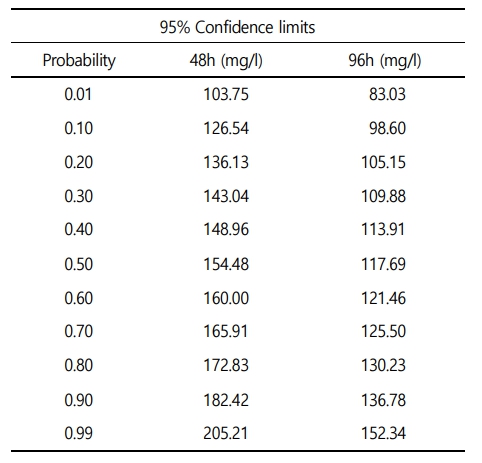
수인성 니켈 노출에 따른 붕어의 생존율은 Fig. 1에 나타내었다. 대조구에서 80 mg Ni2+/l의 노출에서는 폐사 개체는 발견되지 않았으며, 160 mg Ni2+/l에서는 노출 24시간부터 폐사가 발생하여 48시간에 100% 폐사가 나타났다. 수인성 니켈 노출에 따른 붕어의 반수치사농도(Lethal concentration 50, LC50)는 Table 3에 나타내었다. 수인성 니켈 노출에 따른 붕어의 반수치사농도는 117.69 mg Ni2+/l로 나타났다.
2. 혈액학적 성상
수인성 니켈 노출에 따른 붕어의 혈액학적 성상은 Fig. 2에 나타내었다. 붕어의 hemoglobin concentration과 hematocrit value는 수인성 니켈 노출에 따른 유의적인 변화는 나타나지 않았다. 하지만 RBC count는 니켈 노출 48시간 40 mg Ni2+/l의 농도에서 유의적으로 증가한 반면, 니켈 노출 96시간에서는 80 mg Ni2+/l의 농도에서 유의적으로 감소하였다(p < 0.05). Hemoglobin, hematocrit 및 RBC count 결과를 바탕으로 MCV (μl) 및 MCH (pg)은 수인성 니켈 80 mg Ni2+/l의 농도에서 유의적으로 증가하였다(p < 0.05). 하지만, MCHC (%)는 수인성 니켈 노출에 따른 유의적인 변화는 나타나지 않았다.
3. 혈장 성분
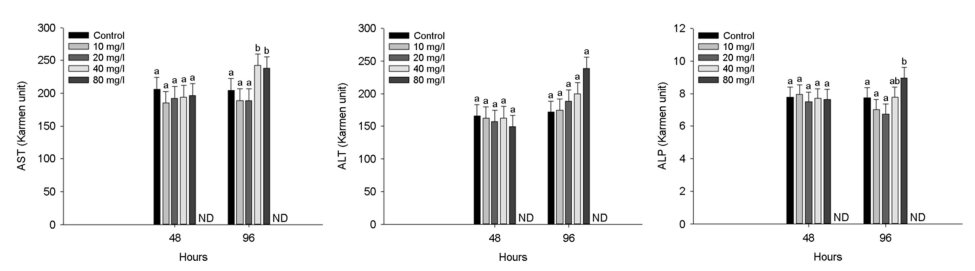
수인성 니켈 노출에 따른 붕어의 혈장 무기성분은 Fig. 3에 나타내었다. 혈장 calcium은 수인성 니켈 80 mg Ni2+/l의 농도에서 노출 96시간 유의적으로 감소하였다(p < 0.05). 혈장 magnesium은 수인성 니켈 40 mg Ni2+/l 이상의 농도에서 노출 96시간 유의적으로 감소하였다(p < 0.05). 수인성 니켈 노출에 따른 붕어의 혈장 유기성분은 Fig. 4에 나타내었다. 혈장 glucose는 96시간 80 mg Ni2+/l의 니켈 농도에서 유의적인 증가를 나타내었다(p < 0.05). 혈장 cholesterol은 96시간 80 mg Ni2+/l의 니켈 농도에서 유의적 감소를 나타내었다(p < 0.05). 혈장 total protein은 48시간 80 mg Ni2+/l의 니켈 농도에서 유의적 증가가 나타났지만, 96시간 80 mg Ni2+/l의 니켈 농도에서 유의적 감소가 나타났다(p < 0.05). 수인성 니켈 노출에 따른 붕어의 혈장 효소성분은 Fig. 5에 나타내었다. 수인성 니켈 노출에 따른 붕어의 혈장 효소성분은 Fig. 5에 나타내었다. 혈장 AST는 40 mg Ni2+/l 이상의 수인성 니켈 노출에 의해 유의적으로 증가하였다(p < 0.05). 혈장 ALT 및 ALP는 80 mg Ni2+/l의 수인성 니켈 노출에 의해 유의적으로 증가하였다(p < 0.05).
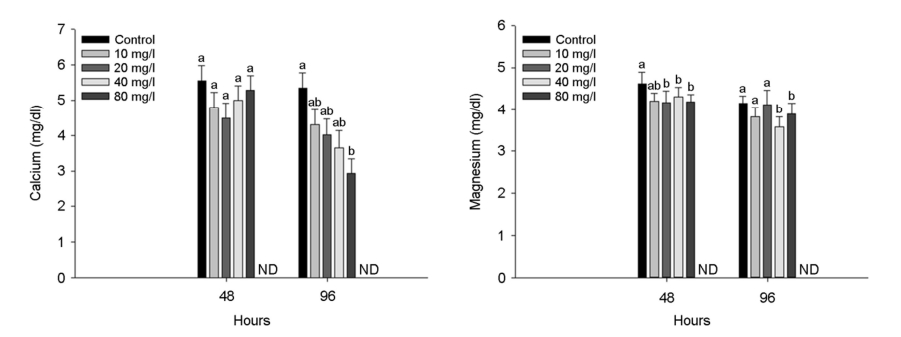
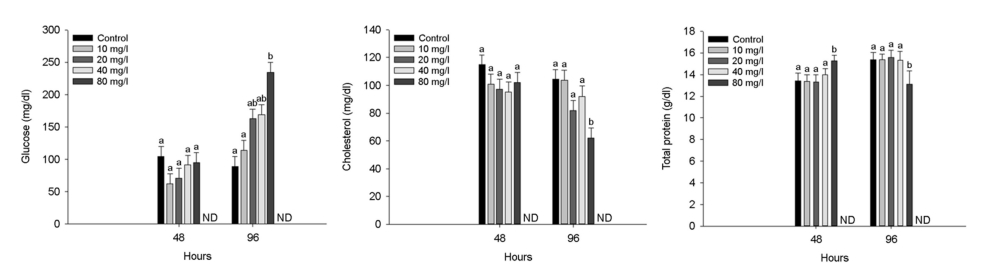
Fig. 4. Organic plasma components of Crucian carp, Carassius carassius exposed to waterborne nickel for 96 hours. Values with different letters indicate significantly different at 48 and 96 hours (p < 0.05) after one-way ANOVA following Tukey's multiple range test.
고 찰
니켈은 살아있는 유기체에 미량으로 존재하지만, 수중 고농도 니켈은 어류의 행동 및 생화학적 기능에 심각한 영향을 유발한다(Azmat et al., 2012; Javed, 2013). 어류에서 내성 한계 이상의 니켈 농도는 대량 폐사를 유발할 수 있으며, 실험 어류의 반이 폐사하는 독성물질의 농도인 반수치사농도(LC50, Lethal Concentration 50%)는 어류의 니켈 내성 한계를 확인하고, 독성을 평가하는 지표로 사용할 수 있다(Lewis Jr and Morris, 1986). 본 연구에서 수인성 니켈 노출에 따른 붕어의 폐사는 160 mg Ni2+/l에서 노출 24시간 부터 폐사가 발생하기 시작하여 노출 48시간 이후 100% 폐사를 나타냈다. 48시간 수인성 니켈 노출에 따른 붕어의 반수치사농도는 154.48 mg Ni2+/l로 나타났고, 96시간 수인성 니켈 노출에 따른 붕어의 반수치사농도는 117.69 mg Ni2+/l로 나타났다. Alkahem (1994)은 Nile tilapia, Oreochromis niloticus의 수인성 니켈의 96시간 급성 노출에서 27.2 mg Ni2+/l의 반수치사농도를 나타내었다고 보고했다. Al-Ghanim (2011)은 common carp, Cyprinus carpio의 수인성 니켈의 96시간 급성 노출에서 14.44 mg Ni2+/l의 반수치사농도로 나타났다고 보고했다. Ololade and Oginni (2010) 역시 African catfish, Clarias gariepinus의 수인성 니켈 96시간 급성 노출에 따른 반수치사농도는 8.87 mg Ni2+/l로 나타났다고 보고하였다. Svecevičius (2010)은 어류 4종 [rainbow trout, Oncorhynchus mykiss: 19.3 mg Ni2+/l, threespine stickleback, Gasterosteus aculeatus: 37.7 mg Ni2+/l, Japanese dace, Tribolodon hakonensis: 48.1 mg Ni2+/l 및 see bass, Lateolabrax japonicas: 48.8 mg Ni2+/l]의 니켈 노출에 따른 어종 별 니켈 내성 차이를 보고하였다. 다른 어종에 비해 붕어에서 니켈 노출에 대한 높은 내성 한계를 보이는 경향이 나타났으며, 이는 붕어가 다른 어종에 비해 금속 노출 시 발생할 수 있는 저산소증 및 삼투조절장애에서 높은 내성 한계를 가지기 때문이라고 판단된다(Schjolden et al., 2007; Poléo et al., 2017). 니켈 노출에 따른 니켈 내성 한계는 생물의 종, 크기, 성, 발달 단계에 의해 내성 한계의 차이를 보이는 것으로 나타났다. 하지만 수온, 염분, pH 및 경도와 같은 환경적 요인 또한 니켈 독성에 영향을 미치는 요인이므로 향후 환경적 요인에 따른 니켈 독성에 대한 추가적인 연구가 이루어져야 할 것이다.
혈액학적 성상은 독성 노출에 따른 어류의 생리학적 영향을 평가할 수 있는 지표이며, 어류의 건강상태를 평가할 수 있는 지표로 사용된다(Alwan et al., 2009). Vinodhini and Narayanan (2009)는 니켈 노출 실험을 통해 C. carpio L의 hemoglobin과 RBC count의 유의적 감소를 보였고, 이는 혈액 내 산소 결합 능력 감소를 초래했을 것이라고 보고하였다. Parthipan and Muniyan (2013)은 니켈 노출 실험을 통해 Mrigal carp, Cirrhinus mrigala의 hemoglobin, hematocrit 및 RBC count의 유의적 감소를 보고하였고, 이로 인하여 빈혈의 유발을 주장했다. Ololade and Oginni (2010) 또한 C. gariepinus가 니켈 노출에 의한 hemoglobin, hematocrit 및 RBC count의 유의적 감소를 나타냈으며, 니켈 노출은 어류 아가미의 기능 손상 및 삼투압 조절 불균형 또는 적혈구의 용혈을 발생시키고 이로 인해 RBC count의 유의적 감소가 나타날 수 있다고 보고하였다. 하지만 MCV, MCHC의 유의적 변화는 없었고, MCH만 유의적으로 감소했으며 이는 혈액 내 철의 감소로 인해 혈액의 산소 운반 능력이 저하되기 때문이라고 보고하였다. Moosavi and Shamushaki (2015)는 니켈 급성 노출 실험을 통하여 gold fish, Carassius auratus의 hemoglobin과 hematocrit의 유의적 감소를 보고하였다. 그리고 hemoglobin과 hematocrit의 감소와 함께 MCV, MCH, MCHC의 유의적 감소를 보였으며, 이는 독성 노출에 따른 어류의 항상성 유지 기능의 영향 및 혈액의 산소 운반 능력의 감소를 유발하기 때문이라고 보고하였다. 반면에 Brucka-Jastrzebska and protasowicki (2005)는 니켈 노출로 인해 C. carpio L의 MCV, MCH, MCHC의 유의적 증가를 보였고, 이는 적혈구의 용적이 증가했음을 주장하였다. Ribeiro et al. (2006)은 금속 노출에 따른 neotropical fish, Hoplias malabaricus가 MCV의 유의적인 증가를 보였으며, 이는 빈혈로 인한 거대적혈구의 증가에 의한 것이라고 주장했다. Hossain et al. (2021) 역시 금속에 노출된 O. niloticus에서 MCV, MCH의 유의적인 증가가 나타났으며, 이는 정상적인 적혈구를 감소시켜 출혈, 용혈 및 저형성 상태를 유발했다고 보고했다. 본 연구에서 수인성 니켈 노출에 따른 붕어의 RBC count 수치는 노출 48시간 일시적인 유의적 증가를 나타내었지만, 노출 96시간에서는 감소하는 경향을 나타내었다. 적혈구 수의 증가는 독성 노출에 따른 적혈구 생성의 일시적인 증가로 판단되며, 이후 유의적인 감소는 니켈 독성에 따른 적혈구 용혈에 의한 파괴로 판단된다. Hemoglobin, hematocrit 및 RBC count 결과를 바탕으로 분석한 붕어의 MCV는 유의적 증가를 나타냈으며, 이는 니켈 독성 노출에 따른 적혈구 세포의 swelling에 의한 것으로 판단된다. 본 연구에서 니켈 노출에 따른 붕어의 MCH는 유의적인 증가를 나타냈으며, 이는 니켈 노출에 의한 적혈구의 절대적인 수치는 독성에 의한 적혈구 용혈로 감소했지만, 니켈 독성 노출에도 조직으로 산소를 운반하기 위한 hemoglobin 효율은 어느 정도 유지되었음을 의미한다.
혈장 무기성분인 calcium과 magnesium은 세포 내 이온 조절 및 효소 작용 기능을 매개하여 수생 생물의 항상성을 유지하는 역할을 하는 주요한 독성 평가 지표이다(Shin et al., 2016; Ko et al., 2019). Pane et al. (2003)은 수인성 니켈 노출에 따른 혈장 calcium의 감소가 Ni2+이 Ca2+의 길항제로 작용되어, 이온 통로 흡착 부위에 경쟁적으로 결합함으로써 혈장 calcium의 변화를 나타낼 수 있다고 주장했다. Bougas et al. (2013)은 수인성 니켈 노출이 yellow perch, Perca flavescens의 혈장 calcium을 유의적으로 감소시켰다고 보고했으며, 이는 면역 반응, 세포 주기 조절 및 유전자 발현 조절과 같은 생리학적 과정에서 중요한 칼슘 매개 신호 전달 단백질인 calmodulin과 경쟁적 결합에 의한 것으로 판단된다. 본 연구에서 수인성 니켈 노출은 붕어 혈장 calcium의 유의적인 감소를 나타냈으며, 이는 Ni2+이 Ca2+과의 경쟁으로 인해 칼슘 이온 통로 차단에 의한 것으로 판단된다. Brix et al. (2017)은 magnesium이 200개 이상의 Mg2+ 의존성 효소 반응(예: ATP, 광합성)에서 촉매 역할을 하며, Mg2+과 Ni2+의 상호작용을 통해 Mg2+의 흡수를 억제한다고 주장했다. Adhikari (2004)는 수인성 아연 노출에 따른 rohu, Labeo rohita가 혈장 magnesium을 유의적으로 감소시켰다고 보고했으며, 이는 Zn2+이 Mg2+의 결합 부위를 방해하여 이온의 항상성 유지에 영향을 미쳤다고 주장했다. 본 연구에서 magnesium은 수인성 니켈 노출에 의해 유의적으로 감소하였으며, 이는 Ni2+이 Mg2+의 전달 경로를 방해하여 생긴 이온 불균형에 의한 것이라고 판단된다.
혈장 glucose는 수산 생물의 주요 에너지원으로 다양한 환경 스트레스에 의해 민감하게 자극되어 어류의 건강상태 및 스트레스를 평가하는 주요한 지표이며, 일반적으로 혈장 glucose의 증가는 스트레스 조건에서 어류의 증가된 에너지 수요에 대처하기 위한 반응으로 알려져 있다(Ramesh et al., 2014). 본 연구에서 수인성 니켈 노출은 붕어 혈장 glucose의 유의적인 증가를 유발했으며, 이는 니켈 독성에 의한 스트레스 반응으로 glycogen 분해 촉진에 의한 것으로 판단된다. Kubrak et al. (2012)는 니켈에 노출된 C. auratus의 혈장 glucose의 유의적인 증가를 보고했으며, 이는 니켈 노출에 의한 스트레스 상황에서 glycolsis를 통해 스트레스에 대응하기 위한 에너지 변환을 위한 작용이라고 주장했다. Moosavi and Shamushaki (2015) 역시 아치사 농도의 니켈 노출이 C. auratus의 혈장 glucose를 유의적으로 증가시켰다고 보고했으며, 이는 cortisol과 관련된 스트레스 호르몬의 에너지 수요에 대처하기 위한 glucose 생산 및 순환의 증가에 의한 것이라고 보고했다. Vinodhini and Narayanan (2009)는 금속 노출은 어류의 과도한 glycogenolysis를 통해 간 조직 단백질 및 아미노산으로부터 glucose 합성을 증가시키고, 이를 통해 스트레스 상황에서 적절히 대응할 수 있는 에너지를 얻는다고 주장했다.
혈장 cholesterol은 모든 스테로이드 호르몬의 전구체 및 세포막의 필수 구성 요소이며, 세포의 신호 전달의 매개체로서 중요한 역할을 한다(Pandit et al., 2018; Brandts et al., 2021). 독성 노출에 따른 cholesterol은 독성 노출에 의한 스트레스를 완화하기 위해 필요한 지질 대사 에너지원으로서 작용되어 감소할 수 있다(Pandit and Sharma, 2019). Atli et al. (2015)는 카드뮴 및 납 노출에 의한 O. niloticus가 cholesterol의 유의적인 감소를 보였으며, 이는 세포막 손상이 일어나 콜레스테롤 합성을 억제했을 것이라고 주장했다. Heydarnejad et al. (2013)은 카드뮴 노출에 의한 O. mykiss의 혈장 cholesterol이 유의적인 감소가 나타났으며, 이는 금속물질이 세포막 구조의 안정성에 영향을 주었기 때문이라고 판단했다. Walker et al. (2020) 역시 금속물질 크롬 3가 이온에 노출된 O. niloticus 치어의 혈장 cholesterol이 유의적으로 감소했으며, 이는 크롬 3가 이온이 어류 대사에 영향을 주어 콜레스테롤 합성을 억제하는 효소를 활성화했다고 주장했다. 본 연구에서 수인성 니켈 노출은 96시간 노출에서 cholesterol의 유의적인 감소를 보였으며, 이는 금속 노출에 의해 어류의 대사 장애 및 세포막 손상이 일어났다고 판단했다.
혈장 total protein은 독성 노출에 의한 어류의 단백질 합성을 평가하는 주요한 지표로 독성 노출에 따른 스트레스에 가장 민감한 초기 지표이다(Atli et al., 2015). 독성물질 노출에 따른 어류의 혈장 total protein 변화는 간 손상, 흡수 감소 및 단백질 손실로 인해 나타날 수 있으며, 어류의 건강상태를 나타내는 좋은 지표이다(Heydarnejad et al., 2013). Kim et al. (2021)은 독성물질 노출이 어류의 단백질 합성 또는 세포 기능을 억제시켜 혈장 total pro- tein의 감소를 유발할 수 있으며, 반면 독성물질 노출에 의한 아가미 병변으로 삼투조절장애로 인한 수분 손실로 증가가 나타날 수도 있다고 주장했다. Pane et al. (2003)는 수인성 니켈에 노출된 O. mykiss의 혈장 total protein은 증가했다고 보고했으며, 이는 니켈 노출에 의한 혈장액 부피의 수축에 의한 것이라고 주장했다. Jasim et al. (2022) 역시 수인성 니켈에 노출된 gray mullet, Mugil cephalus의 혈장 total protein의 유의적인 증가를 보고했으며, 이는 metallothioneins와 같은 저분자량 단백질 효소의 합성에 의한 결과라고 주장했다. 반면에, Husna Malik et al. (2016)은 수인성 니켈에 노출된 major carp, Catla catla가 혈장 total protein의 유의적인 감소를 보였으며, 이는 중금속 노출로 인한 간 기능 손상에 의한 것이라고 주장했다. 본 연구에서 수인성 니켈 노출은 48시간 노출에서 유의적인 증가를 유발했지만, 96시간 노출에서 유의적인 감소를 유발하였다. 이러한 결과는 초기 독성물질 노출에 따른 대응을 하기 위한 일시직인 단백질 합성 증가에 의한 것으로 판단되며, 이후 독성물질 노출에 의한 단백질 손실에 따른 감소에 의한 것으로 판단된다.
혈장 AST, ALT 및 ALP는 단백질 및 아미노산 대사에 중요한 역할을 하는 아미노전이효소로, 독성 노출에 따른 어류의 조직 손상 및 기능 장애 시 혈장으로 방출되어 증가할 수 있으며, 이로 인해 독성물질 노출에 의한 조직 손상을 평가하는 중요한 요소이다(Kavitha et al., 2010). Abou-Hadeed et al. (2008)는 이러한 효소들이 손상된 간, 신장, 심장 및 주요 조직에서 순환계로 유입되는 것은 다양한 금속 노출에 따른 독성 영향으로 인해 발생할 수 있으며, 이러한 지표는 생태독성학에서 주요한 바이오마커로 사용할 수 있다고 주장했다. Rahimikia (2017)는 니켈 노출에 따른 C. auratus의 혈장 AST, ALT 및 ALP 활성의 유의적 증가를 보고했으며, 이는 금속 노출에 따른 어류의 생리적, 기능적 변화의 결과라고 주장했다. Banday et al. (2019) 역시 C. gariepinus의 혈장 AST 및 ALT의 증가를 보고했으며, 이는 금속 노출에 따른 간 세포 손상으로 조직에서 혈장으로 AST 및 ALT의 유출에 의한 것이라고 주장했다. Husna Malik et al. (2016)은 니켈 노출에 따른 C. catla의 혈장 ALP의 유의적 증가를 보고했으며, 이는 간 손상 및 신장 기능 장애에 의한 것이라고 주장했다. 본 연구에서 붕어의 혈장 AST 및 ALP는 수인성 니켈 노출에 의해 모두 유의적으로 증가했으며, 이는 니켈 노출에 따른 조직 손상에 의한 것으로 판단된다. 본 연구에서 니켈 노출은 붕어의 혈액 이온조절장애를 유발했을 것으로 판단되며, 다양한 대사 기능 교란 및 금속 독성에 따른 간 손상을 초래했을 것으로 판단된다.
본 실험에서 높은 수준의 수인성 니켈(160 mg Ni2+/l)은 실험어인 붕어의 100% 폐사를 유발하였으며, 수인성 니켈 노출에 따른 붕어의 48시간 반수치사농도는 154.48 mg Ni2+/l, 96시간 반수치사농도는 117.69 mg Ni2+/l로 나타났다. 수인성 니켈 급성 노출(> 40 mg Ni2+/l)은 붕어의 혈액학적 성상 및 혈장 성분의 유의적인 변화를 나타내었다. 본 연구의 결과를 통해 수인성 니켈의 급성 노출에 따른 내성 한계를 확인하였으며, 수인성 니켈이 붕어에 미치는 생리적인 독성 영향을 평가하는 기준지표를 수립하였다. 독성물질의 독성 거동 및 기작은 다양한 환경 조건에 의해 다르게 나타날 수 있기 때문에, 향후 환경 조건에 따른 추가적인 연구를 통해 더욱 정확한 기준의 수립이 필요할 것이다.
- References
-
1. Abou-Hadeed AH, Ibrahim KM, El-Sharkawy NI, Sakr FS, El-Hamed SAA. 2008. Experimental studies on nickel toxicity in Nile tilapia health. In 8th international symposium on tilapia in aquaculture 1385-1401.
-
2. Adhikari S, Sarkar B, Chatterjee A, Mahapatra CT, Ayyappan S. 2004. Effects of cypermethrin and carbofuran on certain hematological parameters and prediction of their recovery in a freshwater teleost, Labeo rohita (Hamilton). Ecotoxicology and Environmental Safety 58: 220-226.
-
3. Alkahem HF. 1994. The toxicity of nickel and the effects of sub- lethal levels on haematological parameters and behaviour of the fish, Oreochromis niloticus. J Univ Kuwait 21: 243-251.
-
4. Alwan SF, Hadi AA, Shokr AE. 2009. Alterations in hematological parameters of fresh water fish, Tilapia zillii, exposed to aluminum. Journal of Science and its Applications 3: 12-19.
-
5. Al-Ghanim KA. 2011. Impact of nickel (Ni) on hematological para- meters and behavioral changes in Cyprinus carpio (common carp). African Journal of Biotechnology 10: 13860-13866.
-
6. Atli G, Ariyurek SY, Kanak EG, Canli M. 2015. Alterations in the serum biomarkers belonging to different metabolic systems of fish (Oreochromis niloticus) after Cd and Pb exposures. Environmental Toxicology and Pharmacology 40: 508-515.
-
7. Authman MM, Zaki MS, Khallaf EA, Abbas HH. 2015. Use of fish as bio-indicator of the effects of heavy metals pollution. Journal of Aquaculture Research & Development 64: 1-13.
-
8. Azmat H, Javed M, Jabeen G. 2012. Acute toxicity of aluminium to the fish (Catla catla, Labeo rohita and Cirrhina mrigala). Pak Vet J 32: 85-87.
-
9. Banday UZ, Swaleh SB, Usmani N. 2019. Insights into the heavy metal-induced immunotoxic and genotoxic alterations as health indicators of Clarias gariepinus inhabiting a rivulet. Ecotoxicology and Environmental Safety 183: 109584.
-
10. Bielmyer GK, DeCarlo C, Morris C, Carrigan T. 2013. The influence of salinity on acute nickel toxicity to the two euryhaline fish species, Fundulus heteroclitus and Kryptolebias marmoratus. Environmental Toxicology and Chemistry 32: 1354-1359.
-
11. Bita S, Balouch A, Mohammadian T. 2021. Determination of lethal concentration (LC50) of silver nanoparticles produced by biological and chemical methods in Asian seabass fish. International Journal of Aquatic Research 1: 7-12.
-
12. Blewett TA, Leonard EM. 2017. Mechanisms of nickel toxicity to fish and invertebrates in marine and estuarine waters. Environmental Pollution 223: 311-322.
-
13. Bougas B, Normandeau E, Pierron F, Campbell PG, Bernatchez L, Couture P. 2013. How does exposure to nickel and cadmium affect the transcriptome of yellow perch (Perca flavescens)-results from a 1000 candidate-gene microarray. Aquatic Toxicology 142: 355-364.
-
14. Brandts I, Barría C, Martins MA, Franco-Martínez L, Barreto A, Tvarijonaviciute A, Teles M. 2021. Waterborne exposure of gilthead seabream (Sparus aurata) to polymethylmethacrylate nanoplastics causes effects at cellular and molecular levels. Journal of Hazardous Materials 403: 123590.
-
15. Brix KV, Keithly J, DeForest DK, Laughlin J. 2004. Acute and chronic toxicity of nickel to rainbow trout (Oncorhynchus mykiss). Environmental Toxicology and Chemistry: An International Journal 239: 2221-2228.
-
16. Brix KV, Schlekat CE, Garman ER. 2017. The mechanisms of nickel toxicity in aquatic environments: An adverse outcome path- way analysis. Environmental Toxicology and Chemistry 36: 1128-1137.
-
17. Brucka-Jastrzebska E, Protasowicki M. 2005. Effects of cadmiun and nickel exposure on haematological parameters of com- mon carp, Cyprinus carpio L. Acta Ichthyologica et Piscatoria 1: 29-38.
-
18. Cempel M, Nikel GJPJS. 2006. Nickel: a review of its sources and environmental toxicology. Polish Journal of Environmental Studies 153: 375-382.
-
19. de Oliveira PR, Bechara GH, Denardi SE, Pizano MA, Mathias MIC. 2011. Toxicity effect of the acaricide fipronil in semi-engorged females of the tick Rhipicephalus sanguineus (Latreille, 1806) (Acari: Ixodidae): Preliminary determination of the minimum lethal concentration and LC50. Experimental Parasitology 127: 418-422.
-
20. Eisler R. 1998. Nickel hazards to fish, wildlife, and invertebrates: a synoptic review, pp. 1-76, US Department of the Interior, US Geological Survey Patuxent Wildlife Research Center.
-
21. Heydarnejad MS, Khosravian-Hemami M, Nematollahi A, Rahnama S. 2013. Effects of copper at sublethal concentrations on growth and biochemical parameters in rainbow trout (Oncor- hynchus mykiss). International Review of Hydrobiology 98: 71-79.
-
22. Hossain Z, Hossain MS, Ema NS, Omri A. 2021. Heavy metal toxicity in Buriganga river alters the immunology of Nile tilapia (Oreochromis niloticus L). Heliyon 7: e08285.
-
23. Husna Malik SS, Akhtar S, Bilal S. 2016. Effect of nickel toxicity on growth parameters and hepatic enzymes in major carp. Indian J Anim Res 50: 370-373.
-
24. Jasim SA, Golgouneh S, Jaber MM, Indiaminov SI, Alsaikhan F, Hammid AT, Norbakhsh M. 2022. Effects of short-term ex- posure to the heavy metal, nickel chloride (Nicl2) on gill his- tology and osmoregulation components of the gray mullet, Mugil cephalus. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology 258: 109361.
-
25. Javed M. 2013. Chronic effects of nickel and cobalt on fish growth. International Journal of Agriculture and Biology 15: 575-579.
-
26. Jezierska B, Ługowska K, Witeska M. 2009. The effects of heavy metals on embryonic development of fish (a review). Fish Physiology and Biochemistry 354: 625-640.
-
27. Karthikeyan S, Palaniappan PLRM, Sabhanayakam S. 2007. Influence of pH and water hardness upon nickel accumulation in edible fish Cirrhinus mrigala. Journal of Environmental Biology 28: 489-492.
-
28. Kavitha C, Malarvizhi A, Kumaran SS, Ramesh M. 2010. Toxico- logical effects of arsenate exposure on hematological, bio- chemical and liver transaminases activity in an Indian major carp, Catla catla. Food and Chemical Toxicology 48: 2848-2854.
-
29. Khayatzadeh J, Abbasi E. 2010. The effects of heavy metals on aquatic animals. In The 1st International Applied Geological Congress, Department of Geology, Islamic Azad University-Mashad Branch 1: 26-28.
-
30. Kim JH, Kim JY, Lim LJ, Kim SK, Choi HS, Hur YB. 2018. Effects of waterborne nitrite on hematological parameters and stress indicators in olive flounders, Paralichthys olivaceus, raised in bio-floc and seawater. Chemosphere 209: 28-34.
-
31. Kim JH, Yu YB, Choi JH. 2021 Toxic effects on bioaccumulation, hematological parameters, oxidative stress, immune responses and neurotoxicity in fish exposed to microplastics: A review. Journal of Hazardous Materials 413: 125423.
-
32. Ko HD, Park HJ, Kang JC. 2019. Change of growth performance, hematological parameters, and plasma component by hexa- valent chromium exposure in starry flounder, Platichthys stellatus. Fisheries and Aquatic Sciences 22: 1-7.
-
-
34. Kubrak OI, Rovenko BM, Husak VV, Storey JM, Storey KB, Lushchak VI. 2012. Nickel induces hyperglycemia and glycogenolysis and affects the antioxidant system in liver and white muscle of goldfish Carassius auratus L. Ecotoxicology and Environmental Safety 80: 231-237.
-
35. Lee JW, Kim JH, Park SH, Choi KR, Lee HJ, Yoon JD, Jang MH. 2013. Impact of largemouth bass (Micropterus salmoides) on the population of Korean native fish, crucian carp (Carassius auratus). Korean Journal of Environmental Biology 31: 370-375.
-
36. Lewis Jr, WM, Morris DP. 1986. Toxicity of nitrite to fish: a review. Transactions of the American Fisheries Society 115: 183-195.
-
37. Molayemraftar T, Peyghan R, Jalali MR, Shahriari A. 2022. Single and combined effects of ammonia and nitrite on common carp, Cyprinus carpio: Toxicity, hematological parameters, antioxidant defenses, acetylcholinesterase, and acid phos- phatase activities. Aquaculture 548: 737676.
-
38. Moosavi MJ, Shamushaki VAJ. 2015. Effect of sub-acute exposure to nickel on hematological and biochemical indices in gold fish (Carassius auratus). J Clin Toxicol 3: 228-232.
-
39. Ololade IA, Oginni O. 2010. Toxic stress and hematological effects of nickel on African catfish, Clarias gariepinus, fingerlings. Journal of Environmental Chemistry and Ecotoxicology 2: 014-019.
-
40. Palermo FF, Risso WE, Simonato JD, Martinez CB. 2015. Bioaccumu- lation of nickel and its biochemical and genotoxic effects on juveniles of the neotropical fish Prochilodus lineatus. Ecotoxicology and Environmental Safety 116: 19-28.
-
41. Pandit DN, Kumari V, Garhwal N. 2018. Lead Induced Alterations in Serum Biochemical Features of an Indian Air-Breathing Catfish, Clarias batrachus (Linnaeus). Int J Chem Sci 16: 294.
-
42. Pandit DN, Sharma S. 2019. Evaluation of short term stress of lead on certain hematological biomarkers in an Indian air breathing fish, Channa punctatus (Bloch). Trends in Fisheries Research 8, 2319-4758.
-
43. Pane EF, Richards JG, Wood CM. 2003. Acute waterborne nickel toxicity in the rainbow trout (Oncorhynchus mykiss) occurs by a respiratory rather than ionoregulatory mechanism. Aquatic Toxicology 63: 65-82.
-
44. Pandey G, Madhuri S. 2014. Heavy metals causing toxicity in animals and fishes. Research Journal of Animal, Veterinary and Fishery Sciences 2: 17-23.
-
45. Parthipan P, Muniyan M. 2013. Effect of heavy metal nickel on hematological parameters of fresh water fish, Cirrhinus mrigala. Journal of Environment and Current Life Science 1: 46-55.
-
46. Poléo AB, Schjolden J, Sørensen J, Nilsson GE. 2017. The high tolerance to aluminium in crucian carp (Carassius carassius) is associated with its ability to avoid hypoxia. Plos One 12: e0179519.
-
47. Pourkhabbaz A, Khazaei T, Behravesh S, Ebrahimpour M, Pourkhabbaz H. 2011. Effect of water hardness on the toxicity of cobalt and nickel to a freshwater fish, Capoeta fusca. Biomedical and Environmental Sciences 24: 656-660.
-
48. Rahimikia E. 2017. Analysis of antioxidants and serum biochemical responses in goldfish under nickel exposure by sub-chronic test. Journal of Applied Animal Research 45: 320-325.
-
49. Ramesh M, Sankaran M, Veera-Gowtham V, Poopal RK. 2014. Hematological, biochemical and enzymological responses in an Indian major carp Labeo rohita induced by sublethal concentration of waterborne selenite exposure. Chemico-Biological Interactions 207: 67-73.
-
50. Ribeiro CO, Neto FF, Mela M, Silva PH, Randi MAF, Rabitto IS, Pelletier E. 2006. Hematological findings in neotropical fish Hoplias malabaricus exposed to subchronic and dietary doses of methylmercury, inorganic lead, and tributyltin chloride. Environmental Research 101: 74-80.
-
51. Schjolden J, Sørensen J, Nilsson GE, Poléo AB. 2007. The toxicity of copper to crucian carp (Carassius carassius) in soft water. Science of the Total Environment 384: 239-251.
-
52. Seriani R, de Souza Abessa DM, Kirschbaum AA, Pereira CDS, Romano P, Ranzani-Paiva MJT. 2011. Relationship between water toxicity and hematological changes in Oreochromis niloticus. Brazilian Journal of Aquatic Science and Technology 15: 47-53.
-
53. Sfakianakis DG, Renieri E, Kentouri M, Tsatsakis AM. 2015. Effect of heavy metals on fish larvae deformities: a review. Environ- mental Research 137: 246-255.
-
54. Shin KW, Kim SH, Kim JH, Hwang SD, Kang JC. 2016. Toxic effects of ammonia exposure on growth performance, hematological parameters, and plasma components in rockfish, Sebastes schlegelii, during thermal stress. Fisheries and Aquatic Sciences 19: 1-8.
-
55. Soldatov AA. 2021. Content of Methemoglobin in the Blood of Teleost Fish: Effect of Environmental Factors and Natural States of the Organism. Inland Water Biology 14: 747-757.
-
56. Svecevičius G. 2010. Acute toxicity of nickel to five species of freshwater fish. Polish Journal of Environmental Studies 19: 453-456.
-
57. Todorova K, Velcheva I, Yancheva V, Stoyanova S, Dimitrova P, Tomov S, Georgieva E. 2019. Interactions of lead with other heavy metals (cadmium, nickel and zinc) in toxic effects on the histological structure of gills of the common carp Cyprinus carpio Linnaeus, 1758. Acta Zool Bulgar 711: 95-102.
-
58. Topal A, Atamanalp M, Oruç E, Erol HS. 2017. Physiological and biochemical effects of nickel on rainbow trout (Oncorhynchus mykiss) tissues: assessment of nuclear factor kappa B activa- tion, oxidative stress and histopathological changes. Chemo- sphere 166: 445-452.
-
59. Ullah A, Rehman HU, Awais S, Ahsan M, Sardar AM, Muhammad N, Saeed K. 2016. Investigation of acute toxicity and LC50 value of Cu for a fish Oreochromis niloticus. J Entomol Zool Stud 4: 605-607.
-
60. Verma RS. 2012. Acute toxicity of nickel to fresh water prawns. Turkish Journal of Zoology 36: 534-542.
-
61. Vinodhini R, Narayanan M. 2009. The impact of toxic heavy metals on the hematological parameters in common carp (Cyprinus carpio L.). Journal of Environmental Health Science & Engineering 6: 23-28.
-
62. Walker AM, Copatti CE, Melo FV, Melo JF. 2020. Metabolic and physiological responses to intraperitoneal injection of chro- mium oxide in hyperglycaemic Nile tilapia juveniles. Aqua- culture 517: 734821.
-
63. Wang Z, Yeung KW, Zhou GJ, Yung MM, Schlekat CE, Garman ER, Leung KM. 2020. Acute and chronic toxicity of nickel on fresh- water and marine tropical aquatic organisms. Ecotoxicology and Environmental Safety 206: 111373.
-
64. Witeska M. 2005. Stress in fish-hematological and immunological effects of heavy metals. Electronic Journal of Ichthyology 1: 35-41.
-
65. Yunus K, Jaafar AM, Akbar J. 2019. Acute-lethal toxicity (LC50) Effect of Terminalia Catappa Linn. leaves extract on Oreochromis niloticus (Red Nile Tilapia) juveniles under static toxicity ex- posure. Oriental Journal of Chemistry 35: 270-274.












