JMLS 2022 December;7(2):86-93. 10.23005/ksmls.2022.7.2.86 Epub 2022 December 14
Copyright © 2022 by The Korean Society of Marine Life Science
A Study of Environmental Conditions of Survival Rate and Relative Growth Rate in Female Gametophyte of Undaria pinnatifida for Toxicity Assessment
Ju-Wook Lee; West Sea Fisheries Research Institute, National Institute of Fisheries Science, Incheon 22383, Korea
Yun-Ho Park; Environmental Measurement & Analysis Center, National Institute of Environmental Research, Incheon 22689, Korea
Bo-Ram Sim; West Sea Fisheries Research Institute, National Institute of Fisheries Science, Incheon 22383, Korea
Hyong-Joo Jeon; West Sea Fisheries Research Institute, National Institute of Fisheries Science, Incheon 22383, Korea
Seung Heo; West Sea Fisheries Research Institute, National Institute of Fisheries Science, Incheon 22383, Korea
Un-Ki Hwang; Marine Environment Research Division, National Institute of Fisheries Science, Busan 46083, Korea
- Abstract
미역(Undaria pinnatifida) 포자를 사용한 생태독성 시험법은 연중 상시 이용하기에 어렵다. 미역의 암배우체는 실험실에서 배양할 수 있기 때문에, 포자의 단점을 보완하고 상시 생태독성 시험에 사용할 수 있다. 따라서 미역의 암배우체를 생태독성 시험에 활용하기 위해 다양한 환경조건에 노출된 미역의 암배우체 생존율과 상대성장률의 변화를 분석하였다. 미역 암배우체는 염분(5~40 psu), 온도(5~30℃), pH (2~10), 광량(0~120 μmol photon m-2 s-1)에 노출되었다. 암배우체의 생존율은 최고 평균값을 기준으로 온도 20℃, 염분 27.5 psu, pH 8, 광량 30 μmol photon m-2 s-1에서 가장 높았다. 상대성장률은 최고 평균값을 기준으로 온도 15℃, 염문 35 psu, pH 9, 광량 60 μmol photon m-2 s-1에서 가장 높았다. 본 연구결과를 통해 미역 암배우체의 생존율과 상대성장률을 활용하여 연안환경을 상시 신속하게 평가하기 위한 효율적인 방법으로 활용이 기대된다.
The ecotoxicity test method using Undaria pinnatifida spore is challenging to use throughout the year. Since U. pinnatifida female gametophytes can be cultured in the laboratory, they can be used for ecotoxicity testing at any time. Changes in female gametophyte survival rate and relative growth rate in U. pinnatifida exposed to various environmental conditions were analyzed. The female gametophyte of U. pinnatifida was exposed to salinity (5~40 psu), temperature (5~30℃), pH (4~10), and light intensity (0~120 μmol photon m-2 s-1). Based on the highest average value, the survival rate of female gametophyte was highest at a temperature of 20°C, salinity 27.5 psu, pH 8, and light intensity 30 μmol photon m-2 s-1. And the relative growth rate was highest at a temperature of 15°C, salinity 35 psu, pH 9, and light intensity of 60 μmol photon m-2 s-1. As a result of this study, the method using the optimal conditions for the survival rate and relative growth rate is expected to be a practical test method that can complement the current method.
Keywords: Survival rate(생존율) Relative growth rate(상대성장률) Optimal growth condition(최적환경조건) Female gametophyte(암배우체) Undaria pinnatifida(미역)
Correspondence to: Un-Ki Hwang; Marine Environment Research Division, National Institute of Fisheries Science, Busan 46083, Korea
- Received
- 20 May 2022;
- Revised
- 19 August 2022;
- Accepted
- 31 October 2022.
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Language: Korean/English,
Full Text:

서 론
WET (Whole Effluent Toxicity) test는 수생태계의 독성 화학물질을 관리하기 위한 통합적인 생태독성평가 방법으로 US EPA에서 개발하였다(de Vlaming et al., 2000; Ra et al., 2016). WET test는 독성물질에 노출된 수생생물의 물리적 및 생리학적 변동을 통하여 생물에게 미치는 독성영향을 직접적으로 평가한다(Libralato et al., 2010). 현재 전세계적으로 어류, 발광박테리아, 이매패류, 플랑크톤, 미세조류와 같은 다양한 생태학적 위치의 수생생물을 이용하여 생태독성평가 방법이 개발되었다(Han et al., 2008; Hwang et al., 2016; Lee et al., 2020; Libralato et al., 2010). 우리나라 또한 무척추동물, 플랑크톤, 해조류 등 6종의 해양생물을 이용한 생태독성시험 방법을 개발하고 2018년 해양생물공정시험기준에 등록하여 연안환경을 평가하기 위한 도구로 활용하고 있다(MOF, 2018).
현재 해양생물공정시험법에 등재된 미역(Undaria pinnatifida)과 다시마(Saccharina japonica)는 각 생물의 포자를 오염물질에 노출하여 포자발아율, 배우체성장률 및 아포체성장률을 관찰한다(MOF, 2018). 하지만 미역과 다시마의 포자를 이용한 생태독성평가 방법은 연중 생태독성평가를 활용하는데 있어 제한적이다(Lee, 2021). 일반적으로 우리나라에서 미역과 다시마와 같은 갈조류는 포자의 성숙이 봄철에 시작되어 여름에 충분히 성숙한 포자가 방출되며(Primo et al., 2010), 암 · 수배우체로 성장하여 포자체를 형성하고 성체로 성장하는 반수체-이배체 생활주기를 나타낸다(Fig. 1). 이로 인해 생태독성평가에 활용될 양질의 포자 수확은 봄~여름철로 한정된다. 또한 해양생물공정시험기준 미역과 다시마의 포자가 배우체와 아포체로 성장하기 위해서 약 7~21일의 노출시간이 필요하기 때문에(MOF, 2018), 신속하게 연안환경 및 생태독성을 평가하기에 어렵다.
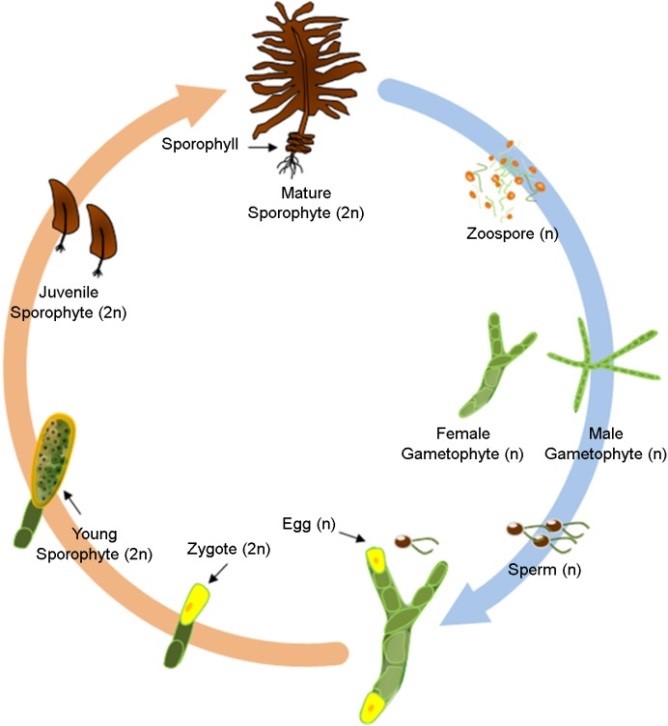
Fig. 1. Life cycle of Undaria pinnatifida
위와 같은 제한사항을 보완하기 위하여 갈조류의 배우체를 이용한 생태독성평가 방법을 고려할 필요가 있다. 갈조류의 암 · 수배우체는 각 배우체가 개별적으로 분리된 통제된 조건에서 다음 생활사로 발달이 진행되지 않고 유사분열만 진행된다(Liu et al., 2016). 따라서 유사분열로 인해 배우체 단계를 유지하며 지속적인 계대배양이 가능하기 때문에(Jiang et al., 2003), 해조류를 이용한 생태독성평가 방법을 연중 상시 활용할 수 있다. 하지만 갈조류의 암 · 수배우체는 세포구조, 환경내성 및 유전적 차이로 인해 동일한 최적환경조건 및 내성한계를 가지고 있다고 판단할 수 없기 때문에 각 배우체가 독립적으로 연구될 필요가 있다(Liu et al., 2016; Sato et al., 2020; Wang et al., 2011). 특히, 갈조류의 암배우체는 수배우체에 비해 영양성장과 질소고정 능력이 높기 때문에 암배우체의 세포는 많은 바이오매스(Biomass)를 축적할 수 있다(Liu et al., 2016). 이로 인해 수배우체 세포보다 암배우체 세포의 크기가 대략 2~4배 크기 때문에 관찰이 용이하고 세포 내 생리활성을 분석하기에 유리하다. 따라서 본 연구는 해조류를 연중 상시 생태독성평가를 적용하기 위하여, 우리나라에서 주로 양식되고 있는 갈조류인 미역 암배우체의 환경조건(온도, 염분, pH 및 광량)에 따른 생존율 및 상대성장률 변동을 분석하고 최적환경조건을 정립하고자 하였다.
재료 및 방법
1. 시험생물
시험에 사용된 미역(Undaria pinnatifida)의 암배우체는 국립수산과학원 수산종자육종연구소에서 분양받았다. 암배우체는 광주기 12 Light : 12 Dark, 온도 15℃에서 PESI 배양액(Tatewaki, 1966)으로 1개월 이상 계대배양 하였다(Table 1). 규조류의 성장을 억제하기 위해 1 mg l-1로 GeO2 (Germanium (IV) oxide, Sigma-Aldrich, St.Louis, USA)를 배양액에 첨가하였다.

2. 암배우체 전처리
미역 암배우체 1.0 g을 PESI 배양액 100 ml에 넣어 mixer (HR2607, Koninklijke Philips N.V., Amsterdam, Netherlands)를 이용하여 30초 분쇄하였다. 분쇄한 암배우체는 50 μm sieve로 여과하여 크기가 50 μm 이상 암배우체는 제거하였다. 여과된 암배우체를 50 ml tube에 넣고 광주기 12 Light : 12 Dark, 온도 15℃, 광량 10 μmol photon m-2 s-1에서 3일간 회복을 유도하였다. 3일 후 50 ml tube의 암배우체를 50 μm sieve로 여과하여 50 μm 이하의 작고 손상된 암배우체를 제거 및 약 50~60 μm 크기의 암배우체를 선별하였다. 선별된 암배우체는 혈구계산판(hemocytometer)를 이용하여 400 female gametophytes ml-1로 정량하였다. GeO2를 0.1 mg l-1의 농도로 첨가하여 규조류 오염을 방지하였고 사전실험을 통하여 암배우체에 영향이 없는 것을 확인하였다(Shea and Chopin, 2007).
3. 환경조건 설정
미역 암배우체의 환경조건의 범위는 온도(5~32.5℃, 간격 2.5℃), 염분(5~40 psu, 간격 2.5), pH(4~10, 간격 1.0) 및 광량(0~120 μmol photon m-2 s-1, 간격 10 μmol photon m-2 s-1)으로 설정하였고, 미역 암배우체의 생존율 및 상대성장률의 최적환경조건 및 내성한계를 명확히 파악할 수 있도록 사전 예비실험을 통하여 설정되었다.
4. 암배우체 생존율의 최적환경조건 연구
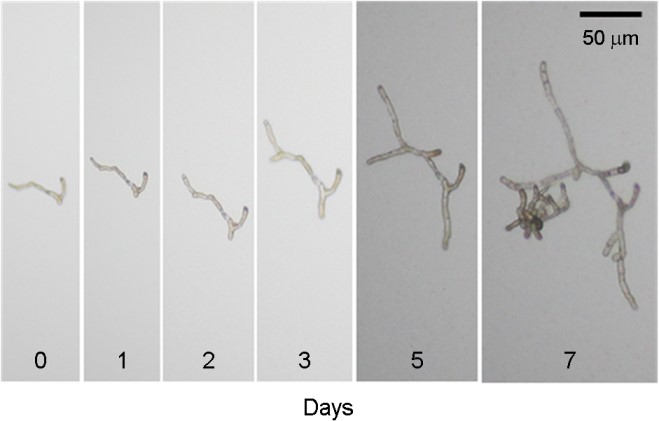
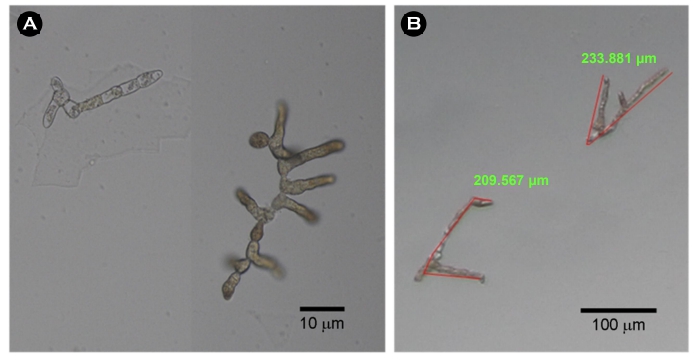
미역 암배우체의 생존율을 분석하기 위하여 다양한 염분, 온도, pH 및 광량에 노출하였다. 96 wells plate의 각 well에 배양액 0.25 ml 분주하고 400 female gametophyte ml-1 농도로 암배우체를 주입하였다. 주입된 암배우체는 온도(5~32.5℃), 염분(5~40 psu), pH (4~10), 광량(0~120 μmol photon m-2 s-1) 조건에서 3일 노출 후, 광학현미경(IX70, Nikon Co., Tokyo, Japan)을 이용하여 생존율을 측정하였다. 생존율은 예비실험을 통하여 배우체의 유의한 성장이 최초로 관찰되는 3일 이후(Fig. 2) 무작위로 관찰된 100개의 암배우체의 생존 유 · 무를 계수하여 아래와 같은 방법으로 산출하였다. 생존율은 암배우체의 세포가 손상되어 투명하게 변화된 경우에 사멸로 판단하였고(Fig. 3), 각 측정은 3반복 수행되었다.
생존율(%) = $S_t / S_0 \times 100$
($S_0$ = 전체 암배우체 수, S = 생존한 암배우체 수, t = 노출시간)
5. 암배우체 상대성장률의 최적환경조건 연구
암배우체의 상대성장률의 최적조건을 분석하기 다양한 염분, 온도, pH, 광량에 노출하였다. 96 wells plate의 각 well에 배양액 0.25 ml 분주하고 400 female gametophyte ml-1 농도로 주입하였다. 암배우체의 초기 길이는 광학현미경(IX70, Nikon Co., Tokyo, Japan) 및 이미지분석 프로그램(iWorks 2.0, Nahwoo Trading Co., Suwon, Korea)을 이용하여 무작위로 선정된 100개의 암배우체의 길이를 측정하였다. 주입된 암배우체는 온도(5~32.5℃), 염분(5~40 psu), pH (4~10), 광량(0~120 μmol photon m-2 s-1) 조건에서 5일 노출 후, 광학현미경 및 이미지분석 프로그램을 이용하여 측정하였다. 배우체는 정확한 길이측정이 가능한 최대 배양기간 5일 이후(Fig. 2), 무작위로 선정된 100개의 암배우체의 길이를 측정하였다. 암배우체의 길이는 현미경에서 관찰되는 모든 길이를 측정하여(Fig. 3) 아래와 같은 방법으로 상대성장률을 계산하였고 각 측정은 3반복 수행되었다.
상대성장률 = $(lnG_t-lnG_0)/t$
($G_0$= 초기 암배우체 길이, $G_t$ = 노출 후 암배우체 길이, t = 노출시간)
6. 통계분석
환경조건 변화에 따른 실험군 사이의 유의성 비교를 위하여 IBM SPSS Statistics ver. 20 (IBM Co., New York, USA) 프로그램의 일원분산분석(ANOVA)과 Tukey 다중비교 테스트를 사용하였고 유의수준은 p<0.05로 설정하였다.
결 과
1. 암배우체 생존율의 최적환경조건
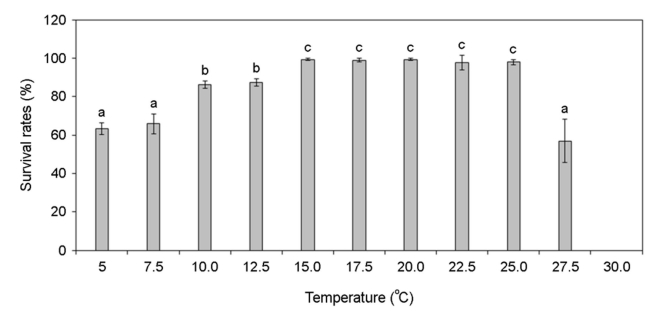
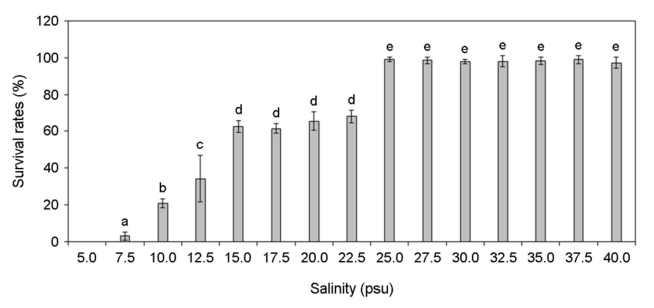
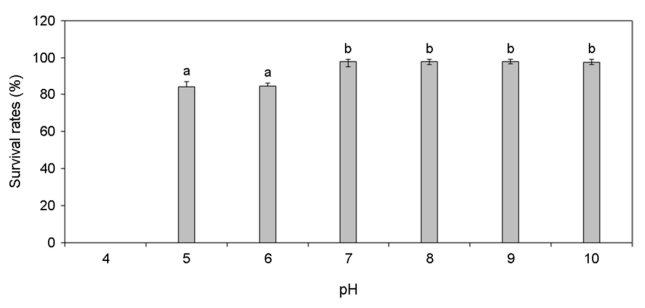
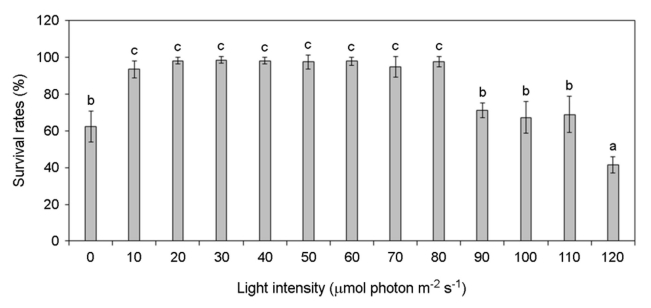
각기 다른 온도, 염분, pH, 광량에 노출된 미역 암배우체의 생존율 변화를 분석하였다. 암배우체는 온도 증가할수록 생존율이 증가하였고 15~25℃에서 가장 높은 생존율을 나타냈으나 27.5℃부터 생존율이 급격히 감소하여 30℃에서 모두 사멸하였다(Fig. 4). 염분 5 psu에서 생존하지 못하였으나 염분이 증가할수록 생존율이 증가하였고 염분 25~40 psu에서 가장 높은 생존율이 나타났다(Fig. 5). pH 4 이하에서는 생존하지 못하였으나 pH 5 이상부터 생존률이 나타났고 pH 7~10에서 가장 높은 생존율이 나타났다(Fig. 6). 그리고 광량이 없는 경우에도 생존하였으며, 10~80 μmol photon m-2 s-1에서 가장 생존율이 높았고 90 μmol photon m-2 s-1 이상의 광량에서는 생존율 저하가 나타났다(Fig. 7). 암배우체의 생존율은 최고 평균값을 기준으로 온도 20℃, 염분 27.5 psu, pH 8, 광량 30 μmol photon m-2 s-1에서 가장 높았다.
2. 암배우체 상대성장률의 최적환경조건
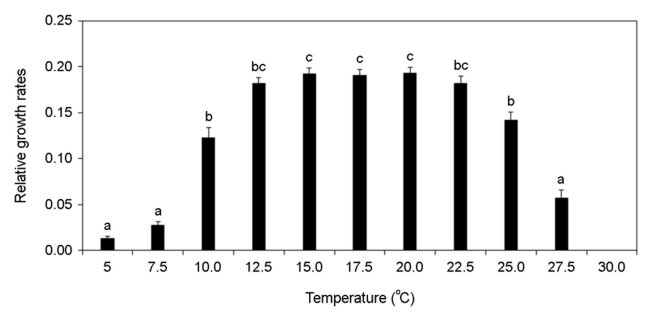
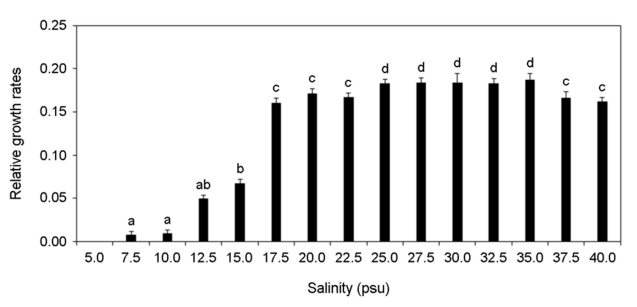
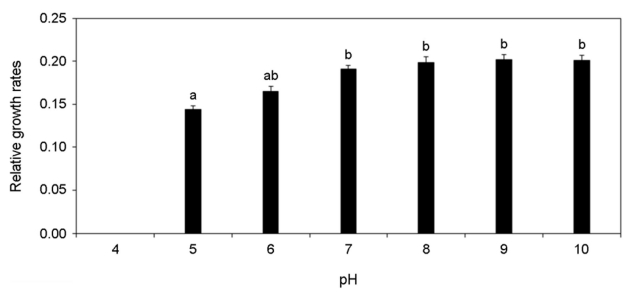
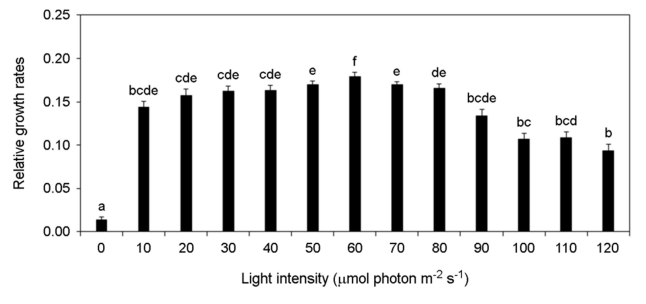
각기 다른 온도, 염분 pH, 광량에 노출된 미역 암배우체의 상대성장률 변화를 분석하였다. 암배우체는 온도가 증가할수록 상대성장률이 증가하였고 15~20℃에서 가장 높은 상대성장률이 가장 높게 나타났으나 25℃부터 상대성장률이 감소하여 30℃에서 모두 사멸하였다(Fig. 8). 염분 5 psu에서 암배우체가 모두 사멸하였으나 염분이 증가할수록 상대성장률이 증가하였고 염분 25~35 psu에서 가장 상대성장률이 높게 나타났다(Fig. 9). pH 4 이하에서 암배우체가 모두 사멸하였으나 pH 5부터 상대성장률이 증가하기 시작하여 pH 7~10에서 상대성장률이 높게 나타났다(Fig. 10). 그리고 광량이 증가할수록 상대성장률이 증가하였으며, 60 μmol photon m-2 s-1에서 가장 높은 상대성장률이 나타났으나 90 μmol photon m-2 s-1 이상의 광량에서 상대성장률이 감소되었다(Fig. 11). 암배우체의 상대성장률은 최고 평균값을 기준으로 온도 15℃, 염분 35 psu, pH 9, 광량 60 μmol photon m-2 s-1에서 가장 높았다.
고 찰
미역과 같은 해조류의 성장 및 발달은 온도와 광량 같은 환경요인에 영향을 받는다(Morelissen et al., 2013). 포자체와 배우자체 사이에서 나타나는 반수체-이배체 생활주기를 가지고 있는 미역은 여러 계절에 걸쳐 발달 및 성장하기 때문에, 포자, 배우체, 포자체 등 생활사에 따라 최적환경조건에 차이가 있다(Liu et al., 2016; Watanabe et al., 2014). 따라서 미역의 암배우체를 생태독성평가에 활용하기 위해서는 암배우체의 최적환경조건 및 내성한계를 구명하는 것이 중요하다.
본 연구의 각 환경조건은 해조류의 성장에 중요한 요소이다(Morelissen et al., 2013). 염분은 광합성 효율과 탄소대사에 영향을 미치기 때문에 해조류의 성장에 중요하다(Bollen et al., 2016). 선행 연구에서도 미역 암배우체는 염분 20~34 psu에서 가장 많이 성장하였고(Peteiro and Sanchez, 2012), 16 psu 이하의 염분에서 짧은 시간 생존은 가능하였으나 시간이 지날수록 세포손상이 발생하여 사멸하였다(Bollen et al., 2016). 이는 본 연구에서 염분 22.5 psu에서 생존율이 감소하고 염분 15 psu에서 상대성장률이 급격하게 감소하는 결과와 일치한다. 온도는 광합성에 직접적인 영향을 미치기 때문에 해조류의 분포와 생활사에 매우 중요한 환경요소이다(James et al., 2015). James et al. (2015)에 따르면 미역의 최적성장온도는 10~22℃로 나타났으며, 24℃ 이상의 온도에서 성장이 감소하기 시작했다. 본 연구결과에서도 유사하게 10℃ 이하와 25℃ 이상에서 성장률이 급격히 감소하였다. pH 또한 해조류의 세포대사과정 및 성장에 영향을 줄 수 있는 환경요소이다(Leal et al., 2017). Gibbson and Kropf (1991)은 낮은 pH가 갈조류(Pelvetia fastigiata)의 초기생활사의 발달을 억제하는 것으로 보고하였고, 홍조류(Pyropia hautanensis)와 갈조류(Ecklonia cava) 또한 낮은 pH에서 광합성 효율을 감소시켰다(Leal et al., 2017). pH가 7 이하로 소폭 감소하는 경우 해수의 탄소량을 증가시켜 광합성 능력을 일시적으로 증가할 수도 있지만, 지속적으로 낮은 pH 환경은 결과적으로 해조류 배우체의 성장을 억제하였다(Gao et al., 2019). 광(Light)은 해조류의 성장과 성숙에 가장 중요한 환경요소이다(Takahide et al., 2017). 일반적으로 엽체 단계의 미역은 50~100 μmol photon m-2 s-1의 광량에서 가장 빠르게 성장하고 광이 없는 환경에서 성장이 나타나지 않았다(Takahide et al., 2017). 하지만 미역의 배우체는 10 μmol photon m-2 s-1의 매우 낮은 광량에서도 성장할 수 있어 수 m 깊이에서도 성장이 가능하고(Morelissen et al., 2013), 이로 인해 해수면 아래 바위 또는 지반에 부착하여 성장이 가능하다. Watanabe et al. (2014)는 미역 엽체의 최대 광합성 포화광량을 119.5 μmol photon m-2 s-1로 보고하였고, Zou et al. (2003)은 미역의 배우체가 82 μmol photon m-2 s-1 이상의 광량에서 억제된다고 보고하였다. 이는 90 μmol photon m-2 s-1 이상부터 암배우체의 생존율과 성장률이 급격하게 감소되는 본 연구의 결과와 매우 유사한 경향을 나타냈다.
본 연구결과 암배우체의 생존율과 상대성장률은 유사한 최적환경조건을 나타내었고, 생태독성평가를 위한 미역 암배우체 생존율과 상대성장률의 최적조건은 가장 높은 평균값을 기준으로 온도 15℃, 염분 30, pH 8, 광량 60 μmol photon m-2 s-1으로 분석되었다. 이러한 연구결과를 바탕으로 미역 암배우체의 생존율과 상대성장률을 활용하여 현재 해양생물공정시험법 해조류 평가방법을 보완하여 연안환경을 상시 신속하게 평가하는 도구로써 활용이 기대된다.
- References
-
1. Bollen M, Pilditch CA, Battershill CN, Bischof K. 2016. Salinity and temperature tolerance of the invasive alga Undaria pinnatifida and native New Zealand kelps: Implications for competition. Mar Biol 163: 1-14.
-
2. de Vlaming V, Connor V, DiGiorgio C, Bailey HC, Deanovic LA, Hinton DE. 2000. Application of whole effluent toxicity test procedures to ambient water quality assessment. Environ Toxicol Chem 19: 42-62.
-
3. Gao X, Kim JH, Park SK, Yu OH, Kim YS, Choi HG. 2019. Diverse responses of sporophytic photochemical efficiency and gametophytic growth for two edible kelps, Saccharina japonica and Undaria pinnatifida, to ocean acidification and warming. Mar Pollut Bull 142: 315-320.
-
4. Gibbon BC, Kropf DL. 1991. pH gradients and cell polarity in Pelvetia zygotes. Protoplasma 163: 43-50.
-
5. Han TJ, Han YS, Park GS, S Lee M. 2008. Development marine ecotoxicological standard methods for Ulva sporulation test. Kor J Soc Ocean 13: 121-128.
-
6. Hwang UK, Ryu HM, Heo S, Chang SJ, Lee KW, Lee JW. 2016. Effect of heavy metals on the survival and population growth rates of marine rotifer, Brachionus plicatilis. Korean J Environ Biol 34: 353-360.
-
7. James K, Kibele J, Shears NT. 2015. Using satellite-derived sea surface temperature to predict the potential global range and phenology of the invasive kelp Undaria pinnatifida. Biological Invasions 17: 3393-3408.
-
8. Jiang P, Qin S, Tseng CK. 2003. Expression of the lacZ reporter gene in sporophytes of the seaweed Laminaria japonica (Phaeophyceae) by gametophyte-targeted transformation. Plant Cell Rep 21: 1211-1216.
-
9. Lee JW, Choi H, Park YH, Lee SM, Choi YS, Heo S, Hwang UK. 2020. Toxic evaluation of antifouling paint (Irgarol and Diuron) using the population growth rate of marine diatom, Skeletonema costatum. JMLS 5: 1-8.
-
10. Lee JW. 2021. Toxicity assessment of eight antifouling booster biocides on spore and female gametophyte of brown alga Undaria pinnatifida. Pukyong National University.
-
11. Libralato G, Annamaria VG, Francesco A. 2010. How toxic is toxic? A proposal for wastewater toxicity hazard assessment. Eco- toxicol Environ Saf 73: 1602-1611.
-
12. Liu F, Pang SJ, Gao SQ. 2016. Growth performance of unialgal gametophytes of the brown alga Saccharina japonica in mass culture conditions. J Appl Phycol 28: 1145-1152.
-
13. Leal PP, Hurd CL, Fernandez PA, Roleda MY. 2017. Meiospore development of the kelps Macrocystis pyrifera and Undaria pinnatifida under ocean acidification and ocean warming: independent effects are more important than their inter- action. Mar Biol 164: 7.
-
14. MOF. 2018. Marine Environment Standard Method, Part 3 Marine Organism Standard Method. Ministry of Oceans and Fisheries. Sejong, Korea. pp 115-123.
-
15. Morelissen B, Dudley BD, Geange SW, Phillips NE. 2013. Gameto- phyte reproduction and development of Undaria pinnatifida under varied nutrient and irradiance conditions. J Exp Mar Biol Ecol 448: 197-206.
-
16. Peteiro C, Sanchez N. 2012. Comparing salinity tolerance in early stages of the sporophytes of a non-indigenous kelp (Undaria pinnatifida) and a native kelp (Saccharina latissima). Russ J Mar Biol 38: 197-200.
-
17. Primo C, Hewitt CL, Campbell ML. 2010. Reproductive phenology of the introduced kelp Undaria pinnatifida (Phaeophyceae, Laminariales) in Port Phillip Bay (Victoria, Australia). Biol Invasions 12: 3081-3092.
-
18. Ra JS, Jeong TY, Lee SH, Kim SD. 2016. Application of toxicity identification evaluation procedure to toxic industrial effluent in South Korea. Chemosphere 143: 71-77.
-
19. Sato Y, Edo H, Oikawa H, Kanematsu K, Naka H, Mogamiya M, Kawano S, Kazama Y. 2020. Sexual difference in the optimum environmental conditions for growth and maturation of the brown alga Undaria pinnatifida in the gametophyte stage. Genes 11: 944.
-
20. Shea R, Chopin T. 2007. Effects of germanium dioxide, an inhibitor of diatom growth, on the microscopic laboratory cultivation stage of the kelp, Laminaria saccharina. J Appl Phycol 19: 27-32.
-
21. Takahide Y, Hisayuki A, Saori S, Ryo I, Akira M, Yutaka O. 2017. Effects of light conditions on the growth of commercial seaweed Undaria pinnatifida. Afr J Plant Sci 11: 190-196.
-
22. Tatewaki M. 1966. Formation of a crustose sporophyte with uni- locular sporangia in Scitosiphon lomentaria. Phycologia 6: 62-66.
-
23. Wang B, Zhang E, Gu Y, Ning S, Wang Q, Zhoua J. 2011. Cryopres- ervation of brown algae gametophytes of Undaria pinnatifida by encapsulation-vitrification. Aquaculture 317: 89-93.
-
24. Watanabe Y, Nishihara GN, Tokunaga S, Terada R. 2014. The effect of irradiance and temperature responses and the phenology of a native alga, Undaria pinnatifida (Laminariales), at the southern limit of its natural distribution in Japan. J Appl Phycol 26: 2405-2415.
-
25. Zou D, Gao K, Xia J. 2003. Photosynthetic utilization of inor- ganic carbon in the economic brown alga, Hizikia fusiforme (Sargassaceae) from the south china sea. J Phycol 39: 1095-1100.












