JMLS 2022 June;7(1):45-51. 10.23005/ksmls.2022.7.1.45 Epub 2022 June 18
Copyright © 2022 by The Korean Society of Marine Life Science
Survival and Physiological Response of Hybrid Grouper(Epinephleus bruneus♀ × Epinephleus lanceolatus♂)Exposed to Different Salinity Water
Yun Kyung Shin; Aquaculture Industry Research Division, South Sea Fisheries Research Institute,National Institute of Fisheries Science, Yeosu 59780, Korea
Young Jae Choi; Inland Fisheries Research Institute, National Institute of Fisheries Science, Geumsan 32762, Korea
Hyun Woo Gil; Aquaculture Industry Research Division, South Sea Fisheries Research Institute,National Institute of Fisheries Science, Yeosu 59780, Korea
Hyo Won Kim; Aquaculture Industry Research Division, South Sea Fisheries Research Institute,National Institute of Fisheries Science, Yeosu 59780, Korea
- Abstract
대왕자바리의 대량생산을 위한 적정 염분을 구명하였다. 각 염분별 노출시킨 대왕자바리의 생존율은 0 psu에서 노출 4일째 모두 폐사하였으며, 염분 5 psu 이상에서 생존율은 100%였다. 성장률은 염분 5 psu 이상에서 염분 상승에 따라 체중과 체장은 모두 증가하였으며, 염분 30 psu (대조구)에서 성장률은 가장 높았다. 먹이섭취량은 염분이 하강함에 따라 감소하는 경향을 보였다. 염분 3 psu에서 먹이섭취는 없었으며, 염분 20, 25 및 30 psu 간에 유의한 차이는 없었다. 염분별 혈액 삼투질농도는 염분 5~30 psu에서 341~368 mg Osmol/㎏였다. 염분변화에 따른 산소소비율은 30 psu(대조구)에서 163.6±22.3 mg O2/㎏ fish/h으로 유의하게 높았다. 염분변화에 따른 SOD, CAT 및 GSH-PX는 염분 15 psu에서 가장 높았다. 따라서 대왕자바리 생존 최저 임계염분은 5 psu이며, 양성을 위한 적정 염분은 20~30 psu으로 추정된다.
The profer salinity range for aquaculture of hybrid grouper (Epinephleus bruneus♀ ×Epinephleus lanceolatus♂) were evaluated in terms of their survival, growth, feed intake and physiological responses after 30 days of exposure to different salinities (0 psu, 3 psu, 5 psu, 10 psu, 15 psu, 20 psu, 25 psu, 30 psu). Hybrid grouper all died at 0 psu salinity on the 4th day of exposure but all hybrid survived at a salinity of 5 psu or higher during the exposure period. Body length and weight increased above 5 psu salinity and the growth rate was the highest at 30 psu. Hybrid exposed to 3 psu did not eat the feed pellet. Feed intake did not show a significant difference between salinity 20 psu, 25 psu and 30 psu. Plasma osmolality of the juvenile hybrids exposed to different salinities was 341~368 mg Osmol/kg above 5 psu. The oxygen consumption rate was the highest at 30 psu with 163.6±22.3 mg O2/㎏ fish/h. SOD, CAT and GSH-PX were significantly higher at 15 psu. Therefore, the critical salinity for survive of the juvenile hybrid was 5 psu, and the proper salinity for optimal culture was analyzed with 20∼30 psu.
Keywords: 왕자바리의 대량생산을 위한 적정 염분을 구명하였다. 각 염분별 노출시킨 대왕자바리의 생존율은 0 psu에서 노출 4일째 모두 폐사하였으며 염분 5 psu 이상에서 생존율은 100%였다. 성장률은 염분 5 psu 이상에서 염분 상승에 따라 체중과 체장은 모두 증가하였으며 염분 30 psu (대조구)에서 성장률은 가장 높았다. 먹이섭취량은 염분이 하강함에 따라 감소하는 경향을 보였다. 염분 3 psu에서 먹이섭취는 없었으며 염분 20 25 및 30 psu 간에 유의한 차이는 없었다. 염분별 혈액 삼투질농도는 염분 5~30 psu에서 341~368 mg Osmol/㎏였다. 염분변화에 따른 산소소비율은 30 psu(대조구)에서 163.6±22.3 mg O2/㎏ fish/h으로 유의하게 높았다. 염분변화에 따른 SOD CAT 및 GSH-PX는 염분 15 psu에서 가장 높았다. 따라서 대왕자바리 생존 최저 임계염분은 5 psu이며 양성을 위한 적정 염분은 20~30 psu으로 추정된다. The prof
Correspondence to: Yun Kyung Shin; Aquaculture Industry Research Division, South Sea Fisheries Research Institute, National Institute of Fisheries Science, Yeosu 59780, Korea; E-mail: yunkshin@korea.kr
- Received
- 20 May 2022;
- Revised
- 23 May 2022;
- Accepted
- 3 June 2022.
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Language: Korean/English,
Full Text:

서 론
국내 해상가두리 어류양식은 주로 연안에 위치하여 소규모로 운영되고 있다. 최근 고수온, 저수온 등 해양환경의 변화에 의해 양식어류의 양성 중에 질병, 집단폐사 등의 문제가 많이 발생하고 있으며, 이로 인해 연간생산량도 불안정하다. 국내 주요 양식어종인 넙치의 생산량은 2018년에 37,241톤, 2020년 43,813톤, 2021년에 41,791톤으로 불안정하고, 조피볼락은 2018년에 22,702톤, 2020년에 21,568톤 그리고 2021년에 17,473톤(KOSIS, 2022)으로 계속 감소하고 있다. 이러한 생산량 감소요인 중 하나는 고수온기에 발생하는 이상해황에 의한 대량폐사에 기인한다. 이상해황에 의한 국내 양식어류의 폐사는 양식산업의 주요 현안으로 고수온기에 폐사를 줄이고 생산량을 증대시켜 어업소득을 향상시킬 수 있는 대체 양식어종의 개발이 필요한 실정이다.
아열대와 열대지역에 분포하고 있는 바리과 어류는 약 150여종 이상으로 이 가운데 일부 바리과 어류는 동남아시아 지역에서 양식어종으로 각광받고 있으며(Chen et al., 2018), 국내 서식하는 바리류는 다금바리(자바리). 붉바리, 능성어 등 27종으로 알려져 있다(Park et al., 2020). 최근 바리과 어류의 양식은 동남아시아 지역에서 급속도로 성장하고 있으나, 해상가두리 고밀도양식으로 인해 이리도바이러스(iridovirus), NNV (nervous necrosis virus), 기생충 등 질병에 의해 폐사가 발생(Chen et al., 2018)하고 있어 질병제어 및 건강한 바리류 양성관리를 위해 적절한 사육환경 유지가 필요하다.
염분과 수온은 해양 경골어류의 서식에 미치는 가장 중요한 환경요인이다. 일반적으로 해양 경골어류는 염분 7.0~58.5 psu의 넓은 범위에도 견뎌낼 수 있는 광염성이며, 바리과 어류 치어는 염분 11~41 psu, 수온 21~35℃에서 생존한다(Huang, 1999). 염분변화는 어류의 대사에 직접적으로 영향을 미칠 수 있다(Boeuf and Payan, 2001; Nordlie, 2009). 염분변화에 노출되었을 때, 이온조성과 삼투질농도를 일정하게 유지할 수 있으며, 이온과 삼투조절이 일어나는 동안 에너지가 소모된다(Lisboa et al., 2015; Nordlie, 2009). 어류가 삼투조절에 사용되는 에너지는 10~50% 이상으로(Boeuf and Payan, 2001), 삼투조절에 의해 소비되는 에너지는 어류의 체액과 서식지의 염분간에 삼투질농도차에 비례하므로(Handeland et al., 1998), 어류의 혈장 삼투질농도와 유사한 염분의 해수에서 사육할 경우 삼투조정에 필요한 에너지가 적어진다(Febry and Lutz, 1987; Woo and Kelly, 1995). 그러므로 어류를 양식할 경우 삼투적 균형유지는 생존, 성장 및 건강도 등 양성관리를 위해 매우 필요하다.
대왕자바리는 자바리(Epinephleus bruneus♀)와 대왕바리(Epine- phleus lanceolatus♂)의 교배종이며, 여름철 고수온기에 집중양성하여 어가 소득원이 가능한 고수온기 대체양식 어종으로 현재 연구 개발 및 양식기술 보급 중에 있다. 현재까지 국내 개발된 교잡바리는 대왕자바리외 대왕붉바리(붉바리 Epinephleus akaara♀ × 대왕바리 Epinephleus lanceolatus♂), 대왕범바리(범바리 Epine- phleus fuscoguttatus♀ × 대왕바리 Epinephleus lanceolatus♂)가 있다. 국내 교잡바리에 관한 연구는 수정란의 난발생과 부화력(Kang et al., 2020; Noh, 2020), 교잡종 형태비교(Park et al., 2020), 분자생물학적 판별(Kim et al., 2020) 및 염분의 영향(Lee et al., 2020; Shin et al., 2021) 등으로 주로 인공종자생산과 관련된 단편적 연구들이며, 양식기술 보급을 위한 연구가 미흡한 실정이다.
따라서 본 연구는 교잡종인 대왕자바리의 대량생산을 위한 양성기술로서 적정 염분범위를 규명하기 위해 염분변화에 따른 대왕자바리의 생존율, 성장, 대사율 및 스트레스 반응을 수행하였다.
재료 및 방법
실험에 사용된 대왕자바리(자바리 Epinephleus bruneus♀ × 대왕바리 Epinephleus lanceolatus♂)는 2020년 8월에 순천향대학교 해양수산연구소에서 생산한 종자를 구입하여 2020년 12월 중에 남해수산연구소 생물사육실로 옮긴 후 3톤 유수식 수조에서 수온 26±1℃, 염분 30.0±0.5 psu(일반해수), 용존산소농도 8.5±1.0 mg/l를 유지하며 순치하였다. 순치기간 동안 먹이는 배합사료(Nova floating ∅3~4 mm, Alleraqua, Denmark)를 어체중의 1%씩 매일 수시로 공급하였다.
실험 염분은 0(지하수), 3, 5, 10, 15, 20, 25±0.5 psu 및 일반해수(대조구, 30±0.5 psu)였으며, 수온은 26±1℃를 유지하였고 실험기간은 30일이었다.
실험방법은 각 염분별로 450 ℓ 수조에서 실험어 50마리씩 수용하여 30일 동안 생존율, 성장 및 생리학적 반응을 조사하였다. 실험 수온은 아쿠아트론(You won engineering Co., Korea)을 이용하여 유지하였으며, 염분은 지하수와 해수를 혼합하여 실험 염분을 맞추면서 유수식으로 수행하였다. 실험에 사용된 개체의 크기는 평균 체장 27.0±0.43 cm, 평균 체중 342.8±17.2 g이었다. 생존율은 오전 9시, 오후 5시에 규칙적으로 점검하였으며, 사망개체를 선별하여 생존율로 환산하여 구하였다. 사망개체는 실험어류가 뒤집혀서 아가미 뚜껑의 운동이 정지되었을 때 사망으로 판정하였다. 모든 실험은 같은 방법으로 2회 반복하여 평균값을 이용하였다.
실험어의 성장률은 각 실험구별 생존한 개체를 대상으로 체장과 체중을 측정하여 아래와 같은 공식에 따라 구하였다. 체장은 digital vernier calipers를 사용하여 0.1 mm 단위로 계측하였고, 체중은 전자저울을 사용하여 0.01 g까지 측정하였다.
체장성장률(Growth rate for total length, %):
[실험종료 시 전장-실험개시 시 전장]/[실험개시 시 전장]×100
체중성장률(Growth rate for body weight, %):
[실험종료 시 체중-실험개시 시 체중]/[실험개시 시 체중]×100
염분변화에 따른 생리학적 반응은 각 실험 염분에 노출시킨 후 30일째 살아있는 개체를 대상으로 혈액 내 삼투질농도, 산소소비율 반응, 간의 조직 내 SOD, CAT, 코티졸, GSH-PX의 변화를 분석하였다. 혈액 내 삼투질농도는 삼투압측정기(OSMOMET 030, Gonotec, Berlin, Germany)를 이용하였으며, 산소소비율은 respir- ometer와 산소호흡측정기(Orbis 3600, Orbis, Zurich, Switzerland)를 이용하여 실험 전후 Respirometer 내 용존산소의 차로서 구하였다. 간의 조직 내 SOD, CAT, 코티졸, GSH-PX 반응을 분석하기 위하여 조직을 분쇄하여 10,000 rpm으로 원심분리한 후 세포상층액을 추출하여 -80℃에 보관하고 분석 시에 사용하였다. SOD, CAT, Cortisol은 어류 ELISA kit (Cusabio Biotech, China)를 사용하였으며, Versamax SoftMax pro 6 (Morecular Devices, USA)를 이용하여 SOD (superoxide dismutase)와 Cortisol은 파장 450 nm, CAT (catalase)는 파장 520 nm 분석하였다. 조직 내 GSH-PX 변화 분석은 Cold PBS containing 1 mM EDTA에서 조직을 분쇄하여 15분간 4℃에서 10,000 rpm으로 원심분리하여 Kinetic Method를 이용하여 5분 간격으로 30분간 405~414 nm 파장으로 분석하였다. 실험결과에 사용된 유의성 검정은 SPSS 19.0을 이용하여 one-way ANOVA로 통계처리 후 Duncan's multiple range test로 사후 검증하였다.
결 과
1. 염분변화에 따른 생존, 성장 및 먹이섭취 반응
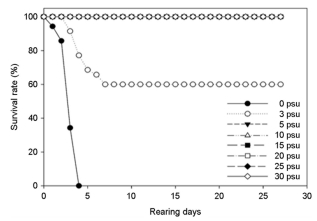
대왕자바리의 적정양성을 위한 염분범위를 조사하기 위해 염분 0, 3, 5, 10, 15, 20, 25, 30±0.5 psu(일반해수)에서 30일 동안 노출시키면서 생존율, 성장 및 사료섭취율을 조사하였다. 생존율은 0 psu에서 노출 4일째 모두 폐사하였으며, 3 psu에서는 노출 3일째 생존율 91.4%, 노출 7일째부터 실험종료일까지 60%로 유지되었다. 염분 5 psu 이상의 염분에서는 생존율 100%를 나타내었다(Fig. 1).
각 실험 염분에 노출시킨 대왕자바리의 체장과 체중은 염분상승에 따라 증가하는 경향을 보였다(Fig. 2, Table 1). 염분 3 psu에서 체장은 26.8±1.8 cm에서 27.5±1.6 cm으로 증가하였으나 체중은 334.6±71.4 g에서 332.0±63.9 g으로 감소하였다.
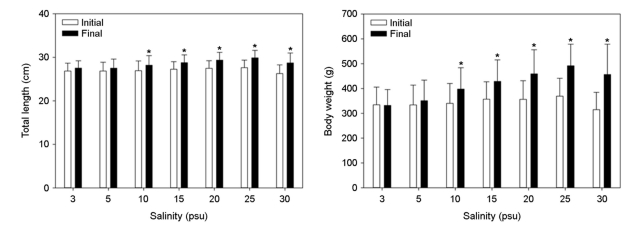
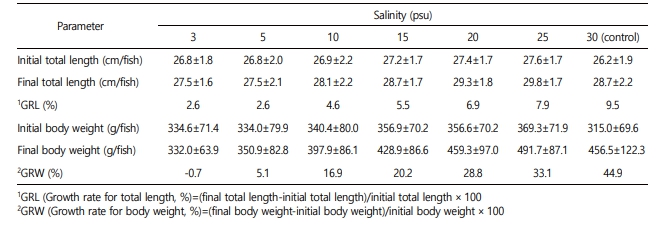
체중은 염분 10 psu 이상의 염분에서 염분상승에 따라 유의하게 증가하였으며(p<0.05), 염분 30 psu에서 체중 315.0±69.6 g에서 456.5±122.3 g으로 초기 체중대비 44.9%으로 가장 높은 성장률을 보였다.
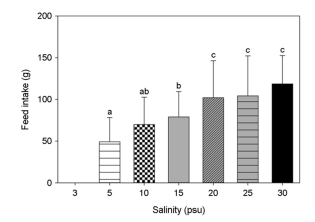
대왕 자바리의 먹이섭취량은 염분이 하강함에 따라 감소하는 경향을 보였다(Fig. 3). 염분 3 psu와 0 psu에 노출시킨 경우 대왕자바리의 먹이섭취는 없었으며, 염분 5 psu부터 사료를 먹기 시작하였으나, 일일 평균섭취량은 49.2±29.04 g/ind./day이었으며 가장 낮았다. 반면 먹이섭취량이 가장 많은 시험구는 염분 30 psu(대조구)에서 118.7±33.89 g/ind./day였으며 5 psu 시험구에 비해 141.2% 높았다. 평균 일일 먹이섭취량은 염분 20 psu 이상 노출 시험구에서 유의하게 증가하였다.
2. 염분변화에 따른 생리학적 반응
2.1. 삼투질농도 변화
대왕자바리의 혈액 삼투질농도는 5, 10, 15, 20, 25 및 30±0.5 psu에서 341~368 mOsmol/kg으로 유사하였다. 한편 3 psu에서는 230 mOsmol/kg으로 5 psu 이상에 노출된 대왕자바리의 삼투질농도에 비해 유의하게 낮았다(Fig. 4).
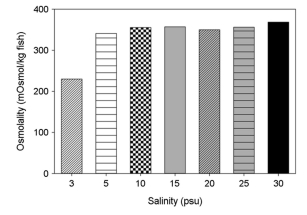
2.2. 염분별 산소소비율 변화와 스트레스 반응
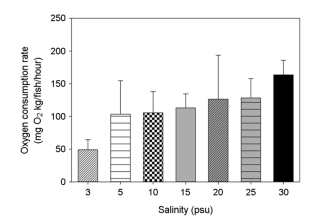
대왕자바리의 산소소비율은 대조구(30±0.5 psu)에서 163.6±22.31 mg O2/kg fish/h으로 다른 실험 염분구에 비해 유의하게 높았다(p>0.05). 반면 염분 3 psu에서 대왕자바리의 산소소비율은 가장 낮았으며, 염분 5~25 psu 실험구에서는 유사한 값을 나타내었다(Fig. 5).
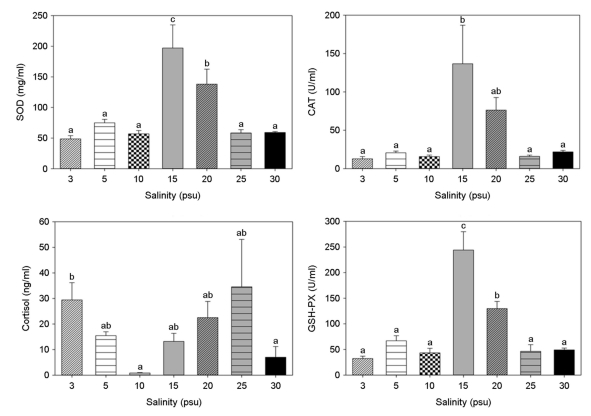
각 실험 염분에 30일 동안 노출시킨 후 생존한 개체를 대상으로 간에서 SOD, CAT, Cortisol 및 GSH-PX의 반응을 Fig. 6에 나타내었다. 염분 15 psu와 20 psu에서 SOD, CAT 및 GSH-PX가 유의하게 높게 반응하였으며(p>0.05), Cortisol은 염분 30 psu에서 유의하게 낮았고, 25 psu에서 높게 나타났다(p<0.05).
고 찰
전 세계 바리류(grouper)의 양식생산량은 2018년에 209,052M/T이며, 주로 중국, 대만 및 동남아시아 등에서 대부분을 차지(FAO, 2021)하고 있으며, 주로 아시아권 나라에서 양식되고 있는 경제적으로 주요한 어류이다(Rimmer and Glamuzina, 2019). 국내 교잡바리류는 2013년부터 정부에서 주도하는 GSP (Golden Seed Project) 사업이 시작되어 교잡바리류 종자가 개발(Noh, 2020)되었으나 국내 양식종으로 보급이 미흡한 실정이며, 적정양성을 위한 요소기술이 요구되고 있다.
바리류(Epinephelus spp)의 사육수온은 13~35℃, 평균적정양성수온은 26.32±0.62℃ (Das et al., 2021), 염분 10~33 psu에서 서식하는 광염성 어류(Chen et al., 2018)이다. 염분은 해양생물의 서식지를 결정하는 중요한 생태학적 환경요인(Kinne, 1966)으로, 염분변화에 따른 어류의 삼투조절 능력은 해양환경에서 어류의 생존과 성장을 예측할 수 있는 지표이다(Stewart et al., 2016).
교잡종, 대왕붉바리(Epinephleus akaara♀ × Epinephleus lanceo- latus♂)의 생존 가능한 염분한계는 3 psu 이상이었으며, 양성을 위한 적정 염분은 20 psu 이상 이었다(Shin et al., 2021). 본 연구에서 교잡종, 대왕자바리(Epinephleus bruneus♀ × Epinephleus lanceo- latus♂)는 염분 3 psu에서 체중이 감소하였으나, 염분 5 psu에서 30일 동안 모두 생존하였고 체장과 체중성장이 2.6~5.1% 증가하는 점으로 보아 생존이 가능한 최저 임계염분은 5 psu으로 분석되어 교잡종인 대왕붉바리의 임계염분이 3 psu와 다소 차이를 보였다. 한편 체장과 체중이 유의하게 증가하기 시작한 염분 10 psu은 대왕자바리의 양성을 위한 최저 염분 조건으로 분석된다.
대왕자바리의 성장과 생존이 가능한 염분 5~30 psu에서 혈장 삼투질농도는 341~368 mOsmol/kg으로 해산어류의 혈장 삼투질농도 300~400 mOsmol/kg (Ostrowski et al., 2011)와 유사하였다. 정상적인 범위를 벗어난 삼투질농도는 삼투적 스트레스의 지표(Devenport et al., 1981)이므로 3 psu에서 대왕자바리의 삼투질농도가 낮고, 성장 감소 등의 생리적 과정은 대왕자바리의 양성에 부적합한 염분이다
일반적으로 어류가 물리적인 스트레스에 노출되면 글루코스와 코티졸이 증가하므로 어류의 스트레스 지표로 글루코스와 코티졸이 많이 이용되고 있다(Davis and Parker, 1990). 또한 간의 효소활성은 스트레스의 크기, 오염원과 질병을 판단할 수 있는 생물지표이며, 어류의 건강상태를 나타낼 수 있다(Shin et al., 2021; Wagner and Congleton, 2004). 본 연구에서 대왕자바리의 간조직 내 스트레스 지표 SOD, CAT 및 GSH-PX는 염분 15 psu와 20 psu에서 다른 염분구에 비해 높았다. 반면 Cortisol은 염분 30 psu에서 높았다. 교잡종인 대왕붉바리의 간조직 내 코티졸은 염분 감소에 따라 유의하게 증가(Shin et al., 2021)하여 대왕자바리와 다소 차이를 보였다. 반면 대왕붉바리의 GSH, SOD와 CAT는 15 psu에서 급격히 증가(Shin et al., 2021)한 결과는 본 연구의 대왕자바리와 유사하였다. 이는 염분 감소에 따라 산화스트레스 반응이 종간 다양한 변화를 보이고 종에 대한 특이성(Mozanzadeh et al., 2021)을 가진다는 보고에 따라 교잡바리류간 염분변화에 대한 산화스트레스 반응이 다소 차이를 보인 것으로 추정된다.
산소소비율은 체내 항정성 조절과 연결되는 대사작용 및 에너지흐름과 관련되므로 어류의 대사율은 산소소비율 측정으로 추정할 수 있으며 이는 어류의 건강과 관련한다(Burton et al., 2011). 산소소비율은 교잡바리의 성장을 증가시키는 주요한 생리적 과정의 대사지표이며(Mazumder et al., 2019; Das et al., 2021), 성장에너지를 최대화시키는 환경적 요인을 분석할 수 있다(Brougher et al., 2005; Shi et al., 2011). 본 연구에서 대왕자바리의 먹이섭취량은 염분상승에 따라 증가하였으며, 염분 20 psu 이상 염분에서 유의하게 높았다. 한편 산소소비율은 염분 30 psu에서 유의하게 증가하였으며, 염분상승에 따른 대왕자바리의 산소소비율의 증가는 교잡바리(Epinephelus fuscoguttatus and E. lanceolatus)에서 높은 염분에서 산소소비율이 증가(Noor et al., 2019)하는 결과와 유사하였다.
어류는 성장을 위해 높은 단백질이 요구되며, 성장과 먹이섭취는 직접적인 관련이 있고, 종 특이성이 있다(Elvy et al., 2022). 대왕자바리의 먹이섭취량과 산소소비율 증가는 염분 20 psu 이상에서 유의하게 증가하였으나, 염분 30 psu에서 체중 및 체장 증가율이 현저히 높았고, 산소소비율과 성장간에 상관관계(Metcalfe et al., 2016)가 있다는 보고 등에 따라 30 psu에서 높은 대사율이 체내 단백질 합성 대사를 높여 성장을 촉진(Metcalfe et al., 2016) 시킨 결과로 추정된다.
따라서 바리류는 저수온, 고수온 및 저염분에 직면했을 때 질병감염에 대한 민감도가 증가(Chen et al., 2018)하므로, 교잡종인 대왕자바리의 염분에 따른 산소소비율 반응, 스트레스 지표 및 성장 등 생리학적 변화를 고려했을 때 생존 최저 임계염분은 5 psu, 양성을 위한 적정 염분범위는 20~30 psu으로 분석된다.
- References
-
1. Boeuf G, Payan P. 2001. How should salinity influence fish growth? Comp Biochem Physiol C 130: 411-423.
-
2. Brougher DS, Douglass LW, Soares JH. 2005. Comparative oxygen consumption and metabolism of striped bass Morone saxatilis and its hybrid M. chrysops♀ x M. saxatilis♂. J World Aquacult Soc 36: 521-529.
-
3. Burton T, Killen SS, Armstrong JD, Metcalfe NB. 2011. What causes intraspecific variation in resting metabolic rate and what are its ecological consequence?. Proc R Soc 278: 3465-3473.
-
4. Chen YY, Cheng AC, Cheng SA, Chen JC. 2018. Orange-spotted grouper Epinephelus coioides that have encountered low salinity stress have decreased cellular and humoral immune reactions and increased susceptibility to Vibrio alginolyticus. Fish Shellfish Immunol 80: 392-396.
-
5. Davis KB. Parker NC. 1990. Physiological stress in striped bass: effect of acclimation temperature. Aquaculture 91: 349-358.
-
6. Das SK, Xing TW, Noor NM, Mazumder SK, Goutham-Bharathi MP. 2021. Temperature physiology in grouper (Epinephelinae: Serranidae) aquaculture: A brief review. Aquaculture reports 20: 100682.
-
7. Davenport J, LØnning S, KjØrsvik E. 1981. Osmotic and structural changes during early development of eggs and larvae of the cod, Gadus morhua L. J Fish Biol 19: 317-331.
-
8. Elvy JE, Symonds JE, Hilton Z, Walker SP, Tremblay LA, Casanovas P. Herbert NA. 2022. The relationship of feed intake, growth, nutrient retention, and oxygen consumption to feed conver- sion ratio of farmed saltwater chinook salmon (Oncorhynchus tshawytscha). Aquaculture 554: 738184.
-
9. FAO (Food and Agriculture Organization). 2021. FAO Fisheries and Aquaculture Department, FIPS-Statistics and information. FAO, Rome, Italy.
-
10. Febry R, Lutz P. 1987. Energy partitioning fish: the activity related cost of osmoregulation in euryhaline cichlid. J Exp Biol 128: 63-85.
-
11. Handeland SO, Berge A, Bjornsson BT, Stefansson SO. 1998. Effect of temperature and salinity on osmoregulation and growth of Atlantic salmon (Salmo salar L) smolts in sea water. Aqua- culture 168: 289-302.
-
-
13. Kang MJ, Noh CH, Kim JH, Park JY. Park DW. 2020. The embryonic development and hatchability of two hybrids with giant grouper female: giant grouper♀ x kelp grouper♂ and giant grouper♀ × red-spotted grouper♂. Korean J Fish Aquat Sci 53: 557-562.
-
14. Kim YH, Park JY, Kim JH, Bang IC. 2020. Molecular Biological species indentification of imported groupers (Epinephleus♀× E. lanceolatus♂). Korean J Fish Aquat Sci 53: 566-571.
-
15. Kinne O. 1966. Physiological aspects of animal in estuaries with special reference to salinity. Neth J Sea Res 3: 222-244.
-
-
17. Lee IY, Park JY, Lim HK. 2020. Effect of low salinity on growth, survival and stress and response of juvenile hybrid grouper (Epinephleus fuscoguttatus × E. polyphekadion). Korean J Fish Aquat Sci 53: 499-505.
-
18. Lisboa V, Barcarolli IF, Sampaio LA, Bainchini A. 2015. Effect of salinity on survival, growth and biochemical parameters in juvenile Lebranche mullet Mugilliza (Perciformes: Mulilidae). Neotrop Ichthyol 13: 447-452.C
-
19. Mazumder SK, Ghaffar MA, Tomiyama T, Das SK. 2019. Effects of acclimation temperatures on the respiration physiology and thermal coefficient of Malabar blood snapper. Res Physiol Neurobiol 268: 103253.
-
20. Metcalfe NB, Leeuwen TEV, Killen SS. 2016. Does individual variation in metabolic phenotype predict fish behaviour and performance? J Fish Biol 88: 298-321.
-
21. Mozanzadeh MT, Safari O, Oosooli R, Mehrjooyan S, Najafabadi MZ, Hoseini SJ, Saghavi H, Modem J. 2021. The effect of salinity on growth performance, digestive and antioxident enzymes, humoral immunity and stress ondices in two eury- haline fish species: yellowfin seabream (Acanthopagrus latus) and asian seabass (Lates calcarifer). Aquaculture 534: 736329.
-
22. Noh CH. 2020. Hatchability of fertilized eggs from grouper (sub- family Epinephelinae) hybrids in Korea: A mini review for selection of commercially promising cross combinations. Korean J Fish Aquat Sci 53: 479-485.
-
23. Nordlie FG. 2009. Environmental influences on regulation of blood plasma/serum components in teleost fishes: a review. Rev Fish Biol Fish 19: 481-564.
-
24. Noor NM, Cob ZC, Ghaffar MA, Das SK. 2019. An evaluation of the effect of salinities on oxygen consumption and wellbing in the hybrid grouper Epinephelus fuscoguttatus and E. lanceolatus. Turkish J Fish Aquat Sci 19: 1017-1023.
-
25. Ostrowski AD, Watanabe WO, Montgomery FP, Rezek TC, Shafer TH, Morris JA. 2011. Effects of salinity and temperature on the growth, survival, whole body osmolality, and expression of Na+/K+ ATPase mRNA in red porgy (Pagrus pagrus) larvae. Aquaculture 314: 193-201.
-
26. Park JY, Kim YH, Bang IC. 2020. Comparision of morphological characteristics and its parent species hybrid grouper between a Epinephelus moara♀ and E. lanceolatus♂. Korean J Fish Aquat Sci 53: 572-576.
-
27. Rimmer MA, Glamuzina B. 2019. A review of grouper (family Serranidae: sunfamily Epinephelinae) aquaculture from a sustainability science perspective. Rev Aquacult 11: 58-87.
-
28. Shi Y, Zhang G, Liu J, Zang W. 2011. Effects of temperature and salinity on oxygen consumption to tawny puffer Takifugu flavidus juvenile. Aquacul Res 42: 301-307.
-
29. Shin YK, Choi YJ, Gil HW. 2021. Survival, growth and physiological response of the juvenile hybrid grouper (Epinephleus akaara♀ x E. lanceolatus♂) exposed to different water salinity levels. Korean J Fish Aquat Sci 54: 426-433.
-
30. Stewart HA, Noakes DLG, Cogliati KM, Peterson JT, Iversen MH, Scherck CB. 2016. Salinity effects on plasma ion levels, cortisol and osmolality in Chinook salmon following lethal sampling. Comp Biochem Physiol A 192: 38-43.C
-
31. Wagner T, Congleton JL. 2004. Blood chemistry correlates of nutritional condition, tissue damage and stress in migration juvenile chinook salmon (Oncorhynchus tshawitscha). Can J Fish Aquat Sci 61: 1066-1074.
-
32. Woo NYS, Kelly SP. 1995. Effects of salinity and nutritional status on growth and metabolism of Sparus sarbain a closed sea- water system. Aquaculture 135: 229-238.












