JMLS 2022 June;7(1):29-36. 10.23005/ksmls.2022.7.1.29 Epub 2022 June 17
Copyright © 2022 by The Korean Society of Marine Life Science
Heat Shock Protein 90 Gene Expression in Juvenile Sea Cucumber Apostichopus japonicus (Echinodermata; Holothuroidea) according to Releasing Methods
Dong-Han Lee; Department of Marine Bioscience, Gangneung-Wonju National University, Gangneung, Gangwon-do 25457, Korea
Seungheon Lee; Department of Marine Bioscience, Gangneung-Wonju National University, Gangneung, Gangwon-do 25457, Korea
Dong-Bin Jeong; Department of Information Statistics, Gangneung-Wonju National University, Gangwon-do 25457, Korea
Young Chang Sohn; Department of Marine Bioscience, Gangneung-Wonju National University, Gangneung, Gangwon-do 25457, Korea
- Abstract
돌기해삼 Apostichopus japonicus는 주요 양식 대상 무척추동물로서 우리나라 연안 해역에 서식하고 있다. 본 연구는 방류 방법에 따른 단기간의 생리학적 스트레스 정도를 평가하기 위하여 heat shock protein 90 (HSP90) 유전자의 발현 변화를 실시간 정량적 중합효소연쇄반응법으로 조사하였다. 어린 돌기해삼을 비닐봉지에 산소 포장하여 30분간 수송하거나 방류 해역의 간조기에 1시간 공기 중에 노출된 실험군의 HSP90 유전자 발현은 대조군의 HSP90 유전자 발현에 비하여 통계학적으로 유의미하게 증가하였다(수송 후 실험군 p=0.001; 간조기 실험군 p=0.032). 어린 돌기해삼을 방류 후 6시간까지 분석한 결과, 선상에서 씨뿌림 방식으로 방류된 6시간째의 개체 및 호스를 통과하여 수중으로 방류된 2~6시간째의 HSP90 유전자 발현율은 대조군에 비하여 약간 감소하는 경향을 보였다(씨뿌림 실험군 p=0.069; 호스 방류군 p=0.093). 한편, 잠수부에 의해 수중에서 방류된 어린 돌기해삼은 방류 후 시간이 경과할수록 HSP90 유전자 발현율은 증가하는 패턴이 관찰되었다(p=0.061). 이상의 결과는 방류된 어린 돌기해삼의 단기간 스트레스 반응 연구와 효과적인 방류 방법의 개발에 HSP90 유전자 발현이 유용하게 사용될 수 있음을 시사한다.
Sea cucumber, Aposticopus japonicus, is a major invertebrate species in the coastal regions of Korea. To evaluate the short-term stress levels according to the releasing methods, this study investigated the gene expression profiles of heat shock protein 90 (HSP90) by real-time quantitative polymerase chain reaction. When the juvenile sea cucumbers were packed in the vinyl bag with oxygen followed by transportation for 30 min or air-exposed for 1 h, the HSP90 gene expression levels in the experimental groups were significantly increased compared to those of the control groups (transported group, p=0.001; air-exposed group, p=0.032). The experimental group at 6 h post-release by seed-spreading method and at 2~6 h post-release by underwater hose-releasing method on board a fishing boat showed that the levels of HSP90 gene expression were not statistically significant but decreased slightly compared to the control group (seed-spreading group, p=0.069; hose-releasing group, p=0.093). On the other hand, the HSP90 gene expression showed an increasing pattern as the time passed (~6 h) after underwater release of juvenile sea cucumbers by divers (p=0.061). These results suggest that HSP90 gene expression can be used to investigate short-term stress response and effective releasing methods of juvenile sea cucumbers.
Keywords: Apostichopus japonicus(돌기해삼) Releasing methods(방류방법) RT-qPCR(실시간 정량적 중합효소연쇄반응)
Correspondence to: Young Chang Sohn; Department of Marine Bioscience, Gangneung-Wonju National University, Gangneung, Gangwon-do 25457, Korea; E-mail: ycsohn@gwnu.ac.kr
- Received
- 3 May 2022;
- Revised
- 3 May 2022;
- Accepted
- 26 May 2022.
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Language: Korean/English,
Full Text:

서 론
돌기해삼(Apostichopus japonicus)은 전세계적으로 약 1,250종을 포함하는 해삼강(Holothuroidea)의 순수목(Aspidochirotida), 돌기해삼과(Stichopodidae), 돌기해삼속(Apostichopus)에 속하는 극피동물이며, 아시아 지역에서 특히 경제적인 가치가 매우 높다(Kanno and Kijima, 2002; Jo et al., 2017). 우리나라 해삼 양식 기술이 발달하지 않은 과거에는 주로 잠수기 어업으로 자연산 해삼을 채취하여 왔다. 돌기해삼 생산량은 1983년에 3,966톤을 정점으로 1990년에는 2,491톤으로 감소하였고, 지속적인 연안 어장의 오염 및 해안 매립 등의 영향으로 서식장이 축소되어 2002년 833톤으로 급감하게 되었다(Statistics Korea (2020). 2003년 이후, 인공 종자 생산 및 방류 사업에 의하여 다소 생산량이 회복하여 2004년 1,154톤, 2009년 2,789톤, 2014년 2,139톤으로 생산량이 증가하여 안정적인 수준을 유지하게 되었지만, 1990년대 이전의 생산량을 회복하고 있지는 못한 실정이다(Statistics Korea, 2020). 각 지자체 및 민간 양식장에서 생산된 돌기해삼 종자는 씨뿌림 양식용으로 사용되고 있지만, 대규모 양식 생산고를 기대할 수 있는 기반 시설과 과학적인 양식 방법은 확립되어 있지 않다(Kang, 2012). 또한, 돌기해삼은 양식 기술력의 부족과 더불어, 해삼류의 독특한 생물학적 특성 및 생활사에 대한 해명이 부족한 점, 해양 환경의 급격한 변동 등 다양한 원인으로 인하여(Kim et al., 2015), 다른 저서성 연체동물과 달리 높은 경제적인 가치에도 불구하고 안정적인 대규모 양식 산업화가 어려운 품종으로 인식되고 있다. 그러나, 방류용 해삼 종자의 크기, 방류 시기 및 장소 등을 효과적으로 선정하고, 방류 후 생존율 및 재포율 향상, 종자 가격의 원가를 절감시킬 수 있다면, 해삼 종자 방류 사업의 경제적 효과는 크게 증대될 수 있을 것으로 전망된다(Park et al., 2013).
돌기해삼은 노지 양식장에서 바닥양성 방법에 의한 생산이 대부분이며, 육상순환시스템 및 천해 채롱 양식에 의한 성장율은 매우 낮다(Jeong et al., 2016). 또한, 사육 수조 내 은신처(shelter)와 모래 등 사육 환경과 기질은 어린 돌기해삼의 성장에 영향을 미친다는 연구 결과도 있다(Seo et al., 2009). 국내 돌기해삼 생산의 주된 방식은 돌기해삼의 종자를 생산한 다음, 수온이 상승하는 시기를 선택하여 노지 양식장에 방류하고 일정 기간 이후에 다시 포획하는 방법이지만(Lee et al., 2018), 어린 돌기해삼의 방류 방법에 따른 스트레스 반응에 관한 연구 및 해삼 자원량의 증가를 위한 최적의 방류 방법에 관한 연구는 매우 부족한 실정이다. 운송 시 나타나는 다양한 스트레스는 다양한 해양 무척추동물의 생존율 감소의 주요 요인이 될 수 있으므로(Heasman et al., 2003; Purcell, 2004), 방류 방법에 따른 생리학적 스트레스 지표에 관한 연구가 요구되고 있는 실정이다. 한편, 수온과 관련된 생태학적 연구 결과로서, 어린 돌기해삼의 최적 성장 수온은 16~18℃이며(Dong et al., 2006), 수온이 낮은 겨울철에는 동면을 하고, 수온이 26℃ 이상 상승하는 여름철에는 활성산소의 생산량을 감소시켜 대사활동의 최소화, 성장율 감소, 소화관 퇴화 등을 유도하고 하면(aestivation)이라는 특이한 생리학적 활동 저하 현상이 알려져 있다(Ji et al., 2008; Sun et al., 2011).
본 연구는 국내에서 일반적으로 시행되고 있는 몇 가지 방류 방법 중에서 분자생리학적으로 스트레스를 완화시킬 수 있는 돌기해삼 방류 방법을 검토하기 위하여, 단기간 방류 후 열충격단백질90(heat shock protein 90, HSP90) 유전자 발현율을 비교하였다. HSP90은 포유동물의 세포 활동에 영향을 미칠 뿐만 아니라 효모부터 무척추동물까지 폭넓은 동물계에서 다양한 아형(isoform)이 세포질에 존재하며, 세포 수준의 스트레스 및 항상성 조절에 매우 중요한 단백질로 알려져 있다(Haslbeck et al., 2012; Schopf et al., 2017). 돌기해삼의 스트레스 반응 지표로 사용된 HSP90 유전자 발현은 수온 및 염분 변화 후 6시간째에 현저히 증가되었다(Wang et al., 2013; Kim et al., 2015). 또한, 연체동물 바지락(Ruditapes philippinarum) 및 북방전복(Haliotis discus hannai)을 이용한 유사 스트레스 반응 연구에서도 HSP90 유전자가 사용되었다(Choi et al., 2018; Sukhan and Kho, 2020). 따라서, 본 연구에서는 해삼 종자를 방류 후 생존율의 향상과 체내 스트레스 정도를 완화시킬 수 있는 방류 방법을 파악하기 위하여, 환경 스트레스 및 대사에 관여하는 유전자인 HSP90를 이용하여 생체 지표 유전자로서의 활용 가능성 및 스트레스 정도를 간접적으로 평가하고자 하였다.
재료 및 방법
1. 실험동물
본 연구에 이용한 어린 돌기해삼(A. japonicus)은 전라남도 완도군 완도읍 소재 한국수산자원공단 남해생명자원센터에서 인공 종자 생산 방법으로 생산한 개체이며, 총 1,300마리(길이 1~3 cm; 중량 0.45~2.2 g)를 사용하였다(Fig. 1).

2. 방류 방법 및 샘플링
남해생명자원센터에서 14℃의 수온에서 수용중인 어린 돌기해삼을 2020년 6월26일 대조군(100개체), 비닐봉지로 산소 포장하여 수송 전 및 30분이 경과한 수송 후 실험군(각 100개체), 시험 방류 해역의 간조기에 1시간 공기 중에 노출된 노출군(100개체)를 샘플링하였다. 일반적인 해삼의 방류 방법인 선상 씨뿌림 방식으로 전라남도 완도군 신지면 신상길 276 인근 해역에 간조 시 드러난 암반 사이에 방류되어 2시간, 4시간 및 6시간 경과 후 재포된 선상 방류 실험군(시간 별 각 100개체), 시험 해역의 수중에서 잠수사에 의해 방류되어 2시간, 4시간 및 6시간 경과 후 재포된 수중 방류 실험군(시간 별 각 100개체), 선상에서 5 m 길이의 호스를 통하여 방류되어 2시간, 4시간 및 6시간 경과 후 재포된 호스 방류 실험군(시간 별 각 100개체)를 실험에 사용 하였다(Fig. 2). 어린 돌기해삼은 2 ml 튜브에 5마리씩(n = 20 / 13그룹) 무작위적으로 투입한 직후, 액화질소를 이용하여 급속 동결하고, 드라이아이스를 이용하여 실험실로 수송한 후, -80℃에서 total RNA 추출 전까지 보관하였다.

돌기해삼의 HSP90 및 beta-actin cDNA의 염기서열은 National Center for Biotechnology Information (NCBI)로부터 확보하였다(GenBank accession numbers: HQ689677.1, JF907619.1, AB510191.1). 이를 기반으로 PCR 기반의 cDNA cloning에 필요한 primer를 주문 제작하였다(Table 1; Bioneer Co., Daejeon, Korea). 어린 돌기해삼의 내장 및 호흡수로부터 RNeasy Mini kit (Qiagen, Valencia, CA, USA)를 이용하여 total RNA를 추출하였고, PrimeScript RT reagent kit (Takara, Osaka, Japan)를 이용하여 first-strand cDNA를 합성하였다. 합성된 first-strand cDNA, primers, Vent polymerase 및 buffer (NEW ENGLAND BioLabs, Ipswich, MA, USA)를 이용하여 pre-denaturing 95℃ 30초, annealing 52℃ 30초, extension 72℃ 70초(HSP90) 또는 40초(beta-actin) 총 35 cycle의 조건으로 PCR을 수행하였다. PCR 산물을 증폭하고 RNeasy Mini kit (Qiagen)를 이용하여 정제한 후, cDNA의 5' 및 3' 양방향 염기서열을 Sanger 분석법으로 결정하였다(Solgent Co., Daejeon, Korea). 분석한 HSP90 및 beta-actin cDNA 염기서열은 중국 Qingdao 시 Laoshan 연안에서 샘플링한 돌기해삼의 게놈(Zhang et al., 2017)의 염기서열과 비교 분석하였다.
4. Total RNA 추출
PureLinkTM RNA Mini kit (Thermo Fisher Scientific; Waltham, MA, USA)를 사용하였고, 제조사의 방법에 따라 total RNA를 추출하였다. 간략히 설명하면, 동결된 어린 돌기해삼 30 mg을 2 ml 튜브에 2-mercaptoethanol 포함된 lysis buffer 600 μl 용액을 첨가하고, 얼음 통 안에 넣어 차게 해 놓은 튜브 내 조직을 homogenizer로 완전히 파쇄한 후, 상온에서 원심분리 (2,600 × g, 5분)하고, 1 volume의 70% ethanol 처리하고 교반시켰다. Spin Cartridge에 파쇄된 조직 700 μl씩 넣고 상온에서 원심분리, 세척 과정을 거쳐 최종적으로 RNase-free H2O 70 μl로 RNA를 용출하였다. Nano Drop 2000 (Thermo Fisher Scientific)을 이용하여 RNA 농도 및 순도를 측정했다.
5. 실시간 정량적 중합효소연쇄반응(real-time quan- titative polymerase chain reaction; RT-qPCR)
RT-qPCR 검사에 사용한 probe 및 primer는 primer design tool (Integrated DNA Technologies, Inc., Coralville, Iowa, USA)을 이용하여 설계하였고, Thermo Fisher Scientific에 의뢰하여 제작하였다(Table 1). 국내산 돌기해삼의 cDNA 염기서열에 기초하여, 중국산 돌기해삼 게놈의 exon-intron 영역을 고려하여 HSP90 및 beta-actin mRNA 유래의 cDNA가 특이적으로 증폭되도록 설계하였다. 제조사의 권장된 방법에 따라서 추출한 total RNA (50 ng), TaqMan Fast Virus 1-Step Master Mix, TaqMan probes (Thermo Fisher Scientific)를 사용하였으며, 최종 PCR mixture는 20 μl로 one-step RT-qPCR 조건으로 QuantStudioTM 7 Flex (Applied Bio- systems, Foster City, CA, USA)을 사용하여 95℃ 30초; 95℃ 5초, 60℃ 34초, 40 cycle 수행했다.
6. 통계학적 분석
수송 전 · 후 및 간조기 노출 실험군의 유의성 검정은 Student's t-test로 비교하였으며, 검정 전 모든 집단에 대한 데이터의 정규성은 만족하였으며(Kolmogorov-Smirnov test, Shapiro-Wilk test, p>0.05), 데이터의 자연 로그 변환을 통해 분산을 동일하게 하였다(Levene test, p=0.791). 다중 검정의 유의성은 검정 전에 데이터의 자연 로그 변환을 수행한 후 정규성 검정(Kolmogorov-Smirnov test, Shapiro-Wilk test)과 분산의 동질성 검정(Levene test)을 실시하고, 일원분산분석(one-way ANOVA)을 수행하여 평균값 차이를 검정하였다. 데이터의 정규성과 분산의 동질성이 만족하지 않는 경우, 일원분산분석 대신 비모수적 검정법 중 Jonckheere-Terpstra 검정법을 사용하여 유의성 검정을 실행하였다. 모든 통계학적 분석은 통계패키지 IBM SPSS Statistics version 25 (SPSS Inc., USA)를 이용하였다.
결 과
1. HSP90 및 beta-actin 염기서열 비교
HSP90 및 beta-actin cDNA의 염기서열은 5'primer과 3'primer 서열을 포함하여 각각 1,096 bp 및 627 bp이었으며(Fig. 3A, B), NCBI에 등록된 기존의 돌기해삼 HSP90 및 beta-actin cDNA 염기서열과는 97~98%의 상동성을 나타내었다. 또한, 중국산 돌기해삼 게놈 시퀀스(Zhang et al., 2017)와 비교한 결과, HSP90 및 beta-actin cDNA는 각각 7개 및 2개의 exon 염기서열을 포함하는 transcripts로 판명되었다(Fig. 3A, B).

2. 방류 방법에 따른 돌기해삼 조직의 RT-qPCR 분석
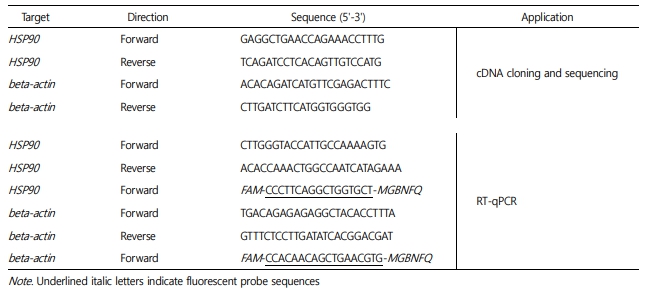
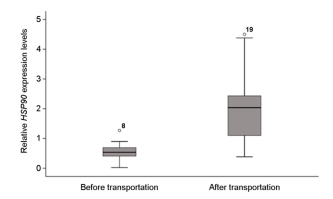
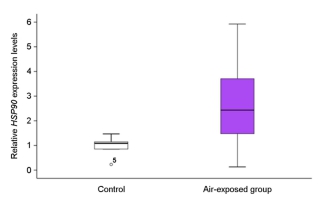
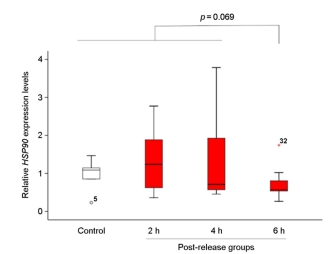
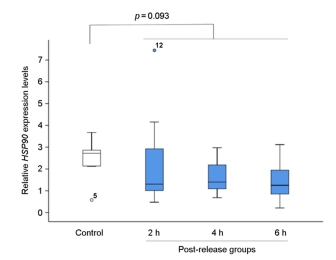
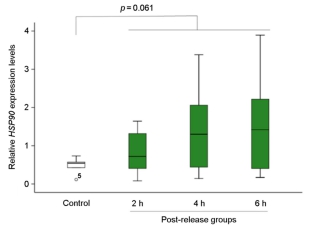
어린 돌기해삼을 비닐봉지에 수용하여 30분 경과한 수송 후 실험군과 수송 전의 대조군을 비교한 결과, 수송 후 실험군의 HSP90유전자 발현은 통계학적으로 유의미하게 증가하였다(p=0.001; Fig.4). 또한, 시험 방류 해역의 간조기에 1시간 공기 중 노출 실험군의 HSP90 유전자 발현도 증가하였다(p=0.032; Fig. 5). 한편, 선상에서 씨뿌림 방식으로 시험 해역에 방류된 어린 돌기해삼의 HSP90 유전자 발현율은 방류 6시간째에 다른 그룹에 비하여 감소하는 경향이 관찰되었다(p=0.069; Fig. 6). 이와 유사하게, 선상에서 호스를 통하여 방류되어 2~6시간 경과 후, 다시 포획된 호스 방류 실험군은 대조군의 HSP90 유전자 발현율에 비하여 약간 감소한 결과가 도출되었다(p=0.093; Fig. 7). 한편, 잠수사에 의해 수중에서 방류된 어린 돌기해삼은 방류 후 시간이 경과할수록 HSP90 유전자 발현율은 증가하는 패턴이 관찰되었다(p=0.061; Fig. 8).
고 찰
돌기해삼의 생산 증대를 위한 다양한 양식 기술 즉, 씨뿌림, 축제식 및 육상수조식 양식 방법의 개발이 활발히 이루어지고 있으며, 종자 방류 사업은 주로 어린 돌기해삼을 어촌계 공동 어장에 방류하고, 일정 기간 경과 후 어촌계는 성장한 돌기해삼을 재포하여 판매하고 있다(Park et al., 2013). 현재 연간 약 2,500톤 내외의 생산량을 기록하고 있는 해삼류의 생산량(Statistics Korea, 2020) 중에서 방류된 돌기해삼의 생물학적 조사가 불완전하여, 돌기해삼의 성장율 및 생존율은 물론, 돌기해삼의 대규모 양식 산업화 가능성과 경제적 파급효과가 정확하게 파악되고 있지 못한 실정이다. 외국에서는 어린 해삼의 방류 적지, 수송 방법, 적합한 방류 시각 및 계절에 관한 상세한 연구가 수행되어 왔으며, 방류된 해삼의 생존율과 성장율 향상에 크게 기여하고 있다(Purcell, 2004). 또한, 어린 해삼의 행동 조절 및 방류 전 적응에 관한 연구 중, 방류 후 최초 1시간에서 3일까지 천적을 회피할 수 있는 기질 탐색 능력 및 방류된 해저 서식처가 생존율을 향상시키는 매우 중요한 요소임이 알려져 있다(Dance et al., 2003; Juinio-Menez et al., 2012).
- References
-
1. Choi HC, Choi YS, Kang HS, Lee Y. 2018. Evaluation of health of tidal flat on the west coast using biomarker genes and Manila clam (Ruditapes philippinarum). J Mar Life Sci 3: 59-66.
-
2. Cui Y, Hou Z, Ren Y, Men X, Zheng B, Liu P, Xia B. 2020. Effects of aerial exposure on oxidative stress, antioxidant and non-specific immune responses of juvenile sea cucumber Apo- stichopus japonicus under low temperature. Fish Shellfish Immunol 101: 58-65.
-
3. Dance SK, Lane I, Bell JD. 2003. Variation in short-term survival of cultured sandfish (Holothuria scabra) released in mangrove-seagrass and coral reef flat habitats in Solomon Islands. Aquaculture 220: 496-505.
-
4. Dong Y, Dong S, Tian X, Wang F, Zhang M. 2006. Effects of diel temperature fluctuations on growth, oxygen consumption and proximate body composition in the sea cucumber Apostichopus japonicus Selenka. Aquaculture 255: 514-521.
-
5. Heasman M, Chick R, Savva N, Worthington D, Brand C, Gibson P, Diemar J. 2003. Enhancement of populations of abalone in NSW using hatchery-produced seed. Final Report, Australian Fisheries Research and Development Corporation Project 1998/219. New South Wales Fisheries, Cronulla, pp 64-163.
-
6. Haslbeck V, Kaiser CJ, Richter K. 2012. HSP90 in non-mammalian metazoan model systems. Biochim Biophys Acta 1823: 712-721.
-
7. Jeong UC, Han JC, Kang SJ. 2016. Sea cucumber Apostichopus japonicas growth in pond-bottom and lantern-net cultures. Korean J Fish Aquat Sci 49: 337-342.
-
8. Ji T, Dong Y, Dong S. 2008. Growth and physiological responses in the sea cucumber, Apostichopus japonicus Selenka: aesti- vation and temperature. Aquaculture 283: 180-187.
-
9. Jo J, Oh J, Lee HG, Hong HH, Lee SG, Cheon S, Kern EMA, Jin S, Cho SJ, Park JK, Park C. 2017. Draft genome of the sea cucumber Apostichopus japonicus and genetic polymor- phism among color variants. Gigascience 6: 1-6.
-
10. Juinio-Menez MA, de Peralta GM, Dumalan RJP, Edullantes CM, Catbagan TO. 2012. Ocean nursery systems for scaling up juvenile sandfish (Holothuria scabra) production: ensuring opportunities for small fishers. Hair CA, Pickering TD, Mills DJ (Eds.), Asia-Pacific tropical sea cucumber aquaculture. ACIAR Proceedings, 136. Australian Centre for International Agricultural Research, Canberra, pp 57-62.
-
11. Kang SJ. 2012. Stocking and transportation of sea cucumber. Kang SJ, Kang SW, Kang JH, Jeong UC, Jin SD, Choi BD, Han JC (eds.), Aquainfo Press, Seoul, pp 310-318.
-
12. Kanno M, Kijima A. 2002. Quantitative and qualitative evaluation on the color variation of the Japanese sea cucumber Stichopus japonicus. Suisanzoshoku 50: 63-69.
-
13. Kim CW, Jin YG, Kim TI, Jeong DS, Kang HS. 2015. The expression of HSP90 and ferritin genes under thermal stress in the sea cucumber (Apostichopus japonicas). Korean J Environ Biol 33: 433-440.
-
14. Lee JW, Gil HW, Lee DH, Kim JK, Hur JW. 2018. Variations of size and density of sea cucumber (Stichopus japonicus) released to the habitat conditions. Ocean Polar Res 40: 69-75.
-
15. Li C, Zhao W, Qin C, Yu G, Ma Z, Guo Y, Pan W, Fu Z, Huang X, Chen J. 2021. Comparative transcriptome analysis reveals changes in gene expression in sea cucumber (Holothuria leucospilota) in response to acute temperature stress. Comp Biochem Physiol Part D Genomics Proteomics 40: 100883.
-
16. Meng XL, Dong YW, Dong SL. 2015. Large-scale mortality and limited expression of heat shock proteins of aestivating sea cucumbers Apostichopus japonicus after acute salinity de- crease. Aquacul Res 46: 1573-1581.
-
17. Park KI, Kim YJ, Kim DH. 2013. Analyzing economic effectiveness of the sea cucumber seed releasing program in Gyeongsangbuk-do region. J Fish Bus Adm 44: 81-90.
-
18. Palmisano AN, Winton JR, Dickhoff WW. 2000. Tissue-specific induction of HSP90 mRNA and plasma cortisol response in Chinook salmon following heat shock, seawater challenge, and handling challenge. Mar Biotechnol 2: 329-338.
-
19. Purcell SW. 2004. Criteria for release strategies and evaluating the restocking of sea cucumbers. Lovatelli A, Conand C, Purcell SW, Uthicke S, Hamel JF, Mercier A (eds.), Advances in Sea Cucumber Aquaculture andManagement: FAO Fisheries Technical Paper 463. FAO, Rome, pp 181-191.
-
20. Sathiyaa R, Campbell T, Vijayan MM. 2001. Cortisol modulates HSP90 mRNA expression in primary cultures of trout hepato- cytes. Comp Biochem Physiol Part B Biochem Mol Biol 129: 679-685.
-
21. Schopf FH, Biebl MM, Buchner J. 2017. The HSP90 chaperone machinery. Nat Rev Mol Cell Biol 18: 345-360.
-
22. Seo JY, Kim DG, Kim GU, Cho SS, Park HG, Lee SM. 2009. Effect of different substrates in the rearing tank on growth and body composition of juvenile sea cucumber Apostichopus japonicas. J Aquacul 22: 118-121.
-
23. Statistics Korea. 2020. Fishery production survey. Korean Statistical Information Service (KOSIS). https://kosis.kr.
-
24. Sukhan ZP, Kho KH. 2020. Expression profile of heat shock protein gene transcripts (HSP70 and HSP90) in the nerve ganglia of Pacific abalone, Haliotis discus hannai exposed to thermal stress. J Mar Life Sci 5: 92-98.
-
25. Sun L, Chen M, Yang H, Wang T, Liu B, Shu C, Gardiner DM. 2011. Large scale gene expression profiling during intestine and body wall regeneration in the sea cucumber Apostichopus japonicus. Comp Biochem Physiol Part D Genomics Pro- teomics 6: 195-205.C
-
26. Wang Q, Yu S, Qin C, Dong S, Dong Y. 2013. Combined effects of acute thermal and hypo-osmotic stresses on osmolality and hsp70, HSP90 and sod expression in the sea cucumber Apostichopus japonicus Selenka. Aquacul Intl 22: 1149-1161.
-
27. Zhang X, Sun L, Yuan J, Sun Y, Gao Y, Zhang L, Li S, Dai H, Hamel JF, Liu C, Yu Y, Liu S, Lin W, Guo K, Jin S, Xu P, Storey KB, Huan P, Zhang T, Zhou Y, Zhang J, Lin C, Li X, Xing L, Huo D, Sun M, Wang L, Mercier A, Li F, Yang H, Xiang J. 2017. The sea cucumber genome provides insights into morphological evolution and visceral regeneration. PLoS Biol 15: e2003790.












