JMLS 2022 June;7(1):15-20. 10.23005/ksmls.2022.7.1.15 Epub 2022 June 17
Copyright © 2022 by The Korean Society of Marine Life Science
Anticancer Effect of Novel Peptide from Abalone (Haliotis discus hannai) based on Next Generation Sequencing Data
Hyunhye Moon; 3BIGS CO. LTD., Busan 49241, Korea
Jeon Hwang-bo; 3BIGS CO. LTD., Busan 49241, Korea
Karpagam Veerappan; 3BIGS CO. LTD., Busan 49241, Korea
Sathishkumar Natarajan; 3BIGS CO. LTD., Busan 49241, Korea
Hoyong Chung; 3BIGS CO. LTD., Busan 49241, Korea
Junhyung Park; 3BIGS CO. LTD., Busan 49241, Korea
- Abstract
본 연구는 우리나라 해안에서 널리 서식 중인 해양 자원 중 하나인 전복(Haliotis discus hannai)의 차세대염기서열분석 데이터 기반으로 선별한 신규 펩타이드의 항암 활성을 평가한 연구이다. 펩타이드의 항암 활성은 교모세포종 세포주인 SNU-489에서 농도 의존적으로 처리 시간에 비례하여 증가하였으며, 200 μM로 48시간 처리하였을 때 암 세포 사멸율이 67%로 가장 높게 나타났다. 반면 정상 세포인 HaCaT에서 가장 높은 세포 사멸율은 18%로 농도 의존적이었으나 처리 시간과는 무관하였다. 또한 신규 펩타이드의 항암 메커니즘 과정을 밝히기 위해 세포자멸괴사(Necroptosis) 관련 유전자의 발현 변화를 qRT-PCR 방법을 통해 검증하였다. RIPK3는 신규 펩타이드 처리군에서 200 μM 처리 시 9배 이상 발현 증가, MLKL는 100 μM 처리군에서 대조군 대비 2배 이상 유의미하게 발현이 증가되었다. 이러한 결과로 미루어 볼 때, 전복 유래 신규 펩타이드는 암 세포 특이적으로 세포 독성을 가지며, 세포자멸괴사 메커니즘을 통해 암 세포 사멸을 일으키는 것으로 추측되므로 신규 펩타이드가 추후 교모세포종 치료제의 후보물질로 활용될 수 있을 것으로 사료된다.
Glioblastoma is one of the highly aggressive central nervous system tumors and it is difficult to treat owing its anatomical location. Peptides are novel class of drugs which has the potential to cross the blood brain barrier and exerts its anti-tumor activity. Here, we discovered a novel peptide from abalone (Haliotis discus hannai) next generation sequencing (NGS) data and tested its anticancer effect on glioblastoma cell line SNU-489. The anticancer activity was measured using a cytotoxicity assay in a time and dose-dependent manner. A concentration and time dependent increase in the cytotoxicity was seen in cells treated with the novel peptide. The highest cytotoxicity rate of about 67% was observed in SNU-489 cells treated with 200 μM peptide for 48 hrs. However, the cytotoxic effect was not or less observed in a normal skin cell line HaCaT at similar concentration, thus, evident of peptide's cell specific anticancer activity. In addition, the gene expression level of necroptosis-related genes was analyzed by qRT-PCR to elucidate the anticancer mechanism of the novel peptide. RIPK3 expression was significantly increased by 9.6-fold in 200 μM of novel peptide treatment group, and MLKL expression level was significantly elevated by 2-fold in 100 μM treated group compared to the control group. Therefore, this study confirmed that the novel abalone-derived peptide has anticancer potency, and it causes cancer cell death through the necroptosis mechanism. Collectively, these results suggest that the novel peptide could be candidate anticancer agent for the treatment of glioblastoma in the future.
Keywords: Haliotis discus hannai(전복) Anticancer(항암) Peptide(펩타이드) Next generation sequencing(차세대염기서열분석) Glioblastoma(교모세포종)
Correspondence to: Junhyung Park; 3BIGS CO. LTD., Busan 49241, Korea; E-mail: jhpark@3bigs.com
- Received
- 10 May 2022;
- Revised
- 17 May 2022;
- Accepted
- 23 May 2022.
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Language: Korean/English,
Full Text:

서 론
전복(Haliotis discus hannai)은 우리나라 해안에서 많이 서식하는 수산생물로 여러 영양소가 풍부하여 건강식으로 애용되는 해양 자원이다. 나아가 전복을 여러 형태로 가공한 가공물 및 추출 성분을 이용하여 화장품, 건강식품 등의 기능성 자원으로 연구 및 활용되고 있다(Kim et al., 2006; Li et al., 2012; Lim, 2014; Ko et al., 2016; Lee et al., 2016). 전복 유래 펩타이드는 피부 질환 개선부터 항균, 항염, 항산화 활성(De Zoysa et al., 2009; Seo et al., 2016; Chen et al., 2019; Choi et al., 2020) 등 다양한 분야에 걸쳐 연구가 이루어지고 있으며, 특히 항암 분야에서는 위암 세포주(Kim et al., 2013)와 섬유육종 세포주(Gong et al., 2019)에서 생장 및 전이 억제 효과가 있음이 밝혀졌다. 하지만 항암 분야의 연구 성과는 다른 분야에 비해 더욱 부족한 실정으로, 다양한 암 종 및 항암 메커니즘에 대한 연구가 필요한 상황이다.
교모세포종(Glioblastoma)은 높은 치명도와 공격적인 특성을 가지는 악성 뇌종양으로 방사선과 화학적 요법에 저항성을 가지며, 뇌혈관 장벽(Blood-Brain Barrier)의 낮은 투과도로 인해 약물 전달력이 저하되어 치료에 어려움을 겪고 있다(Oberoi et al., 2016). 최근까지도 효과적인 항암제 개발이 이루어지지 않아 수술적 치료 방법에 의존하고 있으며, 국내에서는 치료제 연구 또한 비활성화 되어 있는 분야이다. 최근 연구를 살펴보면, 교모세포종을 포함하여 다양한 암 종에서 세포 사멸 과정 중 세포자멸괴사(Necro- ptosis)을 목적으로 하는 치료 전략이 대두되고 있다. 세포자멸괴사는 교모세포종의 종양 형성 및 악성 발달의 원인 중 하나인 세포자멸사 내성(Apoptosis resistance)을 극복하는 메커니즘으로 알려져 있다(Pagano et al., 2022). 세포자멸괴사 신호전달 과정에서 RIPK1, RIPK3, MLKL 등의 유전자가 매개 인자로 알려져 있으며, 교모세포종 세포주인 U118을 이용한 연구에서 후보 약물 처리 시, RIPK1과 RIPK3과 연관된 세포자멸괴사가 유발됨이 확인되었다(Melo-Lima et al., 2015). 이러한 연구에 기반하여, 본 연구에서는 세포자멸괴사 관련 유전자 발현 변화를 관찰하여 신규 펩타이드의 항암 메커니즘을 확인하고자 하였다.
4차 산업혁명 시대를 맞아 범람하는 정보와 데이터를 효율적이고 생산적으로 이용하기 위한 연구가 활발히 이루어지고 있다. 특히 의료 분야에서는 바이오 빅데이터가 의료 서비스 개선, 질병 진단 및 치료 그리고 신약 개발 분야에서 중요하게 활용되고 있다(Lee et al., 2020). 전통적 방식의 신약 개발은 10년 이상의 기간이 소요되나 성공률은 매우 낮은 고비용 산업이다. 또한 생물학과 화학 등 여러 학문의 통합 및 연계가 필요한 분야로 관련 빅데이터를 잘 활용하기만 한다면 신약 개발의 효율성을 매우 높일 수 있어 데이터 활용의 중요성이 대두되고 있다(Jung and Kwon, 2021). 이번 연구에 사용된 신규 펩타이드는 전복의 NGS 데이터 기반으로 선별되었으며, 기존 연구에서 전복 추출물 제조와 정제, 성분 분석 등의 과정이 생략되었기에 매우 경제적이고 효율적으로 개발되었다.
따라서, 이번 연구를 통해 높은 약물 저항성, 낮은 약물 투과성으로 치료제 개발에 어려움을 겪고 있는 교모세포종을 대상으로 전복의 NGS 데이터를 기반으로 추출된 신규 펩타이드의 항암 활성과 작용 메커니즘을 확인하고, 경제적인 항암 후보물질로 연구 가능성을 입증하고자 한다.
재료 및 방법
1. 전복 유래 신규 펩타이드의 선별 및 합성
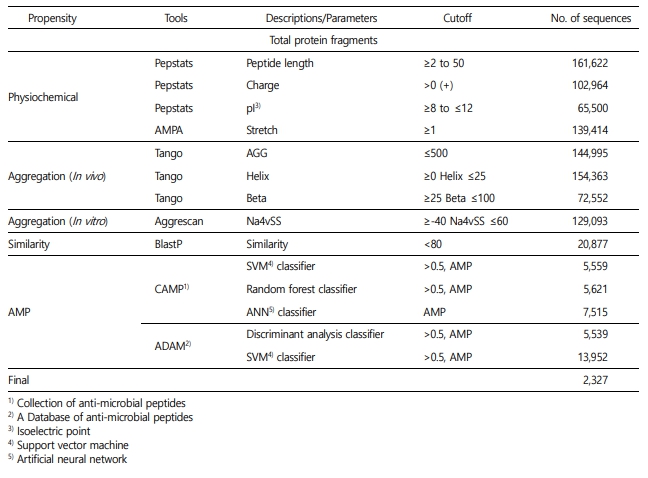
본 연구에서 사용한 전복 유래 신규 펩타이드(ACVRACVRAC- VRACV)는 선행 연구에서 확립된 펩타이드 선별 프로세스를 통해 선별되었고(Lee et al., 2021), 그 과정을 요약하여 Table 1에 나타내었다. 전복 유래 신규 펩타이드는 (주)루젠에스씨아이(Bucheon, Korea)에서 합성하여 본 연구에 사용하였다.
2. 세포 배양
항암 효과 검증에 사용된 교모세포종 세포주는 SNU-489로 한국세포주은행(KCLB, Korea)에서 분양 받아 사용하였다. SNU-489 세포 배양은 10% Fetal Bovine Serum (FBS, corning, USA)와 1% 페니실린-스트렙토마이신(Penicillin-streptomycin, Gibco, USA)이 포함된 RPMI1640 (Welgene, Korea) 배지에 배양하였다. 정상 세포주로 사람의 표피 세포인 HaCaT은 10% FBS와 1% 페니실린-스트렙토마이신을 첨가한 DMEM (Dulbecco's modified Eagle's medium, Welgene, Korea) 배지로 배양하였다. 모든 세포주는 37℃, 5% CO2 조건이 유지되는 배양기에서 배양하였고, 2~3일 간격으로 배지 교환 및 계대 배양을 실시하였다.
3. 세포 독성 평가
SNU-489와 HaCaT 세포주를 5×103 cell/well의 밀도로 96-well plate (SPL, Korea)에서 24시간 배양하고 배지를 제거한 뒤, serum-free medium에 펩타이드를 3.125~200 μM까지의 농도로 2배 연속 희석법으로 희석하였다. 이 용액을 100 μl씩 분주하고 24시간, 48시간 동안 각각 처리하였다. 이후 10 μl의 Ez-Cytox (Dogen, Korea)을 각 well에 첨가하고 3시간 동안 세포 배양기에서 배양하였다. Spectrophotometer를 이용하여 450 nm에서 흡광도를 측정하였으며, 세포 생존율은 대조군의 생존율 100%를 기준으로 펩타이드 처리군의 상대적인 세포 생존율을 백분율로 나타내었다.
4. RNA 추출 및 실시간 중합효소연쇄반응(Quan- titative real-time polymerase chain reaction, qRT-PCR)
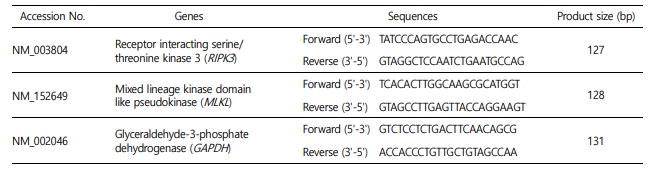
교모세포종에서 세포자멸괴사 신호전달 과정에 연관된 유전자 RIPK3와 MLKL의 발현 변화를 확인하기 위해 qRT-PCR을 수행하였다. 각 유전자의 프라이머는 오리진 테크놀로지(OriGene Tech- nologies Inc., USA)에서 qRT-PCR 방법으로 유전자 특이적 증폭이 확인된 서열 정보를 사용하였고 이를 Table 2에 나타내었다. RNA 추출을 위해, SNU-489 세포주를 5×105 cell/well의 밀도로 6-well plate (SPL, Korea)에서 배양하고, 24시간 동안 배양하였다. 배양 배지를 제거하고, 50, 100, 200 μM의 농도로 신규 펩타이드를 희석한 serum-free medium을 분주하여 추가로 24시간 배양하였다. 배양 후, 배지와 부착 세포를 모두 수거하여 원심분리 후 상층액을 제거하고 PBS로 세척하였다. 이렇게 얻어진 세포를 RiboExTM (Geneall, Korea)를 사용하여 용해하고 RNA를 추출한 뒤, Accu- Power® CycleScript RT PreMix (Bioneer, Korea)로 제조사 실험 지침에 따라 cDNA를 합성하였다. 유전자 증폭은 EzAmp fast qRT-PCR 2x master mix (ELPIS-BIOTECH, Korea)를 사용하여 AriaMx Real-Time PCR System (Agilent Technologies, Inc., USA)에서 이루어졌다. 95℃에서 3분간 heating 후 95℃에서 5초 간 denaturing, 60℃에서 10초 동안 annealing과 extension하는 과정을 40회 반복하여 qRT-PCR을 수행하였다. 이후 얻어진 Cq 값을 2-ΔΔCq 방법으로 분석하고 GAPDH로 상대 정량하였다. 또한, 95℃에서 30초, 65℃에서 30초, 95℃에서 30초 조건으로 melting curve를 분석하여 프라이머가 비특이적 증폭이 없는 것을 확인하였다.
5. 통계 처리
모든 실험은 3반복 진행하였으며, 측정한 결과는 평균 ± 표준편차(Mean ± SD) 값으로 표시하였다. Prism 7 (GraphPad, USA) 프로그램을 이용하여 통계 처리하였으며, 데이터 간의 유의성은 student t-test 방법으로 분석하였다. p<0.05 이하일 때 통계적으로 유의하다고 판단하였다.
결 과
1. 전복 유래 신규 펩타이드의 교모세포종에 대한 항암 활성 평가
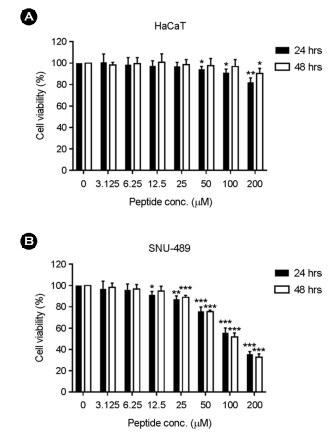
신규 펩타이드의 교모세포종 세포주에 대한 항암 활성과 정상 세포에 미치는 독성을 확인하기 위해 세포 독성 실험을 실시하였다. 3.125~200 μM의 농도로 펩타이드를 처리한 결과, HaCaT 세포주에서는 24시간 동안 신규 펩타이드를 처리했을 때, 50 μM 이상의 농도부터 유의미한 세포 독성을 보였으며(p<0.05), 24시간 동안 처리한 경우 48시간 처리군보다 세포 생존율이 더 크게 감소하는 경향이 관찰되었다(Fig. 1 (A)). 48시간 동안 200 μM로 펩타이드를 처리했을 때 24시간에 비해 1.1배 높은 세포 생존율을 보였다. 이러한 결과로 미루어 볼 때, 정상 세포인 HaCaT의 경우 펩타이드 농도 의존적으로 세포 독성은 있으나, 처리 시간에는 비례하지 않는 것으로 보인다. SNU-489에서 음성 대조군에 비해 각각 12.5 μM과 25 μM 이상의 농도로 처리했을 때 유의미한 세포 독성이 관찰되었다(Fig. 1 (B)). 또한 이러한 세포 독성은 농도 의존적인 경향을 보였다. 24시간 동안 100 μM과 200 μM 처리 시 각각 55%와 35%의 생존률을 보였고, 48시간 동안 처리한 경우 각각 51%와 32%의 생존률이 관찰되어 100 μM 이상 농도부터 처리 시간이 증가함에 따라 세포 독성도 증가하는 결과를 확인하였다. 하지만 HaCaT과 SNU-489에서 24시간과 48시간 처리군 사이에 유의미한 차이는 발견되지 않았다.
2. 전복 유래 신규 펩타이드가 RIPK3와 MLKL의 mRNA 발현에 미치는 영향
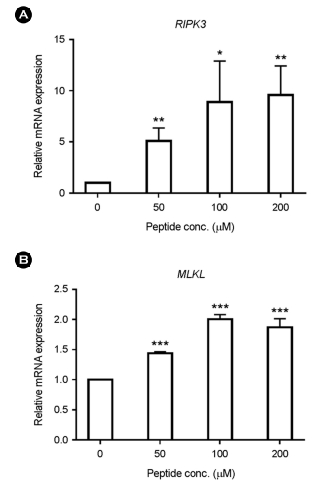
신규 펩타이드의 항암 메커니즘 과정을 밝히기 위해 세포자멸괴사와 관련된 주요 유전자의 발현 변화를 qRT-PCR 방법을 통해 확인하였다(Fig. 2). 신규 펩타이드는 농도 의존적이며 유의미한(p<0.001) 세포 사멸 효과가 확인된 50, 100, 200 μM의 농도로 24시간 동안 SNU-489에 처리하였다. 그 결과, RIPK3는 신규 펩타이드 200 μM 처리군에서 대조군에 비해 9배 이상 발현이 증가하였고 이러한 현상은 농도 의존적인 것으로 관찰되었다. 또한 MLKL은 100 μM 처리군에서 대조군 대비 유전자 발현이 2배 이상 증가되었고, 200 μM 농도로 펩타이드를 처리한 경우 1.87배 증가하여 농도 의존적인 영향력은 확인되지 않았다. 하지만 신규 펩타이드를 처리한 모든 그룹에서 유전자 발현 증가는 유의미한 것으로 분석되었다.
고 찰
본 연구에서는 전복(Haliotis discus hannai)의 NGS 데이터를 기반으로 기존 방식인 가공 및 추출물 제작, 정제 및 성분 분석 등의 과정을 생략하여 경제적이고 효율적인 방식으로 전복 유래 신규 펩타이드를 발굴하였다. 또한 높은 약물 저항성, 낮은 약물 투과성으로 치료제 개발에 어려움을 겪고 있는 교모세포종을 대상으로 신규 펩타이드의 항암 활성과 작용 메커니즘을 규명하고, 경제적인 항암 후보물질로 연구 가능성을 입증하고자 하였다.
선행 연구를 통해 감태, 해삼 등의 해양생물에서 발굴한 펩타이드는 교모세포종 세포주인 SNU-489에서 세포 사멸 효과가 유의미하지 않음을 확인하였다(data not shown). 반면, 본 연구의 전복 유래 신규 펩타이드는 200 μM로 48시간 처리 시 67%의 세포 사멸 효과가 관찰되었고, 같은 조건에서 정상 세포주인 HaCaT의 세포 사멸율이 9.6%인 것에 비하면 7배 이상 높은 비율로 암 세포주 선택적 세포 사멸 효과가 있음이 확인되었다.
1994년부터 2021년까지 248개의 교모세포종 세포주에 대해 교모세포종의 표준 치료제인 테모졸로마이드(Temozolomide)의 세포 사멸 실험이 수행된 것으로 보고되어 있다. 연구에 따르면, 가장 많이 사용된 세포주인 U87에 테모졸로마이드를 48시간 동안 처리했을 때 IC50은 223.1 μM이었으며, 환자 유래 세포주에서 72시간 처리 시 IC50 값은 220 μM인 것으로 확인되었다(Poon et al., 2021). 본 연구에서 전복 유래 신규 펩타이드를 위와 유사한 조건인 200 μM 농도로 48시간 처리했을 때의 결과와 비교하면 테모졸로마이드보다 세포 사멸 효과는 더 높은 것으로 보인다. 하지만 정확한 비교를 위해서는 SNU-489에 테모졸로마이드를 대조군으로 하여 신규 펩타이드의 효능을 비교하거나, 다른 교모세포종 세포주에서 신규 펩타이드의 세포 사멸 효과를 검증하는 연구를 추가로 수행할 필요가 있다.
신규 펩타이드의 항암 작용 메커니즘을 확인하기 위해 최근 교모세포종에서 세포자멸사 내성(Apoptosis resistance)의 대안으로 주목받는 세포자멸괴사(Necroptosis)에 관련된 인자(RIPK3, MLKL)의 mRNA 발현 변화를 살펴보았다. 그 결과, 이들 인자의 발현이 SNU-489에서 전복 유래 신규 펩타이드 처리 시 유의미하게 증가하는 것을 확인하였다. RIPK1, RIPK3, MLKL은 세포자멸괴사 경로의 주요 인자로 알려져 있으며, RIPK1과 RIPK3가 활성화되어 네크로좀(Necrosome)을 형성하고, 이어 MLKL을 인산화시키면 MLKL이 활성화되어 원형질막으로 이동 후 세포 괴사(Necroptotic cell death)를 유발한다(Pagano et al., 2022). 보다 정확한 항암 메커니즘을 밝히기 위해서는 신규 펩타이드가 이러한 주요 인자들의 단백질 수준의 발현 및 인산화 여부에 영향을 미치는지에 대한 추가 연구도 필요하다.
현재까지 교모세포종 치료제 개발이 어려운 이유 중 하나는 뇌혈관 장벽(Blood-Brain Barrier, BBB)에 대한 약물의 낮은 투과율 때문이다. 하지만 동물 실험 모델에서 독소루비신(Doxorubicin)과 파클리탁셀(Paclitaxel)에 짧은 서열의 펩타이드들을 결합하여 뇌혈관 장벽 투과율을 향상시킨 사례들로 볼 때(Oberoi et al., 2016), 전복 유래 신규 펩타이드의 변형(Modification) 및 뇌혈관 표적 펩타이드 또는 세포 투과 기능을 가지는 펩타이드 등의 결합(Conjugation) 시도를 통해 뇌혈관 장벽으로 인한 약물의 투과 문제도 극복이 가능 할 것으로 사료된다.
종합해보면, 본 연구에서 NGS 데이터 기반으로 발굴한 전복 유래 신규 펩타이드가 교모세포종에 대해 암 세포 특이적인 항암 활성을 가지고 있으며, 세포자멸괴사 관련 인자의 발현에 영향을 주는 사실을 확인하였다. 이로써 전복 유래 펩타이드가 현재 어려움을 겪고 있는 교모세포종 치료를 위한 항암제 후보물질로써 활용 가능성이 있음을 시사하였다.
- References
-
1. Chen J, Liang P, Xiao Z, Chen MF, Gong F, Li C, Zhou C, Hong P, Jung WK, Qian ZJ. 2019. Antiphotoaging effect of boiled abalone residual peptide ATPGDEG on UVB-induced keratino- cyte HaCaT cells. Food Nutr Res 63: 3508.
-
2. Choi S, Seo J, Hwang J, Lee K, Lee I. 2020. Anti-inflammatory Effects of Haliotis discus-derived Antibacterial Peptide (AMP) Ab4-7 as a Functional material for Improving Inflammatory Skin Diseases. J Soc Cosmet Sci Korea 46: 147-157.
-
3. De Zoysa M, Nikapitiya C, Whang I, Lee J, Lee J. 2009. Abhisin: a potential antimicrobial peptide derived from histone H2A of disk abalone (Haliotis discus discus). Fish Shellfish Immunol 27: 639-646.
-
4. Gong F, Chen M, Zhang Y, Li C, Zhou C, Hong P, Sun S, Qian Z. 2019. A novel peptide from abalone (Haliotis discus hannai) to suppress metastasis and vasculogenic mimicry of tumor cells and enhance anti-tumor effect in vitro. Mar Drugs 17: 244.
-
5. Jung M, Kwon W. 2021. Present Status and Future of AI-based Drug Discovery. J Korea Inst Inf Commun Eng 25: 1797-1808.
-
6. Kim C, Go H, Seo J, Park N, Kim G. 2013. Anticancer Mechanism of AP1, Abalone Peptide by Cell Cycle Arrest in Human Gastric Cancer Cells. Cancer Prev Res 18: 33-40.
-
7. Kim H, Kang S, Kim I, Kim S, Kim D, Ma S, Gao T, Li H, Kim M, Lee T, Ham K. 2006. In vitro Anti-hypertensive, Antioxidant and Anticoagulant Activities of Extracts from Haliotis discus hannai. J Korean Soc Food Sci Nutr 35: 835-840.
-
8. Ko S, Lee D, Park W, Yoo J, Yim M, Qian Z, Lee C, Oh J, Jung W, Choi I. 2016. Anti-allergic effects of a nonameric peptide isolated from the intestine gastrointestinal digests of abalone (Haliotis discus hannai) in activated HMC-1 human mast cells. Int J Mol Med 37: 243-250.
-
9. Lee C, Hong K, Chun Y. 2016. The Study on Skin 1st Patch Test of Fermented Hydrolysate from Abalone (Haliotis discus hannai Ino). Journal of the Korea Academia-Industrial Cooperation Society 17: 421-424.
-
10. Lee K, Kim J, Veerappan K, Chung H, Natarajan S, Kim K, Park J. 2021. Utilizing Red Spotted Apollo Butterfly Transcriptome to Identify Antimicrobial Peptide Candidates against. Insects 12: 466.
-
11. Lee SB, Song J, Park A. 2020. A trend of artificial intelligence in the healthcare. The Journal of the Korea Contents Association 20: 448-456.
-
12. Li J, Tong T, Ko D, Chung D, Jeong W, Kim J, Kang S. 2012. Anti-oxidant and Anti-skin-aging Effects of Abalone Viscera Extracts in Human Dermal Fibroblasts. Korean J Food Preser 19: 463-469.
-
13. Lim SY. 2014. Cytotoxic and antioxidant activities of abalone (Haliotis discus hannai) extracts. J Life Sci 24: 737-742.
-
14. Melo-Lima S, Gajate C, Mollinedo F. 2015. Triggers and signaling cross-talk controlling cell death commitment. Cell Cycle 14: 465-466.
-
15. Oberoi RK, Parrish KE, Sio TT, Mittapalli RK, Elmquist WF, Sarkaria JN. 2016. Strategies to improve delivery of anticancer drugs across the blood-brain barrier to treat glioblastoma. J Neurooncol 18: 27-36.
-
16. Pagano C, Navarra G, Coppola L, Avilia G, Pastorino O, Della Monica R, Buonaiuto M, Torelli G, Caiazzo P, Bifulco M, Laezza C. 2022. N6-isopentenyladenosine induces cell death through necroptosis in human glioblastoma cells. Cell Death Discov 8: 173.
-
17. Poon MTC, Bruce M, Simpson JE, Hannan CJ, Brennan PM. 2021. Temozolomide sensitivity of malignant glioma cell lines - a systematic review assessing consistencies between in vitro studies. BMC Cancer 21: 1240.
-
18. Seo J, Go H, Kim C, Nam B, Park N. 2016. Antimicrobial peptide, hdMolluscidin, purified from the gill of the abalone, Haliotis discus. Fish Shellfish Immunol 52: 289-297.












