JMLS 2021 December;6(2):88-96. 10.23005/ksmls.2021.6.2.88 Epub 2021 December 15
Copyright © 2021 by The Korean Society of Marine Life Science
Intersexuality of Oyster, Crassostrea gigas in Uninhabited Island Waters Near Yeosu, Korea
Jung Jun Park; Aquaculture Management Division, National Institute of Fisheries Science (NIFS), Busan 46083, Korea
So Ryung Shin; Department of Aqualife Medicine, Chonnam National University, Yeosu 59626, Korea
Hyeon Jin Kim; Department of Aqualife Medicine, Chonnam National University, Yeosu 59626, Korea
Han Young Oh; Department of Aqualife Medicine, Chonnam National University, Yeosu 59626, Korea
Dong-Geun Lee; JeollaNamdo Institute of Ocean&Fisheries Science, Yeosu 59782, Korea
Jung Sick Lee; Department of Aqualife Medicine, Chonnam National University, Yeosu 59626, Korea
- Abstract
본 연구는 여수 인근 13개 무인도 주변 해역의 굴 Crassostrea gigas (n=410, SH 43.3±11.4 mm)에서 확인된 인터섹스 현상을 보고하고자 하였다. 전체 성비(암:수)는 1:1.1이었으나 채집 정점 별로 성비의 차이를 보였다. 가장도, 소경도, 중삼도에서는 암컷이 65% 이상의 높은 비율을 보였으며, 송도, 초도, 부서도에서는 수컷이 65% 이상의 높은 비율을 나타냈다. 전체 intersexuality는 약 12.8%로 암컷에서 약 34.7%, 수컷에서 약 64.3%로 수컷에서 높았다. Intersexuality는 가막만의 초도에서 약 43.8%로 가장 높았다. 조직학적으로 인터섹스는 intrafollicular type, interfollicular type, mixed type의 세 가지 형태로 나눌 수 있었다. 이들 세 가지 형태 가운데 intrafollicular type이 약 81.6%로 가장 우세하였다. 본 연구에서 보고된 굴의 인터섹스 원인에 관해서는 추후 세부적인 연구가 필요할 것으로 생각된다.
The purpose of this study was to report the intersex identified in the oyster Crassostrea gigas (n=410, SH 43.3±11.4 mm) in the waters around 13 uninhabited islands near Yeosu. The overall sex ratio (male: female) was 1:1.1, but there was a difference between the sampling areas. In Gajangdo, Sogyeongdo, and Jungsamdo, females showed a high ratio of 65% or more, and in Songdo, Chodo, and Buseodo, males showed a high ratio of 65% or more. The overall intersexuality was about 12.8%, which was high in males, about 34.7% in females and 64.3% in males. Intersexuality was the highest with about 43.8% in Chodo of Gamak Bay. Histologically, intersex could be divided into three types: intrafollicular type, interfollicular type and mixed type. Among these three types, the intrafollicular type was the most dominant with about 81.6%. The intersex cause of oysters reported in this study is considered to require detailed research in the future.
Keywords: Crassostrea gigas(굴) Intersexuality(인터섹스)
Correspondence to: So Ryung Shin; Department of Aqualife Medicine, Chonnam National University, Yeosu 59626, Korea
- Received
- 5 November 2021;
- Revised
- 6 November 2021;
- Accepted
- 16 November 2021.
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Language: Korean/English,
Full Text:

서 론
연안 해양환경에서 중금속과 내분비계장애물질(EDCs: endocrine disrupting chemicals) 등의 화학적 오염원에 의한 생물 위해성 평 가는 생태계의 보존과 개체군 수준에서 건강성 유지에 필요한 매우 중요한 정보를 제공한다. 환경요인의 영향 평가에 사용되는 생물학적 지표 가운데 성비, 인터섹스(intersex), 성성숙 변화 등의 생식생물학적 지표들은 장기적인 환경조건을 간접적으로 파악할 수 있는 안정된 지표로서 생태영향 모니터링에 유용하게 사용된다(Holm et al., 1991; Bortone and Davis, 1994; Jobling et al., 1998, 2002; Baralla et al., 2021).
인터섹스는 형태학적으로 반대 성의 성징이 발현된 현상으로 복족류의 암컷에서 수컷의 성징이 발현되는 임포섹스와 마찬가지로 병리학적 자웅동체의 한 예이다(Reinboth, 1975; Gibbs et al., 1988). 동물계에서 인터섹스 현상은 곤충에서부터 포유류에 이르기까지 다양한 분류군에서 보고되어 왔지만, 인터섹스 현상과 환경 중의 화학물질과의 명확한 연관성은 제시하지 못하였다(Reinboth, 1975). 하지만, 1980년대 이후 수서동물에서 인터섹스 현상이 수중의 화학물질에 의해 유도된다는 결과가 경골어류인 Gambusia affinis (Drysdale and Bortone, 1989), Oryzias latipes (Gray and Metcalfe, 1997), Cyprinus carpio (Gimeno et al., 1997), Rutilus rutilus (Trevor et al., 2001) 등과 복족류인 Nucella lapillus (Gibbs et al., 1988), Thais clavigera (Horiguchi et al., 1994)와 이매패류인 Mya arenaria (Gauthier-Clerc et al., 2002), Scrobicularia plana (Chesman and Langston, 2006), 대복 Gomphina veneriformis (Park, 2008; Ju et al., 2009), Rangia cuneata (Graca et al., 2021) 등에서 보고된 바 있다.
본 연구는 우리나라 남해안 연안의 생태 건강도를 조사하는 과정에서 여수 인근 무인도 주변의 해역에서 이매패류인 굴 Crassostrea gigas에서 인터섹스 현상이 관찰되어 이를 보고하고자 한다.
재료 및 방법
1. 시료와 채집
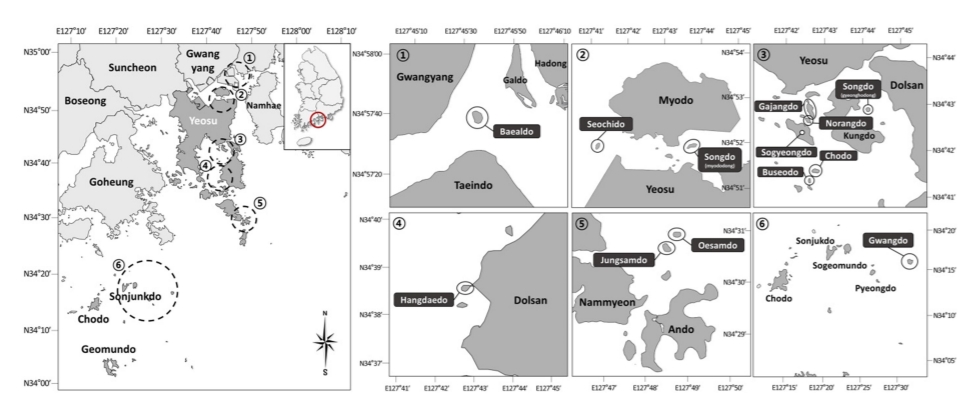
분석에 사용한 굴 Crassostrea gigas는 2010년 5월부터 9월까지 여수 인근 광양만(3개), 가막만(9개), 여수외해(1개)의 13개 무인도 주변의 조간대에서 채집하였다(Fig. 1). 분석에 사용된 굴은 410개체였으며, 크기는 각고 43.3±11.4 mm였다(Table 1).
2. 광학현미경 표본제작
시료는 채집 직후 현장에서 10% 중성포르말린으로 고정한 후, 실험실로 옮겨 수세 한 다음 측정형질을 계측한 후 해부하여 생식소가 포함된 내장낭 부위를 적출하여 Bouin 용액으로 24시간 동안 재고정하여 24~48시간 동안 흐르는 물로 수세하였다. 그 후 에탄올 단계별 탈수과정과 자일렌 치환과정을 거쳐 파라플라스트(Mccormick, U.S.A.)에 포매하였다. 포매된 시료는 마이크로톰(RM2235, Leica, Germany)을 이용하여 4 μm 두께로 연속절편하여 조직표본을 제작하였다. 제작된 조직표본은 Mayer's hematoxylin-eosin (H-E) 염색을 실시하여 광학현미경(BX50F4, Olympus, Japan)으로 관찰하였다.
3. 성비 및 인터섹스 판정
성비와 인터섹스 발현은 생식소 조직표본을 분석하여 구분하였다. 인터섹스는 개체 당 평균 약 1 cm2 크기의 조직표본 10개를 대상으로 반대 성의 생식세포가 나타나는 경우만을 포함하였으며, 다른 성징은 포함하지 않았다.
4. 통계학적 분석
성비는 SPSS 통계 프로그램을 이용하여 χ2 t-test로 유의성 여부를 판정하였다(IBM SPSS Statistics 27, IBM, U.S.A.).
결 과
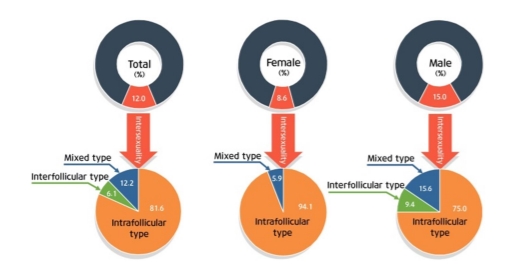

1. 성비
13개 지점의 전체 성비(암:수)는 1:1.1이었으며, 광양만 1:1.1, 가막만 1:1.1, 여수외해에서 1:1.1로 지역에 따라 차이를 보이지 않았다. 하지만 가막만에서는 채집 정점별로 성비의 차이를 보였는데, 가장도, 소경도, 중삼도에서는 암컷이 65% 이상의 높은 비율을 보였으며, 송도, 초도, 부서도에서는 수컷이 65% 이상의 높은 비율을 나타냈다(Table 1).
2. 인터섹스
조직학적인 분석 결과, 생식소 외막에 다른 체 조직이 형성되어 이곳에 반대 성의 생식세포들이 발달된 형태나 생식소 내부에 결체성막에 의한 반대 성의 생식소 조직이 구분되는 형태의 인터섹스는 관찰되지 않았다.
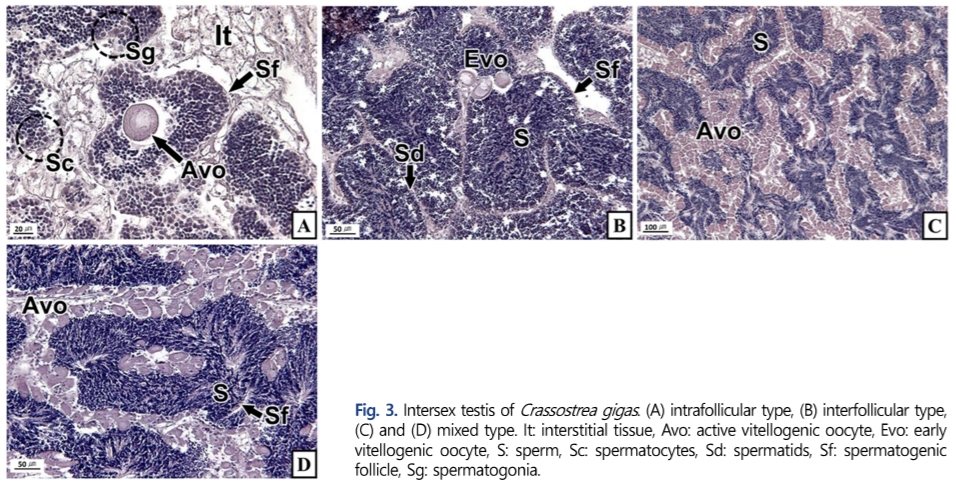
확인된 인터섹스의 형태는 조직학적으로 다음의 세 가지 형태로 구분할 수 있었다. 1) Intrafollicular type: 동일 생식소에서 반대 성의 생식세포들이 생식세포형성소낭(gametogenic follicle) 내부에서 단독 또는 무리지어 나타나는 형태(Figs. 2A and 3A), 2) Interfollicular type: 동일 생식소에서 반대 성의 생식세포들이 생식세포형성소낭과 생식세포형성소낭 사이의 간질 조직에서 단독 또는 무리지어 나타나는 형태(Fig. 3B), 3) Mixed type: 동일 생식소에서 intrafollicular type과 interfollicular type이 동시에 존재하는 형태(Figs. 2B and 3C, D).
조직학적으로 인터섹스 현상이 확인된 난소 또는 정소의 발달 단계는 초기활성기부터 완숙기까지 다양했다. 또한 이성생식세포의 발달 단계 역시 다양했는데, 암컷의 생식세포는 난황형성 활성기의 난모세포가 주를 이루었다(Fig. 2). 수컷 생식세포는 정원세포부터 완숙 정자기까지 관찰되었지만 정자기가 대부분이었다(Fig. 3).
전체 인터섹스 발현율은 12.0%였으며, 초도에서 43.8%로 가장 높았으며, 부서도에서는 0%였다. 성별로는 암컷에서는 8.6%, 수컷에서는 15.0%로 수컷에서 높게 나타났으며, 인터섹스가 확인된 12개 지점 가운데 9개 지점에서는 수컷이 높은 인터섹스 비율을 보였다. 인터섹스 형태별로는 전체 인터섹스 가운데 intrafollicular type이 81.6%, interfollicular type이 6.1%, mixed type이 12.2%로 나타났다. 성에 따라서는 intrafollicular type이 각각 94.1%(암), 75.0% (수), interfollicular type은 각각 0%(암), 9.4%(수), mixed type이 각각 5.9%(암), 15.6%(수)로 나타났다(Fig. 4).
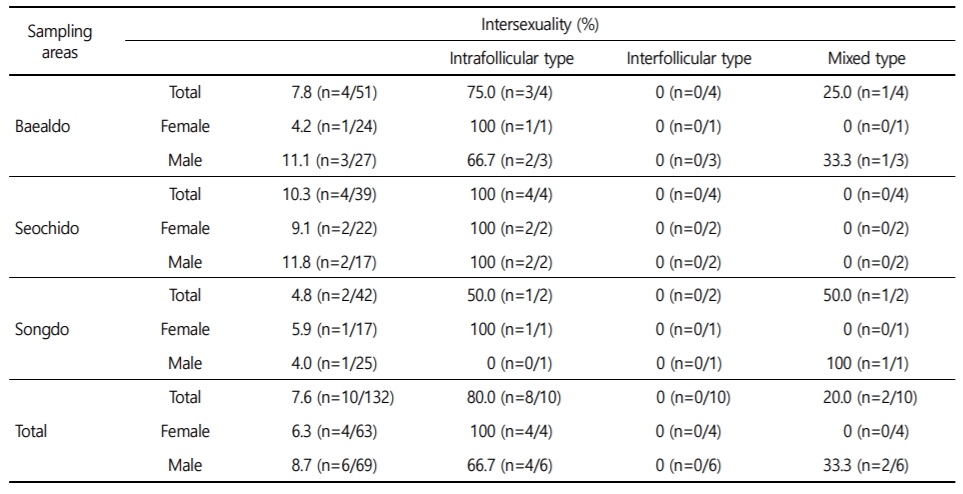
조사 지역별로 광양만(3개)에서 전체 인터섹스 발현율은 7.6%였으며, 암컷에서 6.3%, 수컷에서 8.7%로 나타났다. 인터섹스 형태별로는 intrafollicular type이 80.0%, mixed type이 20.0%를 보였다. 성별로는 3개 지점 가운데 2개 지점에서 수컷이 높은 인터섹스 비율을 보였다(Table 2).
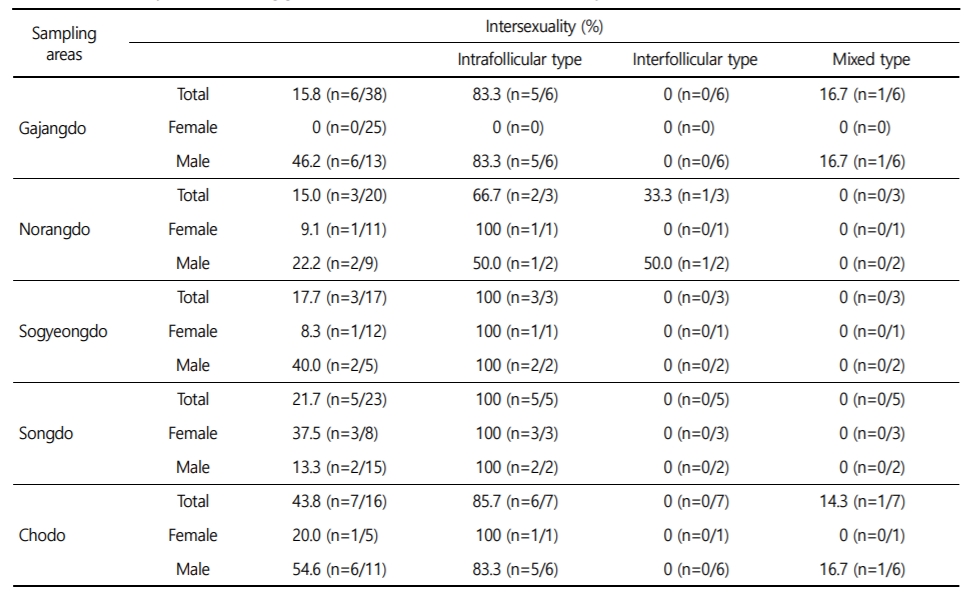
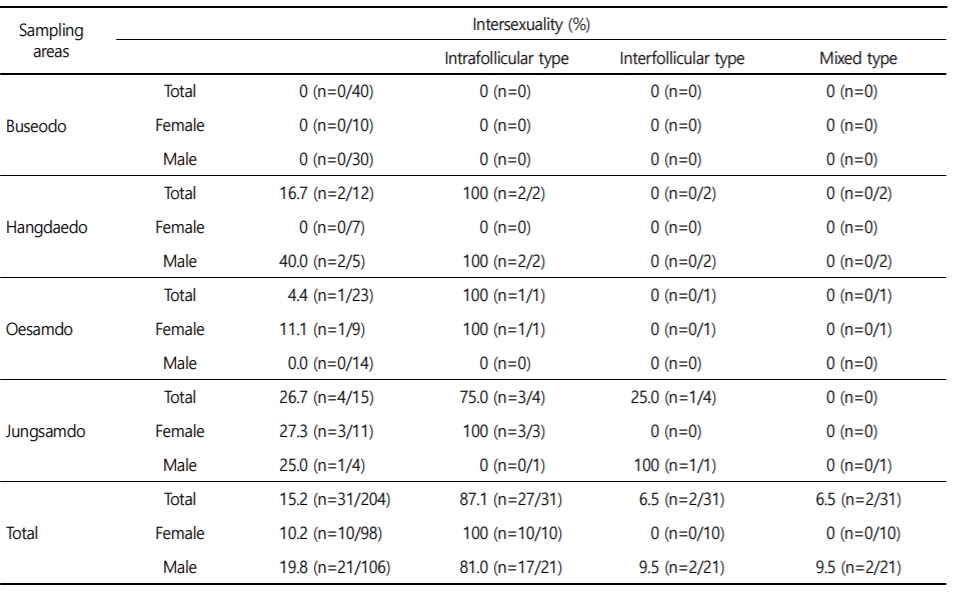
가막만(9개)에서 전체 인터섹스 발현율은 15.2%였으며, 암컷에서 10.2%, 수컷에서 19.8%로 수컷에서 높게 나타났다. 인터섹스 형태별로는 intrafollicular type이 87.1%, interfollicular type과 mixed type이 각각 6.5%를 보였다. 성별로는 인터섹스가 확인된 8개 지점 가운데 6개 지점에서 수컷이 높은 인터섹스 비율을 보였다(Table 3).
여수외해(1개)에서 인터섹스 발현율은 10.8%였으며, 암컷에서8.3%, 수컷에서 13.2%로 수컷에서 높게 나타났다. 인터섹스 형태별로는 intrafollicular type이 62.5%, interfollicular type과 mixed type이 각각 12.5%와 25.0%였다(Table 4).
고 찰
이매패류는 부유생물과 유기물을 여과 섭이하는 섭이생태와 경골어류에 비해 이동성이 매우 낮기 때문에 특정 지역의 환경조건을 잘 반영하는 서식생태학적 특징으로 인해 진주담치 Mytilus edulis, 지중해담치 M. galloprovincialis, Mya arenaria, 바지락 Tapes philippinarum, Scapharca inaequivalvis, 굴 Crassostrea gigas, 꼬막 Tegillarca granosa, 대복 Gomphina veneriformis 등의 이매패류가 생태영향 평가를 위한 지표종으로 사용되어 왔다(Byrne andO'Halloran, 2001; Siah et al., 2003; Ju et al., 2006; Marin et al., 2006; Schintu et al., 2008; Park, 2008; Lee et al., 2010). 따라서 본 연구에서도 이러한 생태적 특징을 잘 반영하고 한국 남해안의 우점 이매패류인 굴을 이용하여 생태 건강성을 알아보고자 하였다.
해양생태계의 건강성과 오염원의 위해성을 평가하는 과정에서 성비의 불균형과 인터섹스 현상은 대복, 바지락, Dreissena poly- morpha을 비롯한 많은 이매패류에서 보고되었는데, 이러한 현상은 수중의 내분비계장애물질이나 중금속 등의 화학적 요인에 의해서 유도된다(Matozzo and Marin, 2005; Quinn et al., 2006; Ju et al., 2009; Park and Lee, 2011; Kim et al., 2021).
내분비계장애물질은 성호르몬 모방효과(mimic effect)를 가지며, 자성화 또는 웅성화를 유도하는 화학물질로 수서동물의 생식관련 내분비계를 교란시켜 형태학적 성의 표현이나 기능을 변화 시킨다(Iguchi, 1998; Tyler and Routledge, 1998; Quinn et al., 2004; Graca et al., 2021). 또한 중금속 가운데 카드뮴, 납, 구리, 아연 등이 내분비계의 기능을 변화시키는 것으로 확인되었다(WWF, 2006; Lee and Park, 2007; Ju et al., 2009; Kim et al., 2021).
화학적 요인 가운데 웅성화를 유도하는 대표적인 물질로는 유기주석과 아연 등이 보고되고 있으며(Gibbs et al., 1988; Kim et al., 2021), 자성화를 유도하는 대표적인 물질로는 페놀류가 보고되고 있다(Nimrod and Benson, 1996; Matozzo and Marin, 2005; Quinn et al., 2006; Andrew et al., 2008).
이러한 화학적 요인에 의한 이매패류의 성비 불균형은 내분비계장애물질 오염 지역의 M. arenaria (Gagné et al., 2003)를 비롯하여 D. polymorpha (Quinn et al., 2004)와 S. plana (Chesman and Langston, 2006)에서 보고되었다. 한국의 연안 해양생태계에서는 진해만의 유기주석 오염 지역에서 피조개 S. broughtonii에서 1:1.6 (Lee et al., 2009), 굴은 통영 산양읍 연안에서 1:6.1, 거제 둔덕면 연안에서는 1:0.7, 바지락은 여수 화양면 삼도와 이목리 연안에서 각각 1:1.6, 1:1.5로 보고되었다(Lee et al., 2010).
본 연구에서 광양만의 송도에서는 1:1.5, 가막만의 송도 1:1.9, 초도 1:2.2, 부서도 1:3.0, 외삼도 1:1.6에서는 수컷의 비율이 높았으며, 가장도에서는 1:0.5, 소경도와 중삼도에서는 1:0.4로 암컷의 비율이 다른 지역에 비해 상대적으로 높았다.
이매패류에서 인터섹스는 영국의 Avon Estuary와 포르투갈의 Guadiana Estuary에서 채집한 S. plana의 수컷에서 각각 최고 50%와 71.4%였으며(Chesman and Langston, 2006; Gomes et al., 2009), 발틱해 13개 지점의 진주담치에서는 지점별로 차이를 보였으나 평균 1.8% 였다(Dublinowska et al., 2016). 한국 가막만의 지중해담치에서 26.4%였는데, 이 가운데 성에 따른 인터섹스 발현율은 암컷과 수컷에서 각각 12.9%와 38.8%로 수컷에서 더 높았다(Jeon et al., 2013). 굴은 여수 가막만의 장군도에서 44.0%(암 53.8%, 수 33.3%), 통영 도산면 연안에서 31.7%(암 20.8%, 수 44.4%), 거제 사등면 연안에서 22.9%(암 20.8%, 수 25.0%)였다. 바지락은 여수 화양면 목도에서 29.5%(암 33.3%, 수 26.1%), 삼도에서 38.1%(암 81.3%, 수 11.5%), 이목리 연안에서 25.6%(암 29.4%, 수 23.1%), 묘도동 송도에서 15.1%(암 26.1%, 수 6.7%)였으며, 모두 암컷에서 높은 출현율을 보였다(Lee et al., 2010).
본 연구에서 전체 인터섹스 발현율은 12.8%였으며, 암컷에서는 8.6%, 수컷에서는 15.0%로 수컷에서 높게 나타났으며, 인터섹스가 확인된 12개 지점 가운데 9개 지점에서 수컷이 높은 인터섹스 비율을 보였다. 화학적 요인의 자성화 및 웅성화 특성에 따른 성별 인터섹스 출현의 인과관계는 비교적 많은 연구가 있으나(Gibbs et al., 1988; Drysdale and Bortone, 1989; Ackermann et al., 2002; Andrew et al., 2008; Kim et al., 2021) 인터섹스 발현에 관한 종 특이성에 관한 연구는 찾아보기 힘들므로 이에 관한 추후의 연구가 필요하다.
본 연구 결과, 굴의 성비 불균형과 인터섹스의 연관관계는 성비의 불균형이 큰 8개 지점(광양만의 송도, 가막만의 송도, 초도, 부서도, 외삼도, 가장도, 소경도, 중삼도) 가운데 5개 지점(가막만의 송도: 21.7%, 초도: 43.8%, 가장도: 15.8%, 소경도: 17.7%, 중삼도: 26.7%)에서 인터섹스 출현율이 다른 지역에 비해 상대적으로 높았다.
또한, 부서도를 제외한 수컷의 성비가 높은 광양만의 송도, 가막만의 송도, 외삼도에서는 암컷에서 인터섹스 비율이 높았으며, 암컷의 성비가 높은 가장도와 소경도에서는 수컷에서 인터섹스의 비율이 상대적으로 높았다. 이러한 결과로 볼 때, 성비의 불균형은 인터섹스 출현율 및 성별 인터섹스 출현율의 연관성은 충분히 논의할 만한 내용으로 판단된다.
이매패류에서 인터섹스의 조직학적 발현 형태에 관한 연구는 많지 않다. Chesman and Langston (2006)은 내분비계장애물질 오염 지역에서 S. plana의 정소에서 발현된 난모세포의 수를 통해 인터섹스의 발현 단계를 여섯 가지 형태로 구분하여 인터섹스의 진행 정도를 구분하였다. 가막만에서 채집한 굴과 바지락(Lee et al., 2010) 그리고 아연에 의해 유도된 꼬막의 인터섹스에서는 이성생식세포의 분포 위치에 따라 interfollicular type과 intrafollicular type 두 가지 발현 형태가 보고되었다(Kim et al., 2021). 지중해담치에서는 이성생식세포의 위치에 따라 네 가지 형태로 구분되었는데, 첫 번째는 생식세포형성소낭 내에 이성생식세포가 발현된 interfollicular type이며, 두 번째는 서로 다른 성의 생식세포형성소낭이 발현된 형태이며, 세 번째는 생식세포형성소낭 사이에 이성생식세포들이 발현된 intrafollicular type이며, 네 번째는 생식소 외막과 다른 조직에서 이성생식세포가 발현된 형태이다(Jeon et al., 2013).
본 연구에서는 생식소 외부에 다른 체 조직이 형성되어 이곳에 이성생식세포들이 발달된 형태나 생식소 내부에 결체성막에 의한 난소와 정소 조직이 구분되는 인터섹스 형태는 관찰되지 않았다. 굴은 바지락, 꼬막 등과 함께 생식소 비활성기에 성전환을 하는 웅성선숙형 비동시자웅동체(protandrous sequential hermaphrodite)로서 생식소에 암, 수의 형태학적 성이 동시에 존재하지는 않는다(Guo et al., 1998; Park et al., 2012; Lee et al., 2013, 2014). 따라서 본 연구에서 확인된 인터섹스 현상은 조직학적으로 Sadovy and Shapiro (1987)가 제시한 경계형(delimited type)과 비경계형(un- delimited type)의 두 가지 자웅동체 형태 가운데 비경계형의 자웅동체 현상이 아니라 병리적인 현상으로 판단되었다.
생물학적 반응을 유도하는 중요한 인자 가운데 하나인 화학적 요인의 생태영향 평가에서 생물지표의 평가는 매우 유용한 방법이지만, 생물지표만으로 원인관계를 규명하기에는 한계가 있으므로 화학적 분석이 되어야 한다(NRC, 1983; Huggett et al., 1992). 본 연구 사용된 굴의 채집 지역은 환경적으로 선박의 출입이 잦은 광양항과 여수화학공단 그리고 도시와 인접한 곳으로 다양한 생활하수 등의 오염원에 노출될 수 있는 가능성이 높은 곳이다. 또한 해당 지역은 굴, 지중해담치, 바지락 등의 양식장이 위치한 해역으로 이들 양식생물의 안전성에 대한 검토 역시 필요할 것으로 판단된다.
- References
-
1. Ackermann GE, Schwaiger J, Negele RD, Fent K. 2002. Effects of long-term nonylphenol exposure on gonadal development and biomarkers of estrogenicity in juvenile rainbow trout, Oncorhynchus mykiss. Aquat Toxicol 60: 203-221.
-
2. Andrew MN, Dunstan RH, O'Connor WA, Van Zwieten L, Nixon B, MacFarlane GR. 2008. Effects of 4-nonylphenol and 17-ethynylestradiol exposure in the Sydney rock oyster, Saccostrea glomerata: Vitellogenin induction and gonadal development. Aquat Toxicol 88: 39-47.
-
3. Baralla E, Pasciu V, Varoni MV, Nieddub M, Demuro R, Demontis MP. 2021. Bisphenols' occurrence in bivalves as sentinel of environmental contamination. Sci Total Environ 785: 147263.
-
4. Bortone SA, Davis WP. 1994. Fish intersexuality as indicator of environmental stress: Monitoring fish reproductive systems can serve to alert humans to potential harm. Bioscience 44: 165-172.
-
5. Byrne PA, O'Halloran J. 2001. The role of bivalve molluscs as tools in estuarine sediment toxicity testing: a review. Hydrobiologia 465: 209-217.
-
6. Chesman BS, Langston WJ. 2006. Intersex in the clam Scrobicularia plana: a sign of endocrine disruption in estuaries? Biol Lett 2: 420-422.
-
7. Drysdale DT, Bortone SA. 1989. Laboratory induction of intersex- uality in the mosquitofish, Gambusia affinis, using paper mill effluent. Bull Environ Contam Toxicol 43: 611-617.
-
8. Dublinowska M, Smolarz K, Zabrzańska S, Larsson J, Czerniawska N. 2016. Intersexuality in the blue mussel Mytilus edulis complex (Mytilidae) from the Baltic Sea and the Danish Strait. Am Malacol Bull 34: 28-39.
-
9. Gagné F, Blaise C, Pellerin J, Pelletier E, Douville M, Gauthier-Clerc S, Viglino L. 2003. Sex alteration in soft-shell clams, Mya arenaria in an intertidal zone of the Saint Lawrence River (Quebec, Canada). Comp Biochem Physiol C 134: 189-198.
-
10. Gauthier-Clerc S, Pellerin J, Blaise C, Gagné F. 2002. Delayed game- togenesis of Mya arenaria in the Saguenay fjord (Canada): a consequence of endocrine disruptors? Comp Biochem Physiol C 131: 457-467.
-
11. Gibbs PE, Pascoe PL, Burt GR. 1988. Sex change in the female dog-whelk, Nucella lapillus, induced by tributyltin from anti- fouling paints. J Mar Biol Assoc UK 68: 715-731.
-
12. Gimeno S, Komen H, Venderbosch PWM, Bowmer T. 1997. Disrup- tion of sexual differentiation in genetic male common carp (Cyprinus carpio) exposed to an alkylphenol during different life stages. Environ Sci Technol 31: 2884-2890.
-
13. Gomes T, Gonzalez-Rey M, Bebianno MJ. 2009. Incidence of intersex in male clams Scrobicularia plana in the Guadiana Estuary (Portugal). Ecotoxicology 18: 1104-1109.
-
14. Graca B, Rychter A, Staniszewska M, Smolarz K, Sokolowski A, Bodziach K. 2021. Bioaccumulation of phenolic endocrine disruptors in the clam Rangia cuneata: Storage in shells and influence of size and sex. Environ Res 197: 111181.
-
15. Gray MA, Metcalfe CD. 1997. Induction of testis-ova in Japanese medaka, Oryzias latipes exposed to p-nonylphenol. Environ Toxicol Chem 16: 1082-1086.
-
16. Guo X, Hedgecock D, Hershberger WK, Cooper K, Allen SK Jr. 1998. Genetic determinants of protandric sex in the Pacific oyster, Crassostrea gigas Thunberg. Evolution 52: 394-402.
-
17. Holm G, Norrgren L, Linden O. 1991. Reproductive and histo- pathological effects of long-term experimental exposure to bis(tributyltin)oxide (TBTO) on the three-spined stickleback, Gasterosteus aculeatus Linnaeus. J Fish Biol 38: 373-386.
-
18. Horiguchi T, Shiraishi H, Shimizu M, Morita M. 1994. Imposex and organotin compounds in Thais clavigera and T. bronniin Japan. J Mar Biol Ass UK 74: 651-669.
-
19. Huggett RJ, Kimerle RA, Mehrle PM Jr, Bergman HL (eds.). 1992. Biomarkers: biochemical, physiological, and histological markers of anthropogenic stress. Lewis Publishers, London, pp 347.
-
-
21. Jeon MA, Kang JC, Lee JS. 2013. Concentration of heavy metal and alteration of reproductive and histological biomarker of Mytilus galloprovincialis in Gamak Bay of the Southern coast of Korea. Korean J Malacol 29: 33-41.
-
22. Jobling S, Coey S, Whitmore JG, Kime DE, Van Look KJW, McAllister BG, Beresford N, Henshaw AC, Brisghty G, Tyler CR, Sumpter JP. 2002. Wild intersex roach, Rutilus rutilus have reduced fertility. Biol Reprod 67: 515-524.
-
23. Jobling S, Nolan M, Tyler CR, Brighty G, Sumpter JP. 1998. Wide- spread sexual disruption in wild fish. Environ Sci Technol 32: 2498-2506.
-
24. Ju SM, Lee JW, Jin YG, Yu J, Lee JS. 2006. Effect of zinc bio- accumulation on survival rate, activity, growth and organ structure of the equilateral venus, Gomphina veneriformis (Bivalvia: Veneridae). Environ Health Toxicol 21: 115-126.
-
25. Ju SM, Park JJ, Lee JS. 2009. Induction of intersex and mascu- linization of the equilateral venus, Gomphina veneriformis (Bivalvia: Veneridae) by Zinc. Anim Cells Syst 13: 339-344.
-
26. Kim HJ, Shin SR, Kim H, Park JJ, Shin YK, Lee JS. 2021. Induction of sex ratio change and intersex in Tegillarca granosa (Bivalvia: Arcidae) by waterborne zinc exposure. Aquacult Rep 21: 1000794.
-
27. Lee JS, Cho HS, Jin YG, Park JJ, Shin YK. 2009. Reproductive disrupting effect of organotin compound in the ark shell, Scapharca broughtonii (Bivalvia: Arcidae). Anim Cells Syst 13: 223-227.
-
28. Lee JS, Lee YG, Kang SW, Park JS, Lee DG, Jeon MA, Ju SM. 2010. Intersexuality of Crassostrea gigas and Ruditapes philippinarum in Southern coastal waters of Korea. Environ Anal Health Toxicol 25: 287-294.
-
29. Lee JS, Park JJ. 2007. Risk assessment of nonylphenol using the sex ratio, sexual maturation, intersex and lipofuscin accumulation of the equilateral venus, Gomphina veneriformis (Bivalvia: Veneridae). Korean J Fish Aquat Sci 40: 16-23.
-
30. Lee JS, Park JJ, Shin YK, Kim H, Jeon MA. 2014. Sex change and sequential hermaphroditism in Tegillarca granosa (Bivalvia: Arcidae). Invertebr Reprod Dev 58: 314-318.
-
31. Lee JS, Park JS, Shin YK, Lee YG, Park JJ. 2013. Sequential hermaphroditism in Manila clam Ruditapes philippinarum (Bivalvia: Veneridae). Invertebr Reprod Dev 57: 185-188.
-
32. Marin MG, Boscolo R, Cella A, Degetto S, Ros LD. 2006. Field validation of autometallographical black silver deposit (BSD) extent in three bivalve species from the Lagoon of Venice, Italy (Mytilus galloprovincialis, Tapes philippinarum, Scapharca inaequivalvis) for metal bioavailability assessment. Sci Total Environ 371: 156-167.
-
33. Matozzo V, Marin MG. 2005. Can 4-nonylphenol induce vitellogenin-like proteins in the clam, Tapes philippinarum? Environ Res 97: 43-49.
-
34. Nimrod AC, Benson WH. 1996. Environmental estrogenic effects of alkylphenol ethoxylates. Crit Rev Toxicol 26: 335-364.
-
35. NRC (National Research Council). 1983. Risk assessment in the federal government: managing the process. National Aca- demy Press, Washington DC, pp 192.
-
36. Park JJ. 2008. Study on the bioindicator of the equilateral venus, Gomphina veneriformis (Bivalvia: Veneridae) chronically ex- posed to TBT (tributytin chloride). Yeosu: Chonnam National University, pp 222.
-
37. Park JJ, Kim H, Kang SW, An CM, Lee S, Gye MC, Lee JS. 2012. Sex ratio and sex reversal in two-year-old class of oyster, Crassostrea gigas (Bivalvia: Ostreidae). Dev Reprod 16: 385-388.
-
38. Park JS, Lee JS. 2011. Change of reproductive and histological biomarkers of Ruditapes philippinarum (Bivalvia: Veneridae) exposed to nonylphenol. Korean J Malacol 27: 181-190.
-
39. Quinn B, Gagne F, Blaise C, Costello MJ, Wilson JG, Mothersill C. 2006. Evaluation of the lethal the sub-lethal toxicity and potential endocrine distupting effect of nonylphenol on the zebra mussel, Dreissena polymorpha. Comp Biochem Physiol C 142: 118-127.
-
40. Quinn B, Gagne F, Costello M, McKenzie C, Wilson J, Mothersill C. 2004. The endocrine disrupting effect of municipal effluent on the zebra mussel (Dreissena polymorpha). Aquat Toxicol 66: 297-292.
-
-
42. Sadovy Y, Shapiro DY. 1987. Criteria for the diagnosis of her- maphroditism in fishes. Copeia 1987: 136-156.
-
43. Schintu M, Durante L, Maccioni A, Meloni P, Degetto S, Contu A. 2008. Measurement of environmental trace-metal levels in Mediterranean coastal areas with transplanted mussels and DGT techniques. Mar Pollut Bull 57: 832-837.
-
44. Siah A, Pellerin J, Amiard JC, Pelletier E, Viglino L. 2003. Delayed gametogenesis and progesterone levels in soft-shell clams, Mya arenaria in relation to in situ contamination to organotins and heavy metals in the St. Lawrence River (Canada). Comp Biochem Physiol C 135: 145-156.
-
45. Trevor PRG, Susan J, Carole K, Steven M, Geoff B, Michael JW, John PS, Charles RT. 2001. Exposure of juvenile roach, Rutilus rutilus to treated sewage effluent induces dose-dependent and persistent disruption in gonadal duct development. Environ Sci Techol 35: 462-470.
-
46. Tyler CR, Routledge EJ. 1998. Natural and anthropogenic environ- mental oestrogens: the scientific basis for risk assessment, oestrogenic effects in fish in English rivers with evidence of their causation. Pure Appl Chem 70: 1795-1804.
-












