JMLS 2021 December;6(2):73-79. 10.23005/ksmls.2021.6.2.73 Epub 2021 December 15
Copyright © 2021 by The Korean Society of Marine Life Science
Time-dependent Effects of Bisphenol Analogs on Ecdysteroid Pathway Related Genes in the Brackish Water Flea Diaphanosoma celebensis
Soyeon In; Department of Biotechnology, College of Convergence Engineering, Sangmyung University, Seoul 03016, Korea
Young-Mi Lee; Department of Biotechnology, College of Convergence Engineering, Sangmyung University, Seoul 03016, Korea
- Abstract
비스페놀A(BPA)는 대표적인 내분비계 교란물질로 광범위한 사용으로 인해 환경 내에서 지속적으로 검출됨에 따라 인간을 비롯한 다양한 생물에서 성장, 발생, 생식 등에 유해한 영향을 미치는 것으로 알려져 있다. 따라서 BPA를 대체하기 위한 구조 유사체들이 개발되어 널리 사용되고 있으나 이러한 대체제들이 내분비계 교란 작용을 갖는지에 대한 연구가 필요하다. 본 연구에서는 BPA와 그 구조 유사체인 BPS와 BPF에 노출시킨 기수산 물벼룩 Diaphanosoma celebensis에서 탈피과정에 관여하는 ecdysteroid 합성(nvd, cyp314a1), receptors (EcRA, EcRB, USP, ERR), 그리고 하위 경로에 있는 유전자(HR3, E75, Vtg, VtgR)의 시간 별 발현 변화를 조사하였다. nvd와 cyp314a1 유전자의 발현은 BPA 보다 BPF에서 6시간 일찍 발현이 증가하는 양상을 보인 반면, BPS의 경우에는 이들 유전자의 발현이 24시간 내내 감소하는 양상을 보였다. BPA와 BPF 노출 시 EcR 유전자들의 발현 양상도 이와 유사한 경향을 보였다. ERR 유전자의 발현은 BPF와 BPS에서 BPA 보다 6시간 일찍 발현이 증가하는 양상을 보였고, HR3, E75, VtgR의 유전자 발현도 노출군에서 시간 차이는 있지만 유의하게 증가하는 양상을 보였다. 반면 Vtg는 24시간 이내에서는 크게 증가하지는 않았다. 이러한 결과는 BPA 뿐 아니라 BPF와 BPS도 탈피에 관여하는 호르몬의 합성 및 조절 경로의 유전자의 발현을 조절할 수 있으며, 서로 다른 기전으로 기수산 물벼룩의 내분비계를 교란시킬 수 있는 능력을 갖는다고 볼 수 있다. 본 연구는 비스페놀 구조 유사체가 기수산 물벼룩의 탈피과정에 관여하는 분자 경로 어떻게 영향을 미치는지를 이해하는데 도움이 될 것이다.
Bisphenol A is a representative endocrine disruptor and continuously detected in aquatic environment due to wide use, resulting in adverse effects on growth, development, and reproduction in diverse organisms as well as human. Structural analogs have been developed to substitute BPA are also suspected to have endocrine disrupting effects. In the present study, the time-dependent expression patterns of ecdysteroid synthesis (nvd, cyp314a1), receptors (EcRA, EcRB, USP, ERR), and downstream signaling pathway - related genes (HR3, E75, Vtg, VtgR) were investigated using quantitative real time reverse transcription polymerase chain reaction (qRT-PCR) in the brackish water flea Diaphanosoma celebensis exposed to Bisphenol analogs (BPs; BPA, BPF, and BPS) for 6, 12, and 24 h. As results, the expression of nvd, cyp314a1, EcRs, USP, ERR and E75 mRNA was upregulated at 6 h exposure to BPF, which is earlier than BPA and BPS (12 h). On the other hand, HR3, E75 and VtgR mRNA levels were elevated at 6 h earlier at BPS and BPF than at BPA (12 h), but Vtg mRNA level was slightly changed within 24 h. These findings suggest that like BPA, BPF and BPS can also modulate the transcription of ecdysteroid pathway - related genes with different mechanisms, and have a potential as endocrine disruptors. This study will provide a better understanding the molecular mode of action of bisphenols on ecdysteroid pathway in the brackish water flea.
Keywords: Bisphenol A(비스페놀A) Bisphenol F(비스페놀F) Bisphenol S(비스페놀S) Ecdysteroid(탈피호르몬) Brackish water flea(기수산 물벼룩)
Correspondence to: Young-Mi Lee; Department of Biotechnology, College of Convergence Engineering, Sangmyung University, Seoul 03016, Korea
- Received
- 28 July 2021;
- Revised
- 16 August 2021;
- Accepted
- 2 September 2021.
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Language: Korean/English,
Full Text:

서 론
비스페놀(bisphenol)은 플라스틱 제조, 종이 코팅, 에폭시 수지 등에 광범위하게 사용되어 왔으며(Beausoleil et al., 2018), 최근 플라스틱의 사용이 증가함에 따라 수 환경 내에서도 지속적으로 검출되고 있다(Liao et al., 2012). 가장 많이 사용되어 온 비스페놀A(bisphenol A, BPA)는 대표적인 내분비계 교란물질로 알려져 왔으며, 인간을 포함한 다양한 생물에서 정상적인 호르몬의 기능을 교란함으로써 성장, 발생, 생식 등에 유해한 영향을 미친다고 보고된 바 있다(Segner et al., 2003; Canesi and Fabbri, 2015). 따라서 BPA는 2018년부터 국제사회에서 사용이 제한되어 왔으며(ECHA, https://echa.europa.eu/), 이를 대체하기 위해 지금까지 16종류의 BPA 구조 유사체들이 개발되어 왔다(Chen et al., 2016). 이들 중 비스페놀F(BPF; 4,40-dihydroxydiphenylmethane)와 비스페놀S(BPS; 4,40-sulfonyldiphenol)는 식품 포장, 영수증, 염료(dyes), 치과용 장비 등 다양한 분야에서 사용됨에 따라 BPA와 더불어 환경 내에서 높게 검출되고 있다(Cabaton et al., 2009; Naderi et al., 2014). 특히 한국에서 비스페놀 구조 유사체는 퇴적물에서 BPA(최대 13,370 ng /g dw) > BPF(최대 9,650 ng/g dw) > BPS(최대 1,970 ng/g dw) 순으로 높게 검출된 바 있다(Liao et al., 2012). 최근 연구를 통해 BPA 구조 유사체들도 내분비계 교란 작용을 한다는 보고가 있으나(Rochester and Bolden, 2015) 해양 소형 무척추 생물에 대한 영향 연구는 미흡한 실정이다.
갑각류(Crustacean)의 탈피과정은 내분비 호르몬인 ecdysteroid에 의해 조절되며 개체의 성장, 발생, 변태, 그리고 생식에 중요한 과정이다(Lafont and Mathieu, 2007). Ecdysone은 neverland (nvd)에 의해 콜레스테롤에서 합성된 후 cyp314a1 유전자의 산물인 ecdy- sone 20-monooxygenase에 의해 활성형인 20-hydroxyecdysone (20HE)로 전환된다(Lafont et al., 2005). 그런 다음 20HE는 ecdysone receptor (EcR)과 ultraspiracle (USP)의 heterodimer와 결합하여 핵으로 이동하여 ecdysone 반응 경로에 있는 유전자들(HR3, E75, vitellogenin (Vtg), vitellogenin receptor (VtgR))의 발현을 조절하게 된다(Nakagawa and Henrish, 2009; Miyakawa et al., 2018). 갑각류의 estrogen-related receptors (ERRs)는 척추동물의 estrogen receptors (ERs)와 유전자 서열이 유사하여 계통학적으로 가까운 것으로 알려져 있다(Laudet, 1997). ER과 결합하는 합성 에스트로겐에 노출되었을 때 copepod, mysid 등 갑각류의 발생과 생식이 영향을 받았다는 보고가 있으나(Andersen et al., 2001; Segner et al., 2003; Ghekiere et al., 2006), 갑각류 ERR의 기능에 대해서는 아직 연구가 부족하다.
기수산 물벼룩 Diaphanosoma celebensis (Crustacean, Cladocera, Sididae)는 광염성 지각류로 아시아의 열대지역에서 주로 서식한다. 1차 소비자로서 어류 양식장에서 치어의 먹이로 이용되는 만큼 해양생태계에서 주요 에너지 전달자로서 중요한 역할을 담당하고 있다. 사육이 용이하며, 크기가 작고, 다음 세대 까지의 기간이 짧으며, 단성교배를 통해 개체간 유전적 동질성 유지가 가능하다는 점 등 실험 생물로서의 장점을 가지고 있어 해양 오염물질에 대한 생태독성학적 연구에 이용되고 있다(Marcial and Hagiwara, 2007; Kim et al., 2018; Bae et al., 2018; Won et al., 2021; Yoo et al., 2021). 우리의 기존 연구를 통해 ecdysteroid signaling pathway에 관여하는 유전자의 발현이 비스페놀 구조 유사체에 노출 시 노출 농도에 따라 변화함으로써 성장, 발생 및 생식에 영향을 미칠 수 있음을 제시한 바 있다(In et al., 2019, 2020, 2021).
본 연구에서는 기수산 물벼룩의 ecdysteroid 합성(nvd, cyp314a1), receptors (EcRA, EcRB, USP, ERR), 하위 경로 유전자들(E75, HR3, Vtg, VtgR)에 대해 비스페놀 구조 유사체(BPA, BPF, BPS) 노출에 따른 시간 의존적 발현 변화를 조사하고자 하였다. 이는 비스페놀 구조 유사체가 탈피 경로를 통해 성장, 발생 및 생식에 미치는 영향에 대해 분자적 수준에서 이해하는데 도움이 될 것이다.
재료 및 방법
1. 시험 생물 배양
기수산 물벼룩 Diaphanosoma celebensis는 한국해양과학기술원(KIOST) 이균우 박사에게 분양 받아, 상명대학교 융합공과대학 생명공학과 분자독성학 실험실에서 배양하고 있는 것을 사용하였다. 생물은 해수염(Instant ocean, France)을 15 psu로 제조하여 0.2 μm 필터로 여과 후 사용하였고, 배양 온도는 25±1℃, 광주기는 L : D 12시간 : 12시간 조건으로 배양하였다. Chlorella vulgaris를 먹이로 주었고, 매일 4.0 - 4.5 × 108 cells/l씩 제공하였다.
2. 비스페놀 구조 유사체 노출 시험
비스페놀 구조 유사체인 BPA (2,2-Bis(4-hydroxyphenyl)propane), BPF (4,4'-Methylenediphenol), BPS (4,4'-Sulfonyldiphenol)를 포함한 모든 시약은 특별한 언급이 없는 한 Sigma-Aldrich Co. (St. Louis, Mo, USA)으로부터 구매하여 사용하였다. 각 물질의 stock solution은 BPA의 경우 6 mg/ml, BPF 10 mg/ml, BPS 23 mg/ml가 되도록 dimethyl sulfoxide (DMSO)에 녹여서 준비하였다. 유전자 발현 실험을 위해 BPA (3 mg/l), BPF (5 mg/l), BPS (23 mg/l)를 D. celebensis (농도 당 200 개체/ 200 ml) 4일 개체에 0, 6, 12, 24시간 노출시켰다. 노출 농도는 기존의 급성독성시험을 통해 얻은 24 h-LC50 값을 토대로 아치사 농도에서 결정하였다(In et al., 2019). 최종 DMSO 농도는 0.05%는 넘지 않았고, 시험물질에 노출하는 동안 죽은 개체는 발견되지 않았다. 노출 기간 동안 먹이나 새로운 배지는 공급되지 않았으며, 모두 실험은 3반복으로 수행되었다.
3. Total RNA 추출 및 cDNA 합성
시험물질에 노출된 생물을 eppendorf tube에 모은 후 5배 용량의 TRIzol reagent (Thermo Fisher Scientific Inc., USA)를 넣어 균질화 하였다. Total RNA 추출 후 1% agarose gel electrophoresis와 Nano drop (Maestrogen, Taiwan)을 이용 정성 및 정량 분석을 하였다. Total RNA 500 ng을 cDNA 합성에 사용하였으며, cDNA 합성은 ReverTra Ace® qPCR RT Master Mix (Toyobo Corp. Ltd, Japan)를 사용하였고, 제조자 방법에 따라 합성하였다.
4. Quantitative real-time reverse transcription-polymerase chain reaction (qRT-PCR)
PCR 반응을 위해 1/10으로 희석한 cDNA 2 μl와 10 pmol의 primer mixture 2 μl를 혼합하여 사용하였으며, PCR 조건은 95℃/10 min; 40 cycles of 95℃/15s, 60℃/1 min로 수행하였다. 반응이 끝난 후 타겟 산물의 증폭을 확인하기 위하여 60℃부터 95℃까지 1초마다 0.5℃씩 증가하여 반응시킨 후 melting curve를 확인하였다. PCR 반응은 SYBR master mix (KAPA Bioassay system, USA)를 사용하였고, SYBR green으로 표지 된 산물의 증폭 여부는 CFX96TM real-time PCR system (Bio-Rad Inc., USA)을 통해 확인하였다. 각 유전자 발현 결과를 normalization하기 위하여 18S rRNA를 reference gene으로 이용하였다. 각 유전자 별로 측정된 Ct (threshold cycle) 값을 이용하여 2-△△Ct 방법에 따라 fold-change 값을 분석하여 상대적인 유전자 발현 정도를 계산하였다. 각 유전자의 primer 정보는 In 등 (2019, 2020, 2021)을 참조하였다.
5. 통계 분석
모든 실험은 3반복으로 진행하였으며, 수치는 평균 ± 표준편차(Mean ± S.D.) 값으로 표시하였다. 유전자 발현의 통계 분석은 일원배치 분산분석(One-way ANOVA)으로 분석하였고, 분석 프로그램은 IBM SPSS statistics 21 (SPSS Inc, USA)를 사용하였다. 그래프 작성은 sigmaPlot 12.0을 사용하였다. p 값이 0.05 이하일 때 통계적으로 유의한 것으로 판단하였다.
결과 및 고찰
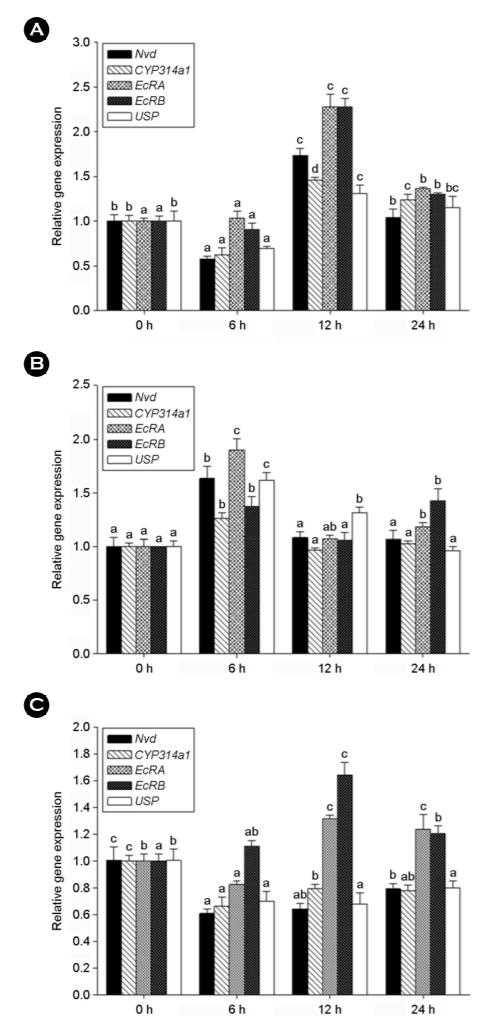
1. Ecdysteroid 합성 및 조절에 관여하는 유전자의 발현 양상
갑각류에서 ecdysteroid는 탈피 호르몬으로 성장, 발생, 생식에 중요한 역할을 하는 대표적인 내분비 호르몬이다. Neverland는 콜레스테롤을 7-dehydro cholesterol로 바꾸는 ecdysteroid 생합성의 첫 번째 단계에 참여하는 유전자로 알려져 있다(Sumiya et al., 2014), RNAi 기술을 이용하여 neverland를 knockdown 시키면 ecdysteroid의 titre가 감소하면서 molting이 억제됨으로써 발생이 지연된다고 보고된 바 있다(Sumiya et al., 2016). In 등 (2021)의 연구 결과에 따르면, ecdysteroid 생합성에 관여하는 nvd 유전자의 발현은 bisphenol 류에 48시간 노출시켰을 때 고농도에서는 모두 감소하는 양상을 보였다. 노출 시간에 따른 양상을 분석한 본 연구 결과에서는 nvd 유전자 발현은 BPA 노출 시 12시간에서 가장 높았으며(Fig. 1A), BPF에서는 6시간째에 가장 높게 나타났다(Fig. 1B). 반면 BPS의 경우 24시간 동안 대조군 대비 감소된 양상을 보였다(Fig. 1C). Nvd 유전자 발현에 대한 비교할 만한 연구 결과가 부족함에도 불구하고 본 연구 결과는 비스페놀류에 노출 시 이들 유전자의 발현 변화는 ecdysteroid 생합성에 서로 다른 방식으로 영향을 미칠 수 있음을 제시한다.
Ecdysone은 cyp314a1에 의해 활성을 갖는 ecdysteroid인 20-HE로 전환되어, nuclear receptor family에 속하는 EcR과 USP의 hete- rodimer와 결합하여 유전체 상에서 ecdysone response element (EcRE) 부위에 결합하게 된다(Yao et al., 1993; Zhu et al., 2006). Chironomus riparius (Planelló et al., 2008; Nair and Choi, 2012; Morales et al., 2014), Gammarus pulex (Gismondi, 2018), Tigriopus japonicus (Hwang et al., 2016), D. celebensis (In et al., 2019) 등에서 ecdysteroid 경로에 관여하는 cyp314a1, EcR, USP 유전자의 발현이 여러 내분비계 장애물질들에 노출되었을 때 조절된다는 보고된 바 있다. BPA에 노출된 이들 유전자들은 노출된 지 12시간 째에 가장 높은 발현양을 보였다(Fig. 1A). Cyp314a의 경우에 BPA나 BPF와 달리 BPS의 경우 cyp314a1의 발현이 24시간 동안 오히려 감소하는 양상을 보였다. 이는 BPF는 BPA보다는 낮지만 유사한 에스트로겐 활성을 가지며, BPS는 오히려 항안드로겐 활성을 갖는다는 보고와 관련되어 있는 것으로 보인다(Rochester and Bolden, 2015).
특히 BPA 노출의 경우 EcRA와 EcRB 유전자들은 2배 이상의 유전자 발현 수준을 보였다(약 2.3-fold, p < 0.05). 한편 BPF에 노출된 유전자는 BPA에 노출된 경우 보다 이른 시간인 6시간에 발현양이 유의하게 증가하였다(Fig. 1B). 그러나 발현양은 BPA 보다는 낮게 나타났고, EcRs 중 EcRA가 약 2배 정도로 가장 높게 발현되었다. BPS의 경우 BPA와 유사하게 EcRA와 EcRB 유전자의 발현이 노출 12시간 째에 가장 높게 증가하였으며, EcRB가 약 1.6배 높은 발현양을 보였다(Fig. 1C). In 등 (2019)에 따르면 D. celebensis에 비스페놀류를 48시간 노출했을 때 BPA와 BPS에서는 EcRA가 더 증가한 반면, BPF에 노출했을 때는 EcRB가 더 증가하는 양상을 보였다. Drosophila melanogaster embryo와 adult 시기에서 EcR isoform의 역할과 관련해서 EcRA는 성체 분화에 관련하며, EcRB는 larval stage에서 탈피 과정을 조절한다고 알려져 있다(Talbot et al., 1993). 이러한 결과는 비스페놀류가 ecdysteroid의 운반에 관련하는 EcR isoform의 발현을 조절함으로써 하위에 있는 ecdysteroid-responsive genes의 전사 조절에 영향을 미칠 수 있음을 의미한다. 뿐만 아니라 비스페놀류의 종류에 따라 EcR isoform의 발현이 서로 다르게 조절되는 것은 이들 물질이 서로 다른 기전에 의해 D.celebensis의 분화 및 탈피에 영향을 미칠 수 있음을 제시한다. 한편 Ecdysteroid의 운반에 EcR isoforms와 heterodimer를 형성하는 USP의 발현은 BPA와 BPF에 노출했을 때는 EcR isoforms의 발현 패턴과 유사한 노출 시간에 가장 높은 발현 변화를 보였다(Fig. 1A, B). 한편 BPS에 대해서는 24시간 이내에서 크게 발현이 증가하지 않았다(Fig. 1C). BPA 노출 시 USP 발현의 증가는 midge C. riparius에서도 보고된 바 있다(Planelló et al., 2008). BPS 노출에서 USP 유전자 발현의 감소는 이전 실험의 48시간 노출에서도 일관되게 나타나는 결과(In et al., 2019)로 BPA와는 다른 작용 기전을 갖는 것으로 보인다.
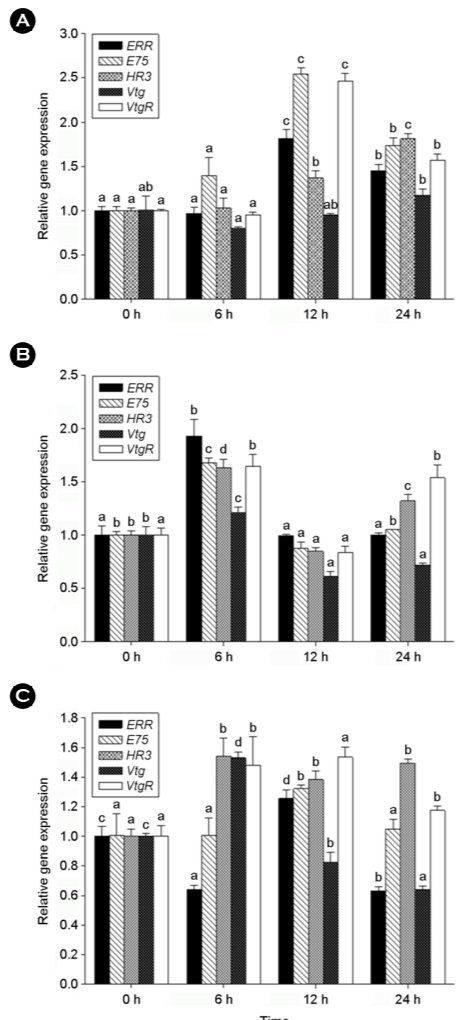
2. Ecdysteroid에 의해 조절되는 유전자의 발현 양상
Ecdysteroid에 의해 조절되는 하위 유전자들 중 early response gene인 E75와 HR3, late response gene인 Vtg와 VtgR 유전자의 발현양상을 조사하였다. 추가로 아직 그 기능이 정확하지 않지만 vitellogenesis와 관련되어 있다고 알려져 있는 ERR 유전자의 발현 양상도 함께 조사하였다. Fig. 2A에서 보는 바와 같이 ERR 유전자 발현의 증가가 BPA 노출 12시간과 24시간에서 확인되었다. E75와 VtgR 유전자의 발현은 BPA 노출 12시간째에 모두 2.5배 이상 증가하였다. HR3와 Vtg의 발현 양상은 24시간에 가장 높게 증가하였다. 한편, BPF 노출 후 ERR 유전자의 발현은 6시간째에 가장 높게(약 2배, p < 0.05) 발현하였고, 그 외 유전자들도 모두 6시간째에 가장 높은 발현양을 보였다(Fig. 2B). BPS의 경우 E75는 12시간째 가장 높게 발현하였으나, HR3는 6시간째에 가장 높게 발현하였다(Fig. 2C). Vtg 유전자 발현양은 BPS를 제외하고는 통계적으로 유의하기는 하지만 전체적으로 크게 증가하지 않은 반면, VtgR 유전자의 발현양은 모든 노출군에서 시간의 차이는 있지만 증가하는 양상을 보였다.
HR3와 E75는 ecdysteroid에 의해 조절되는 하위 유전자이며, Daphnia magna에서 HR3 유전자의 발현은 20HE에 의해 증가한 반면, E75는 반응을 보이지 않았다고 보고된 바 있다(Hannas and LeBlanc, 2010). 특히 HR3는 vitellogenin과 chitin 생합성 과정과 관련된 유전자의 발현을 자극하는 역할을 하며, E75는 HR3를 억제하는 역할을 함으로써 이들의 상호작용은 탈피 뿐 아니라 발생과 변태과정에 영향을 미친다(Hannas and LeBlanc, 2010). 따라서 본 연구에서 E75와 HR3의 서로 다른 발현 양상은 이러한 상호작용을 반영하는 것으로 보인다. Vitellogenin은 난 발생 생물에서 yolk protein인 vitellin의 전구체이며, vitellogenin receptor (VtgR)을 통해 oocyte로 전달되기 때문에 생식과 발생에 중요한 역할을 한다(Hayward et al., 2010; Roth and Khalaila, 2012). 특히 vitellogenin의 발현은 ER을 통해 조절되기 때문에 내분비계 장애물질의 발생 독성을 스크린 하기는 적합한 바이오마커로 알려져 있다(Zhong et al., 2014). 담수산 물벼룩인 Daphnia에서도 BPA와 NP에 노출되었을 때 Vtg 유전자의 발현이 높게 증가한다는 보고가 있다(Hannas et al., 2011). 본 연구에서 VtgR의 발현이 증가한 반면 Vtg의 발현은 큰 변화를 보이지 않은 것에 대해 24시간 이내에는 영향이 미비한 것으로 보인다. In 등 (20201)의 결과에서 D. celebensis에 비스페놀류를 48시간 처리 시 Vtg의 발현양이 크게 증가한 바 있어 24시간 노출에서 VtgR의 발현량 증가가 48시간에서 Vtg의 발현을 유도하는데 관여했을 것으로 추정할 수 있다.
절지동물에서 ER의 존재는 알려져 있지 않고, 대신 estrogen-related receptor (ERR)가 보고되어 있다(Bardet et al., 2006). ERR의 역할과 관련해서는 gametogenesis를 조절할 수 있으며(Nagasawa et al., 2015), ecdysteroid 매개 경로에 관여하여 gonad develop- ment를 조절할 수 있다고 알려져 있다(Jin et al., 2017). 그러나 ERR와 estrogenic compounds의 결합능력에 대해서는 의견이 분분하다. Mytilus를 이용한 실험에서는 ERR이 17β-estradiol에 반응하지 않았으나(Nagasawa et al., 2015), C. riparius에서는 BPS (Herrero et al., 2018)와 BPA, 4-nonylphenol, di(2-ethylhexyl)phthalate 등(Park and Kwak, 2010)에 노출되었을 때 ERR 유전자의 발현이 증가하였다는 보고가 있다. 갑각류에서 다양한 내분비계 장애물질에 대한 ERR 유전자의 발현과 역할은 아직 잘 알려져 있지 않음에도 불구하고, 본 연구 결과와 함께 ERR은 내분비계 장애물질에 의해 발현이 조절될 수 있어 잠재적인 타겟 분자가 될 수 있음을 의미한다.
결과적으로 본 연구에서는 갑각류의 탈피, 성장, 생식 및 발생에 관여하는 ecdysteroid pathway와 관련하여 D. celebensis에서 ecdysteroid 생합성에 관여하는 2개의 유전자 및 ecdysteroid 매개 경로에 있는 8개의 유전자에 대해 3종의 비스페놀 구조 유사체 노출 시간에 따른 유전자 발현 양상을 분석하였다. 분석한 유전자 발현 양상이 비스페놀 구조 유사체 노출 시간에 따라 의존적인 경향을 보이지는 않았지만, 종류에 따라 서로 다른 패턴을 보인 것으로 보아 BPS와 BPF도 BPA와는 서로 다른 기전으로 기수산 물벼룩의 내분비계를 교란시킬 수 있는 능력을 갖는 것으로 보인다. 또한 본 연구에서 분석한 ecdysteroid 합성 및 하위 유전자들이 관여하는 경로가 내분비계 장애물질의 잠재적 타겟 분자가 될 수 있음을 보였다. 추가로 ecdysteroid pathway 관련 유전자들의 발현 양상이 노출 시간에 따라 다르게 나타나기 때문에 실험 디자인 시 적절한 노출 시간을 설정하거나 다양한 노출 시간 별 변화를 조사할 필요가 있다. 향후 BP 구조 유사체가 생물에 미치는 노출 농도를 정확하게 이해하기 위하여 해수 내 및 생물 중 농도 측정에 대한 추가 연구가 필요하다.
- References
-
1. Andersen HR, Wollenberger L, Halling-Sorensen B, Kusk KO. 2001. Development of copepod nauplii to copepodites - a par- ameter for chronic toxicity including endocrine disruption. Environ Toxicol Chem 20: 2821-2829.
-
2. Bae C, Kim RO, Kim JS, Lee YM. 2018. Acute Toxicity and Modulation of an Antioxidant Defence System in the Brackish Water Flea Diaphanosoma celebensis Exposed to Cadmium and Copper. Toxicol Environ Health Sci 10: 186-193.
-
3. Bardet PL, Laudet V, Vanacker JM. 2006. Studying non-mammalian models? Not a fool's ERRand! Trends Endocrinol Metab 17: 166-171.
-
4. Beausoleil C, Emond C, Cravedi JP, Antignac JP, Applanat M, Appenzeller BMR, Beaudouin R, Belzunces LP, Canivenc-Lavier MC, Chevalier N, Chevrier C, Elefant E, Eustache F, Habert R, Kolf-Clauw M, Le Magueresse-Battistoni B, Mhaouty-Kodja S, Minier C, Multigner L, Schroeder H, Thonneau P, Viguié C, Pouzaud F, Ormsby JN, Rousselle C, Verines-Jouin L, Pasquier E, Michel C. 2018. Regulatory identification of BPA as an endocrine disruptor: Context and methodology. Mol Cell Endocrinol 475: 4-9.
-
5. Cabaton N, Dumont C, Severin I, Perdu E, Zalko D, Cherkaoui-Malki M, Chagnon MC. 2009. Genotoxic and endocrine activities of bis(hydroxyphenyl)methane (bisphenol F) and its derivatives in the HepG2 cell line. Toxicology 255: 15-24.
-
6. Canesi L, Fabbri E. 2015. Environmental effects of BPA: Focus on aquatic species. Dose Response 13: 1-14.
-
7. Chen D, Kannan K, Tan H, Zheng Z, Feng YL, Wu Y, Widelka M. 2016. Bisphenol analogues other than BPA: Environmental occurrence, human exposure, and toxicity - A review. Environ Sci Technol 50: 5438-5453.
-
8. Ghekiere A, Verslycke T, Janssen C. 2006. Effects of methoprene, nonylphenol, and estrone on the vitellogenesis of the mysid Neomysis integer. Gen Comp Endocrinol 147: 190-195.
-
9. Gismondi E. 2018. Identification of molt-inhibiting hormone and ecdysteroid receptor cDNA sequences in Gammarus pulex, and variations after endocrine disruptor exposures. Ecotoxicol Environ Saf 158: 9-17.
-
10. Hannas BR, LeBlanc GA. 2010. Expression and ecdysteroid re- sponsiveness of the nuclear receptors HR3 and E75 in the crustacean Daphnia magna. Mol Cell Endocrinol 315: 208-218.
-
11. Hannas BR, Wang YH, Thomson S, Kwon G, Li H, LeBlanc GA. 2011. Regulation and dysregulation of vitellogenin mRNA accumulation in daphnids (Daphnia magna). Aquat Toxicol 101: 351-357.
-
12. Hayward A, Takahashi T, Bendena WG, Tobe SS, Hui JHL. 2010. Comparative genomic and phylogenetic analysis of vitello- genin and other large lipid transfer proteins in metazoans. FEBS Letters 584: 1273-1278.
-
13. Herrero O, Aquilino M, Scanchez-Arguello P, Planello R. 2018. The BPA-substitute bisphenol S alters the transcription of genes related to endocrine, stress response and biotrans- formation pathways in the aquatic midge Chironomus riparius (Diptera, Chironomidae). PLOS ONE 13: e0193387. https:// doi.org/10.1371/journal.pone.0193387.
-
14. Hwang DS, Han J, Won EJ, Kim DK, Jeong CB, Hwang UK, Zhou B, Choe J, Lee JS. 2016. BDE-47 causes developmental retar- dation with downregulated expression profiles of ecdysteroid signaling pathway-involved nuclear receptor (NR) genes in the copepod Tigriopus japonicus. Aquat Toxicol 177: 285-294.
-
15. In S, Cho H, Lee KW, Won EJ, Lee YM. 2020. Cloning and molec- ular characterization of estrogen-related receptor (ERR) and vitellogenin genes in the brackish water flea Diaphanosoma celebensis exposed to bisphenol A and its structural ana- logues. Mar Pollut Bullet 154: 111063.
-
16. In S, Cho H, Lee YM. 2021. Identification of ecdysteroid pathway-related genes and their transcriptional modulation in the brackish water flea Diaphanosoma celebensis exposed to bisphenol analogs. Toxicol Environ Health Sci 13: 261-268.
-
17. In S, Yoon HW, Yoo JW, Cho H, Kim RO, Lee YM. 2019. Acute toxicity of bisphenol A and its structural analogues and transcriptional modulation of the ecdysone-mediated path- way in the brackish water flea Diaphanosoma celebensis. Ecotoxicol Environ Saf 179: 310-317.
-
18. Jin W, Jia Y, Tan E, Xi G. 2017. Relevance of estrogen-related receptor gene and ecdysone receptor gene in adult testis of the cricket Teleogryllus emma (Orthoptera: Gryllidae). Sci Nat 104: 97.
-
19. Kim BM, Kang S, Kim RO, Jung JH, Lee KW, Rhee JS, Lee YM. 2018. De novo transcriptome assembly of brackish water flea Diaphanosoma celebensis based on short-term cadmium and benzo[a]pyrene exposure experiments. Hereditas 155: 36.
-
20. Lafont R, Dauphin-Villemant C, Warren JT, Rees H. 2005. Ecdy- steroid chemistry and biochemistry. In: Gilbert LI, Iatrou K, Gill S. (Eds.), Comprehensive Molecular Insect Science, vol. 3. Elsevier, Oxford, pp 125-195.
-
-
22. Laudet V. 1997. Evolution of the nuclear receptor superfamily: early diversification from an ancestral orphan receptor. J Mol Endocrinol 19: 207-226.
-
23. Liao C, Liu F, Moon H-B, Yamashita N, Yun S, Kannan K. 2012. Bisphenol analogues in sediments from industrialized areas in the United States, Japan, and Korea: spatial and temporal distributions. Environ Sci Technol 46: 11558-11565.
-
24. Marcial HS, Hagiwara A. 2007. Multigenerational effects of 17b-estradiol and nonylphenol on euryhaline cladoceran Diaphanosoma celebensis. Fish Sci 73: 324-330.
-
25. Miyakawa H, Sato T, Song Y, Tollefsen KE, Iguchi T. 2018. Ecdy- steroid and juvenile hormone biosynthesis, receptors and their signaling in the freshwater microcrustacean Daphnia. J Steroid Biochem Mol Biol 184: 62-68.
-
26. Morales M, Martínez-Paz P, Martin R, Planello R, Urien J, Martinez-Guitarte JL, Morcillo G. 2014. Transcriptional changes in- duced by in vivo exposure to pentachlorophenol (PCP) in Chironomus riparius (Diptera) aquatic larvae. Aquat Toxicol 157: 1-9.
-
27. Naderi M, Wong MY, Gholami F. 2014. Developmental exposure of zebrafish (Danio rerio) to bisphenol-S impairs subsequent reproduction potential and hormonal balance in adults. Aquat Toxicol 148: 195-203.
-
28. Nagasawa K, Treen N, Kondo R, Otoki Y, Itoh N, Rotchell JM, Osada M. 2015. Molecular characterization of an estrogen receptor and estrogen-related receptor and their autoregulatory cap- abilities in two Mytilus species. Gene 564: 153-159.
-
29. Nair PMG, Choi J. 2012. Modulation in the mRNA expression of ecdysone receptor gene in aquatic midge, Chironomus riparius upon exposure to nonylphenol and silver nano- particles. Environ Toxicol Pharmacol 33: 98-106.
-
30. Nakagawa Y, Henrich VC. 2009. Arthropod nuclear receptors and their role in molting. FEBS J 276: 6128-6157.
-
31. Park K, Kwak I-S. 2010. Molecular effects of endocrine-disrupting chemicals on the Chironomus riparius estrogen-related re- ceptor gene. Chemosphere 79: 934-941.
-
32. Planelló R, Martínez-Guitarte JL, Morcillo G. 2008. The endocrine disruptor bisphenol A increases the expression of HSP70 and ecdysone receptor genes in the aquatic larvae of Chironomus riparius. Chemosphere 71: 1870-1876.
-
33. Rochester JR, Bolden AL. 2015. Bisphenol S and F: A systematic review and comparison of the hormonal activity of bisphenol A substitutes. Environ Health Perspect 123: 643-650.
-
34. Roth Z, Khalaila I. 2012. Identification and characterization of the vitellogenin receptor in Macrobrachium rosenbergii and its expression during vitellogenesis. Mol Reprod Dev 79: 478-487.
-
35. Segner H, Caroll K, Genske M, Janssen CR, Maack G, Pascoe D, Schäfers C, Vandenbergh GF, Watts M, Wenzel A. 2003. Identification of endocrine-disrupting effects in aquatic verte- brates and invertebrates: report from the European IDEA project. Ecotoxicol Environ Saf 54: 302-314.
-
36. Sumiya E, Ogino Y, Miyakawa H, Hiruta C, Toyota K, Miyagawa S, Iguchi T. 2014. Roles of ecdysteroids for progression of reproductive cycle in the fresh water crustacean Daphnia magna. Front Zool 11: 60.
-
37. Sumiya E, Ogino Y, Toyota K, Miyakawa H, Miyagawa S, Iguchi T. 2016. Neverland regulates embryonic moltings through the regulation of ecdysteroid synthesis in the water flea Daphnia magna, and may thus act as a target for chemical disruption of molting. J Appl Toxicol 36: 1476-1485.
-
38. Talbot WS, Swyryd EA, Hogness DS. 1993. Drosophila tissues with different metamorphic responses to ecdysone express different ecdysone receptor isoforms. Cell 73: 1323-1337.
-
39. Won EJ, Kim D, Yoo JW, In S, Shin KH, Lee YM. 2021. Oxidative stress responses in brackish water flea exposed to microcystin-LR and algal bloom waters from Nakdong River, Republic of Korea. Mar Pollut Bull 162: 111868.
-
40. Yao TP, Forman BM, Jiang Z, Cherbas L, Chen JD, McKeown M, Cherbas P, Evans RM. 1993. Functional ecdysone receptor is the product of EcR and Ultraspiracle genes. Nature 366: 476-479.
-
41. Yoo JW, Cho H, Lee KW, Won EJ, Lee YM. 2021. Combined effects of heavy metals (Cd, As, and Pb): Comparative study using conceptual models and the antioxidant responses in the brackish water flea. Comp Biochem Physiol Part C 239: 108863.
-
42. Zhong L, Yuan L, Rao Y, Li Z, Zhang X, Liao T, Xu Y, Dai H. 2014. Distribution of vitellogenin in zebrafish (Danio rerio) tissues for biomarker analysis. Aquat Toxicol 149: 1-7.
-
43. Zhu J, Chen L, Sun G, Raikhel AS. 2006. The competence factor βFtz-F1 potentiates ecdysone receptor activity via recruiting a p160/SRC coactivator. Mol Cell Biol 26: 9402-9412.












