JMLS 2021 December;6(2):58-65. 10.23005/ksmls.2021.6.2.58 Epub 2021 December 15
Copyright © 2021 by The Korean Society of Marine Life Science
Effect of Halophyte (Spartina anglica and Calystegia soldanella) Extracts on Skin Moisturizing and Barrier Function in HaCaT Cells
Yuna Ha; Research Institute of Basic Sciences, Incheon National University, Incheon 22012, Korea
JaeWoo Jeong; Inkos Co., Ltd., Incheon 21633, Korea
Won Hwi Lee; Research Institute of Basic Sciences, Incheon National University, Incheon 22012, Korea; Department of Marine Sciences, Incheon National University, Incheon 22012, Korea
Jun Hyuk Oh; Department of Marine Sciences, Incheon National University, Incheon 22012, Korea
Youn-Jung Kim; Research Institute of Basic Sciences, Incheon National University, Incheon 22012, Korea; Department of Marine Sciences, Incheon National University, Incheon 22012, Korea
- Abstract
노화가 진행될수록 활성산소종으로 인하여 피부 보습은 떨어지고 피부 장벽은 붕괴되어 피부가 손상된다. 본 연구에서는 인천 동막 해변에 서식하는 염생식물인 갯끈풀(Spartina anglica; SAE)과 갯메꽃(Calystegia soldanella; CSE)을 70% 에탄올(EtOH)로 추출하여 피부 보습 및 피부 장벽 기능 강화에 대한 효능을 평가하였다. 이 추출물들에 대한 피부 각질형성세포(HaCaT cell)에서 세포독성을 WST-8 assay를 이용하여, 세포 생존율이 90% 이상을 보이는 농도를 선별하여 추가 실험을 진행하였다. ABTS 라디칼 소거능을 통해 항산화 효과를 확인한 결과, SAE와 CSE는 높은 라디칼 소거능을 보였다. 피부 보습과 관련된 인자들인 filaggrin (FGL), aquaporin 3 (AQP3), hyaluronan synthase 2 (HAS2)과 피부 장벽 기능과 연관 있는 transglutaminase 1 (TGM1)과 involucrin (INV)의 유전자 수준에서의 발현 변화를 측정한 결과, SAE에 의해 AQP3, HAS2, TGM1의 발현이 증가하였으나, CSE는 변화가 없는 것을 확인할 수 있었다. SAE에 의한 세포 내 신호전달 경로를 확인하기 위해 western blot 분석을 수행하였다. Extracellular signal regulated kinase (ERK), c-Jun N-terminal kinase (JNK) and p38 mitogen activated protein kinase의 활성이 SAE에 의하여 상향 조절되었음을 확인하였다. 이러한 결과는 갯끈풀 추출물이 피부 보습 및 피부 장벽 기능 강화를 위한 화장품의 기능성 소재로 사용될 수 있음을 시사한다.
As aging progresses, reactive oxygen species (ROS) reduces skin moisturization and collapses skin barrier function. In this study, we evaluated the efficacy of skin moisturizing and skin barrier function enhancement by extracts from halophytes using HaCaT cells. Spartina anglica (S. anglica; SAE) and Calystegia soldanella (C. soldanella; CSE), a kind of halophytes, were collected from Dongmak beach in Incheon, and extracted with 70% ethanol. At the first, we evaluated the cytotoxicity of extracts in HaCaT cell using WST-8 Kit. As a result, the other experiment was conducted by setting the concentration at which the cell viability was 90% or more. SAE and CSE showed high radical scavenging activity through ABTS assay. Expression levels of genes related to skin moisturizing and skin barrier functions, were analyzed by real-time qPCR. As a result, it showed that the expression of aquaporin 3, hyaluronan synthase 2, and transglutaminase 1 was increased by SAE treatment but not changed by CSE. Activation of extracellular signal regulated kinase (ERK), c-Jun N-terminal kinase (JNK), and p38 mitogen activated protein kinase was induced by SAE. These results suggest that SAE can be used as functional materials for cosmetics for skin moisturizing and barrier function enhancement.
Keywords: Halophytes(염생식물) Spartina anglica(갯끈풀) HaCaT cell(피부각질세포) Skin moisturization(피부 보습) Skin barrier function(피부장벽기능)
Correspondence to: Youn-Jung Kim; Department of Marine Sciences, Incheon National University, Incheon 22012, Korea
- Received
- 15 October 2021;
- Revised
- 19 October 2021;
- Accepted
- 27 October 2021.
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Language: Korean/English,
Full Text:

서 론
연안지역에 분포하는 탄소, 즉 블루카본(Blue Carbon)이 기후 변화에 대안책으로 중요한 역할을 한다는 많은 연구 결과들이 최근 발표되고 있다(Lee, 2020). 하지만, 우리 나라의 경우 블루카본을 가장 많이 포집하고 있다고 알려진 맹그로브 숲은 지형적인 특징으로 인하여 거의 존재하지 않기 때문에 해조류와 염생식물 등이 중요한 블루카본 바이오매스 자원으로 주목받고 있다. 염생식물(halophyte)이란 염전, 바닷가 등과 같은 주위에 염기가 있는 염습지에 서식하는 식물을 일컫는다(Shin et al., 2019). 염생식물의 종류는 갯끈풀, 지채, 갯메꽃, 갯질경, 순비기나무 등이 있고(Shin et al., 2019), 기존 문헌들에 의하면 염생식물 추출물들의 피부 생리활성 평가에서 항염증(Kim et al., 2009), 항산화(Ravikumar et al., 2011) 그리고 미백(Kim et al., 2017) 등의 효과들이 있다고 알려져 있다. 하지만, 다른 식물 종에 비해 연구 결과가 적고, 특히, 보습 및 피부 장벽 기능 강화에 관한 생리활성 평가에 대한 연구는 미비한 실정이다. 따라서, 본 연구에서는 염생식물 중에서 갯끈풀(Spartina anglica, S. anglica)과 갯메꽃(Calystegia soldanella, C. soldanella)을 선정하여 피부 보습 및 장벽기능 강화에 미치는 영향에 대한 연구를 수행하였다. 이 중 갯끈풀(S. anglica)은 벼목, 벼과의 식물이고 유럽, 아프리카 대륙이 원산지인 외래종으로써 갯벌에 서식한다고 알려져 있으며(Yoon and Yoon, 2016), 현재 우리나라에서는 생태계 교란종으로 지정되어 갯벌에 서식하여 기존 자생식물들을 밀어내고, 해양생물들의 서식처를 파괴시킨다고 알려져 있다. 갯메꽃(C. soldanella)은 원 산지가 한국이고 바닷가 근처 모래 언덕에 자라는 덩굴성 여러해 살이풀이고 줄기가 땅 위를 기거나 다른 물체를 감고 올라가는 특징이 있으며(Treeinfo), 항염, 항암 등의 효과도 있는 것으로 알려져 있다(Kim et al., 2004; Son et al., 2018). 본 연구를 통하여 갯끈풀과 같이 생태계 교란종으로 알려진 염생식물의 소재화 가능성을 입증한다면 사회적인 비용 및 환경문제와 생태계 파괴문제를 동시에 해결할 수 있을 것으로 기대된다.
피부의 역할은 외부로부터 들어온 항원과 감염원의 침입을 막아주고 물리적인 요인으로부터 신체를 보호하며, 체온조절, 비타민의 합성 및 자극을 감지하는 역할을 하고 있으며, 무엇보다도 중요한 역할은 신체는 약 80%의 물로 구성되어 있는데 그 수분을 건조한 외부환경으로부터 안전하게 지켜주는 것이다(Youm, 2013). 따라서, 본 연구의 목적은 인체의 가장 최전방에서 신체를 보호하고 있는 피부 보습과 장벽 기능에 대한 염생식물이 미치는 영향에 대한 가능성을 입증하고 블루카본 바이오매스 소재의 고부가가치를 창출하고자 함에 있다.
재료 및 방법
1. 세포 배양
본 실험에서는 각질형성세포인 HaCaT 세포를 American Type Culture Collection (ATCC, USA)에서 구입하여 사용하였다. HaCaT 세포의 배양은 10% heat-inactivated fetal bovine serum (FBS, Youngin frontier, Korea)과 1% penicillin-streptomycin (Gibco, USA)을 첨가한 DMEM (Dulbecco's modified Eagle's medium, Gibco) 배지를 사용하였다. 해당 세포는 37℃ 온도와 5% CO2 조건으로 배양하였다.
2. 시료 제조
염생식물 갯끈풀(S. anglica)과 갯메꽃(C. soldanella)은 인천광역시 강화도 동막 해변에서 2018년 06월 채집하였다. 채집한 염생식물은 염분 제거를 위해 약 30회 이상 수돗물로 세척한 다음 증류수로 헹구어 24시간 동안 45℃ 드라이 오븐에서 건조시킨 후 분쇄하였다. 파우더는 70% 에탄올(EtOH)에 48시간 상온에서 침지 추출을 진행하였고, filter paper (Whatman No. 2, UK)로 여과를 진행한 후 감압 농축하였다. 제조된 갯끈풀(S. anglica extract, SAE)와 갯메꽃(C. soldanella extract, CSE) 추출물은 동결건조하여 dimethyl sulfoxide (DMSO, Duksan science, Korea)에 녹여 실험에 사용하였다.
3. ABTS radical 소거 활성 측정법
2,2'-azino-bis (3-ethylbenzothiazoline-6-sulfonic acid) (ABTS) radical 소거 활성 측정은 Re 등의 방법을 변형하여 측정하였다(Re et al., 1999). Radical을 형성하도록 감광하여 실온에서 16시간 반응시켜 9 mM potassium persulfate (Sigma Aldrich, USA)에 용해시킨 14 mM ABTS 용액을 제조하였다. ABTS 용액을 190 μl와 200, 1,000, 2,000 그리고 4,000 μg/ml 농도의 SAE와 CSE를 10 μl씩 혼합하여 암실에서 20분 동안 반응시킨 후 microplate reader를 이용하여 734 nm에서 흡광도를 측정하여 ABTS radical 소거 활성을 확인하였다. 양성 대조군(Positive control)로 5 μg/ml의 농도인 L-ascorbic acid (Sigma Aldrich, USA)를 사용하였다. ABTS radical 소거 활성은 다음 식에 따라 계산하였다. A (control)은 대조군, A (sample)은 시료의 처리군이다.
ABTS radical scavenging activity (%) = (A(control)-A(sample))/A(control) x 100
4. 세포 독성 평가
SAE와 CSE에 대한 세포 생존율을 WST-8 cell viability assay kit (Precaregene Co., Korea)을 이용하여 측정하였다. HaCaT 세포를 15×103 cells/well의 밀도로 96 well plate에 분주한 후 24시간 동안 5% CO2, 37℃ 조건에서 부착시켰다. Serum-free DMEM medium을 이용하여 SAE와 CSE를 24시간 처리한 다음 100 μl의 WST-8 시약을 첨가하여 2시간 동안 5% CO2, 37℃ 조건에서 배양하였다. 그 다음 microplate reader를 이용하여 450 nm에서 흡광도를 측정하였다. 세포 활성 측정은 시료 처리군과 대조군의 흡광도 차이를 백분율(%)로 나타냈다.
5. RNA 추출 및 Real time qPCRPCR
피부 보습과 장벽 강화에 관여하는 유전자들의 발현 변화를 확인하기 위하여 real time qPCR을 수행하였다. 이들 유전자들에 대한 primer 서열 정보는 Table 1에 나타내었다. HaCaT 세포를 7×105 cells/dish의 밀도로 60 mm plate에 분주하여 24시간 동안 5% CO2, 37℃ 조건에서 부착 및 안정화를 시킨 후, 각각 추출물들을 serum free DMEM medium에 100, 200 μg/ml 농도의 SAE와 5, 10 μg/ml 농도의 CSE를 처리하여 24시간 배양하였다. 추출물을 처리한 HaCaT 세포에서 total RNA는 TRIzol (Invitrogen Carlsbad, USA)을 이용하여 RNA를 분리하였다. ReverTra Ace® qPCR RT master mix with gDNA remover (TOYOBO, Japan)을 사용하여 RNA를 cDNA로 합성하였고, 유전자 발현을 측정하기 위하여 SYBR® qPCR Mix (Toyobo, Japan)을 사용하였다. 합성된 cDNA은 BIO-RAD CFX ConnectTM을 이용하여 95℃에서 3분 동안 heating을 하였고, 95℃에서 10초 간 denaturing을, 59℃에서 10초 동안 annealing을 72℃에서 30초의 extension을 39 Cycle 반복하였다. Cycle이 완료된 후에는 Cq 값을 분석하여 GAPDH로 상대 정량하였다.
6. Western blot analysis
배양된 세포에서 추출한 단백질 농도는 bicinchoninic acid (BCA) protein assay (Bio-Rad Laboratories)을 사용하여 정량하였다. 동일한 양(15 μl)의 각 샘플을 sodium dodecyl sulfate polyacrylamide 겔에 로딩했다. 분리 후, 단백질을 polyvinylidene fluoride (PVDF) membrane (Bio-Rad Laboratories)으로 옮기고 0.1% tween-20을 함유한 Tris-buffered saline에 2~5% bovine serum albumin (Sigma-Aldrich) 또는 5% 탈지유로 1시간 동안 블로킹하였다. PVDF mem- brane에 c-Jun N-terminal kinase (JNK1/2), phospho-JNK1/2, p38 MAPK, phospho-p38 MAPK, extracellular signal-controlled kinase (ERK1/2), phospho-ERK1/2, α-tubulin (Cell Signaling Technology Inc., Beverly, MA , USA) 1차 항체와 함께 4℃에서 하룻밤 동안 반응시켰다. 0.1% Tween-20을 함유한 Tris-buffered saline으로 3회 세척한 후, 2차 항체와 함께 3시간 동안 반응시켰다. Chemidoc XRS (Bio-Rad Laboratories)를 사용하여 표적 검출 밴드를 관찰하고 사진을 인화했다.
7. 통계 처리
본 실험은 graphpad prism 5 (Graph Pad, USA) 프로그램을 사용하여 통계 처리를 하였다. 각 반복 실험군의 측정한 항목의 결과는 평균 ± 표준편차(mean ± SD)로 표기를 하였으며, 반복 실험군 간 평균 차이를 one-way ANOVA (analysis of variance)로 확인을 한 후 그룹 간의 통계적 유의성을 Tukey's multiple comparison test를 이용하여 실시하였다.
결 과
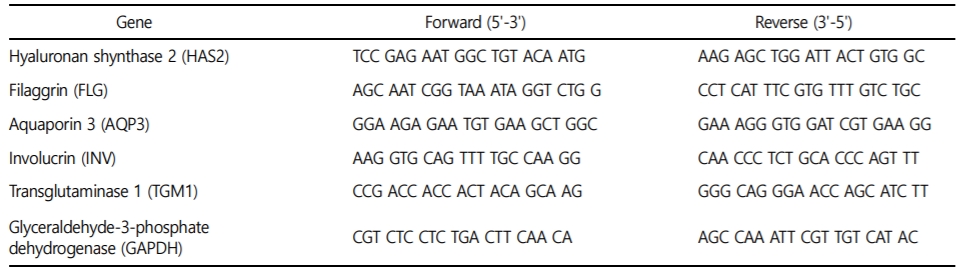
1. ABTS Radical 소거 활성 측정
SAE와 CSE의 항산화 능력을 평가하기 위해 ABTS radical 소거 활성을 측정하였다(Fig. 1). 양성 대조군은 높은 항산화 효과를 가진 L-Ascorbic acid와 비교하였는데, L-Ascorbic acid의 경우, 5 μg/ ml의 농도에서 약 94%의 소거 활성을 나타내었다. SAE의 경우에도 10~200 μg/ml 농도를 처리하였는데, 농도 의존적으로 radical 소거 활성이 높은 것으로 확인되었고 200 μg/ml에서 약 88.7%의 가장 높은 소거 활성을 보였다. CSE는 50 μg/ml의 농도에서부터 81.4% 이상의 소거 활성을 보였으므로 두 추출물 모두 농도의 의존적인 radical 소거능을 보였다.
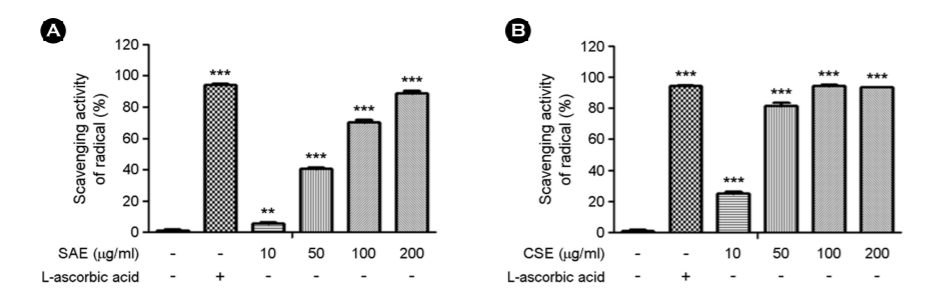
2. 세포 생존율
SAE, CSE 추출물과 피부 보습 효능 성분으로 알려진 D-panthenol이 인간의 피부에서 유래한 HaCaT 세포 생존율에 미치는 영향을 조사하였다. Serum free DMEM medium에 0.5~4%의 농도의 D-panthenol을 24시간 배양한 후 세포 생존율을 확인하였다(Fig. 2 (A)). 2% 농도에서 72.9%의 생존율을, 3% 농도에서는 41.0%의 생존율을, 그리고 4% 농도에서는 22.3%의 생존율을 보여, 농도 의존적으로 세포 생존율의 감소가 나타나는 것을 알 수 있었다. 따라서, 본 실험에서는 세포 생존율에 영향을 미치지 않는 1% 농도의 D-panthenol을 피부 보습 및 피부 장벽에 영향을 확인하기 위해 사용하였다. SAE의 세포 독성 평가를 실시한 결과, 12.5~400 μg/ml의 농도로 처리를 하였고 400 μg/ml에서 84.3%, 200 μg/ml 이하의 농도에서는 모두 90% 이상의 세포 생존율을 보였다(Fig. 2 (B)). CSE의 경우는 1~20 μg/ml의 농도로 처리하였고, 20 μg/ml에서 60.9%, 15 μg/ml에서 79.8%, 10 μg/ml에서 92.5%의 세포 생존율을 보였으며, 10 μg/ml 이하의 농도에서 모두 90% 이상의 세포 생존율을 보였다(Fig. 2 (C)). 따라서 SAE는 200 μg/ml 이하의 농도에서, CSE는 10 μg/ml 이하의 농도 범위로 선정하여 이후 실험을 실시하였다.
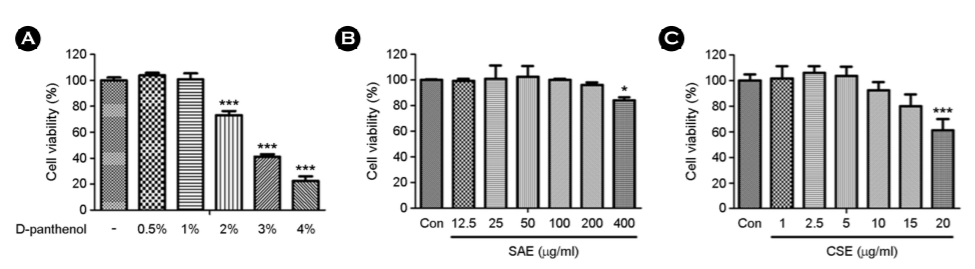
3. 염생식물 추출물이 보습 관련 유전자 HAS2, FLG, AQP3 mRNA 발현에 미치는 영향
HaCaT 세포에서 피부 보습 관련 유전자들에 미치는 영향을 평가하기 위해, 피부 보습 및 장벽 기능의 효능 물질로 알려진 D-panthenol과 SAE, CSE를 처리하고 보습 인자인 hyaluronan shyn- thase 2 (HAS2), filaggrin (FLG) 그리고 aquaporin 3 (AQP3) 유전자의 mRNA 변화를 Real-time qPCR을 이용하여 비교 분석하였다(Fig. 3). 1%의 농도인 D-panthenol의 경우 FLG에서만 유의하게 발현이 증가하였고, AQP3와 HAS2의 발현은 감소하는 경향을 보였다. SAE는 대조군 대비 HAS2가 100 μg/ml의 농도에서 약 1.8배 그리고, 200 μg/ml의 농도에서 약 3.3배의 발현이 증가한 것으로 확인되었다. 그리고, AQP3은 100 μg/ml과 200 μg/ml 농도의 SAE에 의해 약 1.5배의 유전자 발현이 증가된 것을 확인할 수가 있었다. 또한, FLG의 경우 SAE에서는 100 μg/ml 농도에서 약 1.3배의 유전자 발현을 보였다. CSE의 경우 HAS2가 10 μg/ml 농도에서 약 1.2배, FLG는 10 μg/ml 농도에서 약 1.4배 유전자 발현이 증가하였다. SAE는 D-panthenol과 CSE에 비하여 보습 유전자들의 발현 양을 가장 높게 증가시키는 것으로 확인되었다.
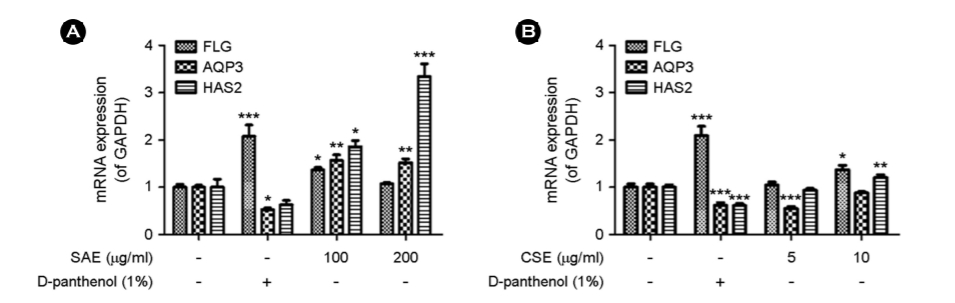
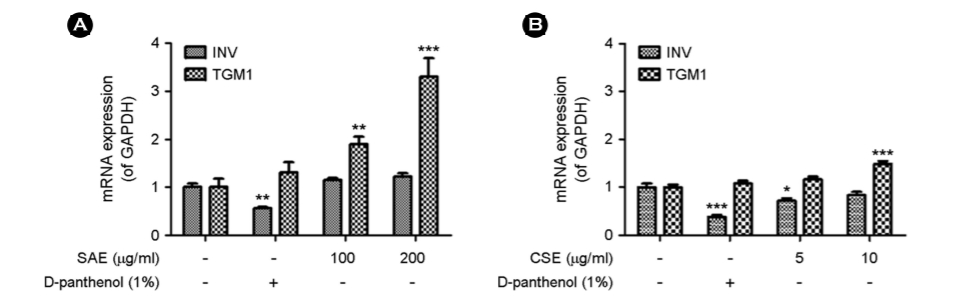
4. 염생식물이 피부 장벽 기능 강화 관련 유전자 INV과 TGM1 mRNA 발현에 미치는 영향
HaCaT 세포에서 피부 장벽 기능 강화에 효과가 있는지 여부를 평가하기 위해 피부 보습 및 장벽 기능의 효능 물질로 알려진 D-panthenol과 SAE, CSE를 처리하고 피부 장벽 기능 강화 인자인 involucrin (INV)과 transglutaminase 1 (TGM1)을 mRNA 수준에서 Real-time qPCR 기법으로 측정하였다. SAE의 경우, INV와 TGM1 유전자 모두 피부 장벽 기능의 효능 물질로 알려진 1%의 농도의 D-panthenol보다 더 높은 수치로 농도에 비례하게 증가하였다(Fig. 4 (A)). 특히, TGM1 유전자 발현이 대조군 대비 100 μg/ml 농도에서 약 1.8배, 200 μg/ml 농도에서는 3.3배 증가되었다. 그에 반해, CSE의 경우에는 10 μg/ml의 농도에서 TGM1의 유전자 발현이 약 1.5배로 SAE에 비해 미비한 수준으로 증가되었다(Fig. 4 (B)).
5. 염생식물에 의한 세포 내 MAPK 신호전달 기전
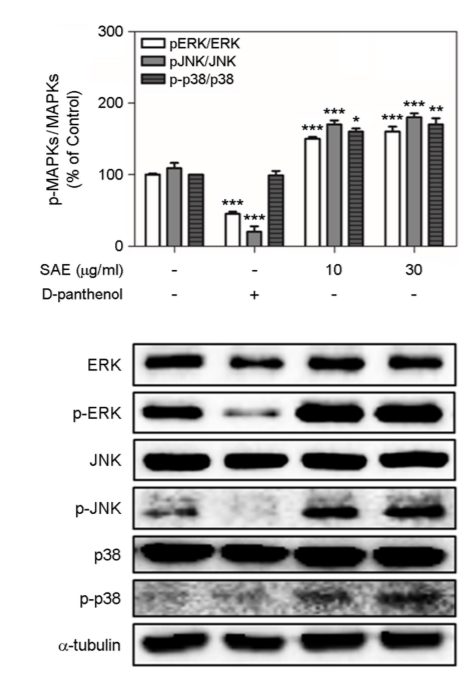
HaCaT 세포에서 피부 보습 및 장벽 기능 강화를 촉진하는 SAE의 조절 기전을 조사하기 위해 웨스턴 블롯을 사용하여 ERK, JNK 및 p38을 포함한 MAPK의 활성화를 조사하였다. HaCaT 세포 내에 ERK, JNK 및 p38의 인산화는 SAE에 의해 용량 의존적 방식으로 유의하게 증가되었음을 확인했다(Fig. 5). 결과적으로, SAE는 ERK, JNK 및 p38의 인산화를 상향 조절함으로써, 피부 보습 및 장벽 기능 강화의 영향을 미치는 것으로 나타났으며, 기존 피부 보습 및 장벽 기능의 효능 물질로 알려진 D-panthenol 보다 유의하게 증가되는 것으로 나타났다.
고 찰
본 연구에서 우리는 외적인 요인에 의한 피부의 산화적 스트레스로 유발된 영향을 감소시키는 동시에 환경문제해결 및 고부가가치를 창출하는 소재를 발굴하기 위해, 보습 및 피부 장벽 기능 강화에 관한 효능을 갖는 소재로 비교적 연구가 미비한 블루카본 바이오매스 자원인 염생식물을 대상으로 하여 그 가능성을 평가하였다.
해양 자원인 염생식물 중 갯끈풀과 갯메꽃에 대한 보습 및 피부 장벽 기능 강화에 관한 효능 평가를 수행하기 위하여 70% EtOH로 추출하여 제작하였으며, 세포 독성 평가를 수행하여 실험에 적합한 농도를 설정하여 연구를 수행하였다. 또한 이미 피부 보습 및 장벽 강화를 위한 성분으로서 화장품에 사용되고 있는 D-panthenol과 비교를 함으로써 효능의 정도와 작용 기전을 규명하고자 하였다(Proksch et al., 2017; Choi et al., 2019).
Filaggrin (FLG) 과립층에서 keratohyalin을 만드는 단백질인 pro- filaggrin의 형태로 존재하고 있다가, 마지막 분화 과정에서 filag- grin으로 분해된 후에 천연 보습 인자(Natural Moisturize factor)의 주요 성분이 된다고 알려져 있다(Cau et al., 2017; Park et al., 2019). Aquaporin 3 (AQP3)는 사람의 각질형성세포에서는 수분 통로를 형성하여 특이적으로 물, 글리세롤, 우레아 등과 같은 성분들을 세포 내로 전달하는 역할을 하는 막 관통 단백질로 피부 보습 유지의 중요한 역할을 한다(Kikuchi et al., 2003). Hyaluronic acid는 피부의 보습을 유지하여 피부상태 개선에 도움을 주는 생체 내 자연 형성되는 보습 인자로(Kawada et al., 2016) 이들은 hyaluronan shynthase (HAS)에 의하여 생성되고 주로 HAS1, HAS2 그리고 HAS3으로 존재하고 있다. 이들 중 HAS2가 각질형성세포에 가장 많이 존재한다고 보고되어 있다(Park et al., 2019). 또한, 기존 연구에서 HAS2는 mitogen-activated protein kinase (MAPK)와 AKT signaling pathway에 의해 발현이 조절된다고 알려져 있다(Lim et al., 2015). Involucrin (INV)과 transglutaminase 1 (TGM1)은 cornified envelope (CE)의 전구 단백질이다. 이 단백질들은 세포의 분화 단계를 거치면서 세포막의 안쪽에서 다른 구조 단백질들과 cross-link를 통해 피부 장벽 기능을 강화시켜주는 역할을 한다(So et al., 2019). 따라서, 본 연구에서는 외적 요인과 ROS 등의 산화적 스트레스로 인해 약화된 보습력을 강화시키고, 동시에 피부 장벽 기능을 개선시키는 소재를 확인하기 위하여 filaggrin (FLG), Aquaporin 3 (AQP3), hyaluronan shynthase 2 (HAS2), Involucrin (INV)과 transglutaminase 1 (TGM1)의 mRNA 수준에서의 발현 변화를 살펴보았다.
먼저, 우리는 보습 관련 유전자 FLG와 AQP3의 발현에 대한 영향을 평가한 결과, D-panthenol은 FLG의 발현이 유의하게 증가했으며, SAE도 마찬가지로 100 μg/ml의 농도에서 유의한 증가를 보인데 반해, CSE의 경우 FLG의 발현에 유의한 영향이 없는 것으로 나타났다. 또한, SAE와 CSE가 HaCaT 세포에서 HAS2 발현에 미치는 영향을 평가한 결과, D-panthenol은 HAS2의 발현에 영향을 미치지 않았지만, SAE의 경우 농도 의존적으로 높은 HAS2 발현을 유도하였고, CSE는 10 μg/ml의 농도에서 유의하게 증가했다.
피부 장벽 기능에 관련된 유전자의 발현에 영향을 평가한 결과, D-panthenol과 CSE은 INV과 TGM1 발현에 영향이 미치지 않는 것이 확인되었다. 반대로, SAE는 농도 의존적으로 높은 TGM1과 INV의 발현을 증가시켰다. 결과적으로 SAE는 D-panthenol과 CSE에 비하여 피부 보습 관련 유전자와 장벽 기능에 관련된 유전자들을 상향 조절하는 것으로 나타났다.
FLG는 ERK/MAPK에 의해 분화 조절된다고 잘 알려져 있다(Kim et al., 2015). AQP3 단백질은 JNK와 p38/MAPK signaling pathway에 의해 발현이 조절 된다고 잘 알려져 있는데(Cao et al., 2008), 이 AQP3의 증가는 다양한 기질들인 물, 글리세롤 그리고 우레아 등이 표피층의 수분함유량을 증가시켜 피부의 보습력과 장벽 강화 등에 긍정적인 영향을 미친다(Bae et al., 2019). TGM1은 구조 단백질인 INV를 합성하여 loricrin과 TGM3 등과 같은 다른 구조 단백질들을 cross-link를 통해 피부 장벽을 강화시키고, P38/MAPK와 nuclear factor-kappa B (NF-κB) signaling pathway에 의해 발현이 조절된다고 알려져 있다(Terazawa et al., 2015). INV는 p38 및 JNK/MAPK signaling pathway에 의해 분화 조절된다고 잘 알려져 있다(Silva et al., 2017). 따라서, 본 연구에서는 염생식물 추출물의 피부 보습 및 장벽 기능에 관여하는 유전자들의 발현에 영향을 미치는 SAE에 의한 신호전달 경로를 확인한 결과, SAE는 ERK, JNK와 p38의 인산화 반응을 상향 조절시키는 것으로 나타내었다.
하지만, 기존 보고된 바와는 다르게 피부 보습 및 장벽 기능의 효능 물질로 알려진 D-panthenol을 처리하였을 때 인산화된 ERK와 JNK는 모두 감소하였으며 p38은 유의한 변화를 보이지 않았다(Choi et al., 2019). 1% D-panthenol을 처리하였을 때 HAS2, FLG, AQP3, INV과 TGM1 유전자들이 mRNA 수준에서 유의하게 증가하지 않았고, 마찬가지로 MAPKs pathway에 관여하지 않는 것으로 나타났다. 본 연구에서의 D-panthenol의 결과는 SAE에 비하여 효력이 거의 없는 것으로 나타났으며 D-panthenol의 기존의 보고된 결과와 유사한 효과를 나타내기 위해서는 노출시간 혹은 농도 처리 범위를 재설정할 필요가 있다고 사료된다. MAPKs pathway는 각질형성세포에서 피부 형성 단백질의 분해와 축적에 관여하는데, SAE에 의해 상향 조절됨으로써 보습 관련 단백질인 FLG과 AQP3의 형성을 촉진시키고 hyaluronic acid의 합성을 증가시키게 된다. 또한 MAPKs pathway의 상향 조절로 INV과 TGM1의 발현을 증가시키고 이는 피부 장벽의 기능을 강화로 이어진다.
따라서, 본 연구는 염생식물 중에서 갯끈풀 추출물이 피부 보습 및 장벽 기능에 있어 우수한 천연 화장품 소재로서의 개발 가능성을 보였음을 나타낸다.
- References
-
1. Bae IH, Lee SH, Oh S, Choi H, Marinho PA, Yoo JW, Kim DY. 2019. Mannosylerythritol lipids ameliorate ultraviolet A-induced aquaporin-3 downregulation by suppressing c-Jun N-terminal kinase phosphorylation in cultured human kera- tinocytes. Kor J Physiol Pharmacol 23: 113-120. doi:10.4196/ kjpp.2019. 23.2.113
-
2. Cao C, Wan S, Jiang Q, Amaral A, Lu S, Hu G, Wan Y. 2008. All-trans retinoic acid attenuates ultraviolet radiation-induced down-regulation of aquaporin-3 and water permeability in human keratinocytes. J Cell Physiol 215: 506-516. doi:10.1002/ jcp.21336
-
3. Cau L, Pendaries V, Lhuillier E, Thompson PR, Serre G, Takahara H, Méchin MC, Simon M. 2017. Lowering relative humidity level increases epidermal protein deimination and drives human filaggrin breakdown. Journal of Dermatological Science 86: 106-113.
-
4. Choi E, Kang YG, Hwang SH, Kim JK, Hong YD, Park WS, Kim D, Kim E, Cho JY. 2019. In vitro effects of dehydrotrametenolic acid on skin barrier function. Molecules 24: 4583.
-
5. Kawada C, Kimura M, Masuda Y, Nomura Y. 2016. Orally admin- istered hyaluronan affects skin dryness and epidermal thick- ening in photoaged hairless mice. Bioscience, Biotechnology, and Biochemistry 80: 1192-1195.
-
6. Kikuchi K, Kobayashi H, Hirao T, Ito A, Takahashi H, Tagami H. 2003. Improvement of Mild Inflammatory Changes of the Facial Skin Induced by Winter Environment with Daily Appli- cations of a Moisturizing Cream. Dermatology 207: 269-275. doi:10.1159/000073089
-
7. Kim JH, Bae HC, Ko NY, Lee SH, Jeong SH, Lee H, Son SW. 2015. Thymic stromal lymphopoietin downregulates filaggrin ex- pression by signal transducer and activator of transcription 3 (STAT3) and extracellular signal-regulated kinase (ERK) phos- phorylation in keratinocytes. J Allergy Clin Immunol 136: 205-208. doi:10.1016/j.jaci.2015.04.026
-
8. Kim M-J, Hyun KH, Kim J-H, Han DH, Kim S-Y, Lee NH, Hyun C-G. 2017. Whitening Activities of the Halophyte L. tetragonum (Thunberg) A. A. Bullock Extract in B16F10 Melanoma Cells. KSBB Journal 32: 218-223. doi:10.7841/ksbbj.2017.32.3.218
-
9. Kim Y-A, Min H-Y, Park HJ, Lee E-J, Park E-J, Hwang H-J, Lee SK. 2004. Suppressive effects of nitric oxide production and inducible nitric oxide synthase (iNOS) gene expression by Calystegia soldanella methanol extract on lipopolysaccharide-activated RAW 264.7 cells. European Journal of Cancer Pre- vention 13: 419-424.
-
10. Kim YA, Kong CS, Um YR, Lim SY, Yea SY, Seo WY. 2009. Evaluation of Salicornia herbacea as a Potential Antioxidant and Anti-Inflammatory Agent. Journal of Medicinal Food 12: 661-668.
-
11. Lee S-K. 2020. Mangrove Height Estimates from TanDEM-X Data. Korean Journal of Remote Sensing 36: 325-335.
-
12. Lim T-G, Jeon AJ, Yoon JH, Song DS, Kim J-E, Kwon JY, Lee KW. 2015. 20-O-β-D-glucopyranosyl-20(S)-protopanaxadiol, a metabolite of ginsenoside Rb1, enhances the production of hyaluronic acid through the activation of ERK and Akt mediated by Src tyrosin kinase in human keratinocytes. Int J Mol Med 35: 1388-1394. doi:10.3892/ijmm.2015.2121
-
13. Park S, Paek M, Yang J. 2019. Skin Anti-aging, Moisturizing, and Barrier Protective Effects of Plectranthus Tomentosa: A Com- parative Study of Water and Ethanol Extracts. J Kor Soc Cosm 25: 1061-1607.
-
14. Proksch E, de Bony R, Trapp S, Boudon S. 2017. Topical use of dexpanthenol: a 70th anniversary article. J Dermatolog Treat 28: 766-773. doi:10.1080/09546634.2017.1325310.
-
15. Ravikumar S, Gnanadesigan M, Inbaneson SJ, Kalaiarasi A. 2011. Hepatoprotective and antioxidant properties of Suaeda maritima (L.) Dumort ethanolic extract on concanavalin-A induced hepatotoxicity in rats. NISCAIR-CSIR 49: 455-460.
-
16. Re R, Pellegrini N, Proteggente A, Pannala A, Yang M, Rice-Evans C. 1999. Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radic Biol Med 26: 1231-1237. doi:10.1016/s0891-5849(98)00315-3
-
17. Shin WS, Yoon YG, Lee SW, Yoon JJ. 2019. The value and applica- tions of coastal halophytes. ChungNam Climate Information Briefing 41: 1-11.
-
18. Silva AD, Maraschin BJ, Laureano NK, Daroit N, Brochier F, Bundrich L, Rados PV. 2017. Expression of E-cadherin and involucrin in leukoplakia and oral cancer: an immunocytochemical and immunohistochemical study. Braz Oral Res 31: e19. doi: 10.1590/1807-3107BOR-2017.vol31.0019
-
19. So YK, Hwang JY, Kim HW, Jo HN, Lee T-B. 2019. Skin hydration and skin barrier effects of Cymbopogon citratus and Perilla frutescens extracts. Journal of the Society of Cosmetic Scientists of Korea 45: 225-235.
-
20. Son JM, Kim JS, Kim HJ, Seo YW. 2018. Anti-invasion Effects of Calystegia soldanella Solvent Extracts and Partitioned Frac- tions on PMA stimulated Fibrosarcoma Cells. Journal of Life Science 29: 287-294. doi:10.5352/JLS.2019.29.3.287
-
21. Terazawa S, Mori S, Nakajima H, Yasuda M, Imokawa G. 2015. The UVB-Stimulated Expression of Transglutaminase 1 Is Mediated Predominantly via the NFkappaB Signaling Pathway: New Evidence of Its Significant Attenuation through the Specific Interruption of the p38/MSK1/NFkappaBp65 Ser276 Axis. PLoS One 10: e0136311. doi:10.1371/journal.pone.0136311
-
-
23. Yoon JJ, Yoon YG. 2016. The current issue of the spread of Spartina anglica that threatens the tidal flat environment and the countermeasures of Chungcheongnam-do. ChungNam Climate Information Briefing 13: 1-5.
-












