JMLS 2021 June;6(1):23-30. Epub 2021 May 31
Copyright © 2021 by The Korean Society of Marine Life Science
Microstructural Differentiation of Sperm in the Abalone Haliotis discus hannai (Gastropoda: Haliotidae)
Hyejin Kim; Fisheries Seed and Breeding Research Institute, National Institute of Fisheries Science, Haenam 59002, Korea
Hyeon Jin Kim; Department of Aqualife Medicine, Chonnam National University, Yeosu 59626, Korea
So Ryung Shin; Department of Aqualife Medicine, Chonnam National University, Yeosu 59626, Korea
Eun Ran Baek; Department of Aqualife Medicine, Chonnam National University, Yeosu 59626, Korea
Jung Sick Lee; Department of Aqualife Medicine, Chonnam National University, Yeosu 59626, Korea
- Abstract
-
북방전복 Haliotis discus hannai 웅성생식세포의 분화과정과 정자의 형태를 미세구조적으로 기재하였다. 정자의 분화과정은 정원세포기, 정모세포기, 정세포기 및 정자기의 4단계로 구분하였다. 정원세포기에서 정모세포기로의 분화과정은 형태학적 변화가 크지 않았다. 그러나 정자변태과정 동안 염색질 응축, 핵의 형태 변화, 첨체와 중편 및 편모 형성 등의 급격한 형태학적 변화를 나타냈다. 북방전복의 정자는 두부, 중편 및 미부로 구성되며, 두부의 길이는 약 5.3 μm로 전자밀도가 높은 핵과 총알형의 첨체로 이루어져 있었다. 중편은 기저체와 미토콘드리아로 구성되어 있었으며, 기저체를 중심으로 5개의 미토콘드리아가 한 층으로 배열되어 있었다. 미부의 횡단면은 "9+2"의 미세소관 구조를 보였다. 이러한 형태 및 구조적 특징은 북방전복의 정자는 원시형(primitive type) 정자임을 보여주는 결과이다.
The differentiation process of male germ cells and sperm morphology of the abalone Haliotis discus hannai were described in ultrastructure. The differentiation process of sperm was divided into four stages: spermatogonium, spermatocyte, spermatid and sperm. The process of differentiation from spermatogonium to spermatocyte did not show significant morphological changes. However, during the spermiogenesis there were distinct morphological changes such as chromatin condensation, morphological changes of the nucleus, and formation of acrosome, midpiece and flagellum. The sperm of the abalone consisted of head, midpiece and tail. The head of approximately 5.3 μm in length was composed of a nucleus of high electron dense and bullet-shaped acrosome. The midpiece was composed of the basal body and mitochondria, and five mitochondria were arranged in single layer around the basal body. The cross section of the tail showed a "9+2" axonemal structure. These morphological and structural features are the result of showing that the sperm of H. discus hannai is a primitive type.
Keywords: Haliotis discus hannai(북방전복) Sperm(정자) Microstructural differentiation (미세구조적 분화)
Correspondence to: Jung Sick Lee; Department of Aqualife Medicine, Chonnam National University, Yeosu, 59626, Korea; E-mail : ljs@jnu.ac.kr
- Received
- 4 January 2021;
- Revised
- 26 March 2021;
- Accepted
- 13 April 2021.
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Language: Korean/English,
Full Text:

서 론
정자의 형태, 구조적 특징 및 정자의 분화과정은 종과 상위의 분류군에 따른 특이성을 반영하므로 중요한 계통분류학적 형질로 사용된다(Hodgson and Bernard, 1988; Jamieson, 1991; Franco et al., 2008; Chen et al., 2015). 아울러 생식세포의 형태와 구조에 관한정보는 종의 보존 및 증식 측면에서도 매우 중요하게 이용되는 자료이다.
배우자형성과정은 생식소 발달단계와는 다르게 하나의 생식세포가 감수분열과정을 거쳐 분화, 발달하는 과정을 의미한다(Hahn, 1989; Gurney and Mundy, 2004). 전복류 성체의 생식소 구조 및 생식세포 발달에 관한 연구는 정자형성과정 동안의 형태학적 비교 연구(Sobhon et al., 2001; Singhakaew et al., 2003)를 비롯하여 정자의 미세학적 구조에 관한 연구(Lewis et al., 1980; Shiroya and Sakai, 1984; Hogdson and Foster, 1992; Gwo et al., 1997; Healy et al., 1998)가 보고되어 있다. 하지만, 북방전복 Haliotis discus hannai 정자의 미세구조적 분화과정과 형태에 관한 고찰은 매우 미약하다.
북방전복은 한국, 중국 및 일본 등지에서 자원조성과 양식용의 중요한 생물자원 가운데 하나이다(Lee et al., 2015). 따라서 본 연구는 북방전복의 정자형성과정에 관한 기초생물학적 정보와 생물자원 보존에 필요한 정보를 제공하고자 하였다.
재료 및 방법
1. 재료
본 연구에서는 북방전복 Haliotis discus hannai 성체(각장 67.4±7.80 mm) 21개체를 분석하였다.
2. 현미경 표본 제작 및 분석
2.1. 광학현미경
간췌장이 포함된 정소의 일부를 적출하여 10% 중성포르말린에 24시간 동안 고정한 후 수세하여 Bouin 용액에 재고정 하였다. 시료는 흐르는 물에 48시간 동안 수세한 후 알코올 단계별 탈수 후 paraplast (Leica, Germany)에 포매하였다. 포매된 시료는 microtome (RM2235, Leica, Germany)을 이용하여 4~6 μm 두께로 연속절편 하였다. 제작된 표본은 Mayer's hematoxylin-eosin (H-E) 염색, Masson 삼중염색 그리고 alcian blue-periodic acid and Schiff's solution (AB-PAS, pH 2.5) 반응을 시행하였다.
2.2. 주사전자현미경
정소의 일부를 절취하여 0.1 M phosphate buffer (pH 7.4)로 완충된 2.5% glutaraldehyde 용액에 3시간 고정하였다. 고정된 시료는 0.1 M phosphate buffer (pH 7.4)에 20분씩 3회 수세한 후, 1% OsO4로 2시간 동안 4℃ 암조건에서 후 고정하였다. 후 고정된 시료를 0.1 M phosphate buffer (pH 7.4)로 20분씩 3회 수세한 후, 알코올 단계별 탈수 후 CO2로 임계건조 하였다. 1분간 백금이온을 이용하여 약 5 nm로 증착 후, FE-SEM (Sigma 500, Zeiss, Germany)으로 관찰하였다.
2.3. 투과전자현미경
전 고정과 후 고정은 주사전자현미경 시료제작과 동일한 과정을 거쳐 진행하였다. 후 고정된 시료를 0.1 M phosphate buffer (pH 7.4)로 20분씩 3회 수세한 후, 알코올 단계별 탈수 후 30분 간격으로 2회에 걸쳐 propylene oxide의 치환과정을 거쳐 60℃ 오븐에서 epoxy resin으로 36~48시간 동안 중합하였다. 완성된 시료의 블럭은 ultramicrotome (EM-UC 7, Leica, Germany)으로 600~ 900 nm 두께로 절편한 후, uranyl acetate-lead citrate의 이중염색 과정을 거쳐 투과전자현미경(LIBRA® 120, Carl Zeiss NTS GmbH, Germany)으로 관찰하였다.
2.4. 현미경 화상분석
세포 크기 등의 정량적 분석을 위하여 현미경 화상분석 프로그램(i-solution, IMT Inc., U.S.A.)을 이용하여 분석하였다.
결과 및 고찰
1. 정소의 형태와 구조
북방전복 성체의 정소는 긴 원뿔형으로 갈색의 간췌장을 둘러싸고 있으며, 성숙시기에 정소는 부피가 증가하며 옅은 노란색을 나타냈다(Fig. 1A). 정소는 얇은 외막으로 싸여 있었으며, 외막은 외부 상피층과 내부 결합조직층으로 이루어져 있었다. 정소는 생식소 외막과 간췌장 사이의 생식소 내강에 형성된 격벽에 의해 여러 개의 내강으로 구분되며, 분지형 생식세포형성소낭(sperm- atogenic follicle)으로 구성되고 이들 생식세포형성소낭을 따라 생식세포들이 발달한다(Fig. 1B, C).
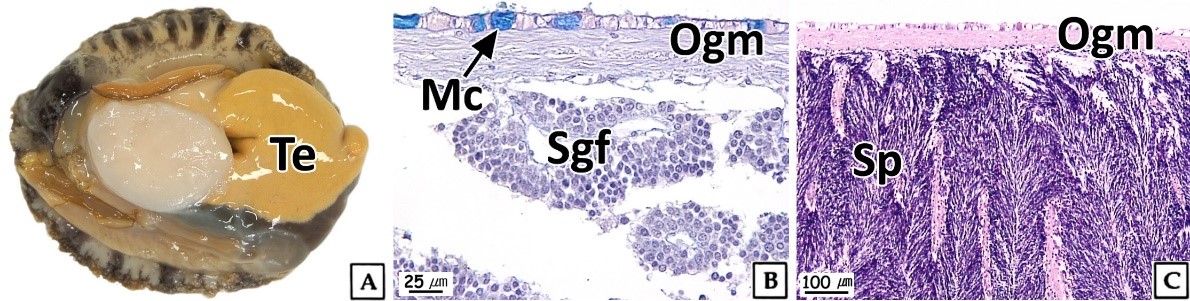
이러한 북방전복 정소의 조직학적 구조는 Haliotis midae (Visser-Roux, 2011)를 비롯한 많은 전복류와 유사하였다(Wilson and Schiel, 1995; Capinpin et al., 1998; Najmudeen and Victor, 2004; Bilbao et al., 2010).
2. 정자분화 과정
북방전복의 정자분화 과정은 세포의 크기, 염색성, 핵과 세포소기관의 구조적 특징에 따라 정원세포(spermatognium), 정모세포(spermatocyte), 정세포(spermatid), 정자(sperm) 단계로 구분하였다.
대부분 패류의 정자는 감수분열과정을 거쳐 구조 및 기능적으로 완성된 형태로 체외로 방출된다. 따라서 정자형성과정은 일반적으로 감수분열 단계에 따라 구분된다. 복족류에서 정원세포부터 정자에 이르기까지의 정자형성과정 동안 중요한 형태학적 변화는 연접사복합체(synaptonemal complex)의 출현, 핵의 형태 변화와 첨체(acrosome) 및 편모 형성이다(Lewis et al., 1980; Healy, 1988; Sobhon et al., 2001). 본 연구에서 정자형성과정의 4단계 구분은 H. asinina (Wetakan et al., 1997; Sobhon et al., 2001)와 H. ovina (Singhakaew et al., 2003)를 비롯한 전복류와 동일하였다.
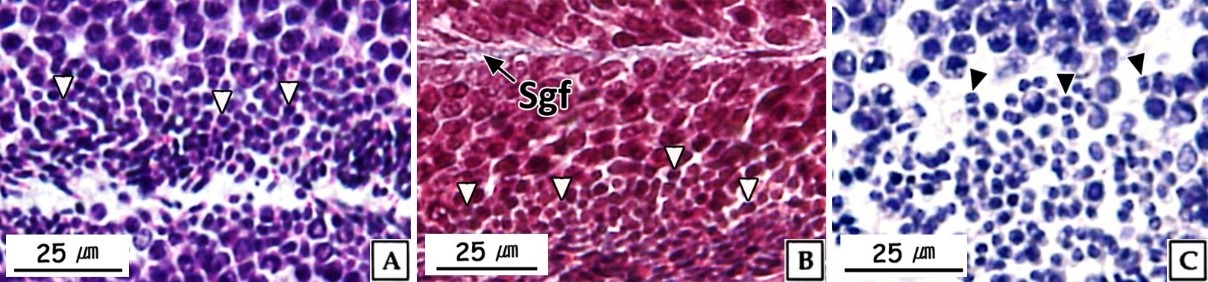
정원세포는 정소 발달단계 가운데 주로 비활성기와 초기활성기에 관찰되었다. 형태는 원형 혹은 타원형으로 직경 약 7~8 μm의 크기였다. 핵질에는 H-E 염색, Masson 삼중염색 및 AB-PAS (pH 2.5) 반응에 강한 호염기성을 나타내는 염색사의 분포를 확인할 수 있었다. 정원세포의 세포질은 H-E 염색에서는 약한 호염기성을 나타냈으며, Masson 삼중염색에서는 붉은색, AB-PAS (pH 2.5) 반응에서는 옅은 보라색을 나타냈다(Fig. 2). 투과전자현미경 표본에서 간기(interphase)의 정원세포는 원형 혹은 타원형으로 핵의 직경은 약 3.8 μm로 세포의 대부분을 차지하며, 핵질은 전자밀도가 높은 미세한 과립형의 이형염색질로 채워져 있었다. 세포질에서는 관상의 미토콘드리아와 조면소포체 그리고 직경 약 200~300 nm의 전자밀도가 높은 단백질성 과립들이 분포하고 있었다(Fig. 3A). 분열기 정원세포의 핵은 타원형으로 여전히 세포 표면적의 60% 이상을 차지하며, 핵질에는 핵공 부위를 제외한 핵막 내부를 따라 응축된 이형염색질이 진정염색질과 뚜렷하게 구분되어 있었다. 핵막 주변의 세포질에서는 크리스테(cristae) 구조가 잘 발달된 직경 약 300 nm의 관상 미토콘드리아와 조면소포체가 관찰되었다(Fig. 3B).
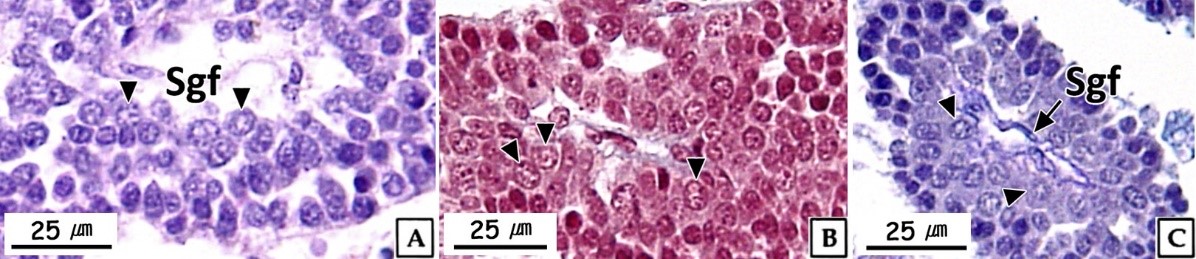
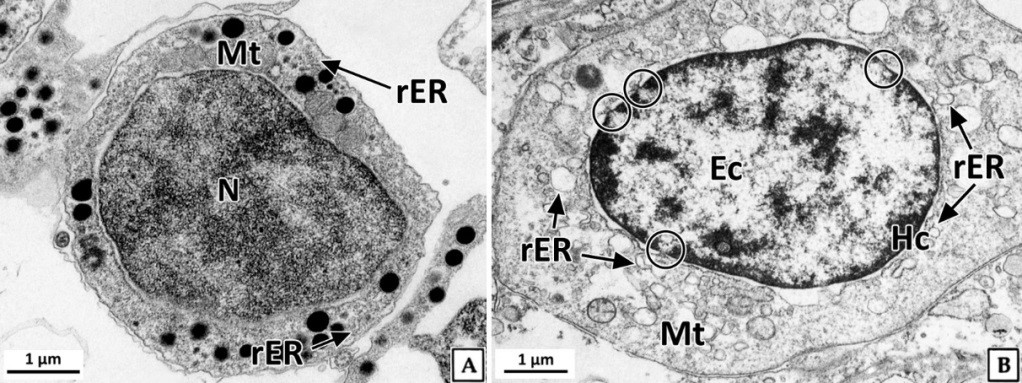
정모세포는 정소 발달단계 가운데 주로 초기활성기에 관찰되었으며, 크기는 약 5~6 μm로 정원세포에 비해 감소하였다. 핵은 H-E 염색과 Masson 삼중염색, 그리고 AB-PAS (pH 2.5) 반응에서 모두 호염기성을 나타냈다(Fig. 4). 투과전자현미경 표본에서 제 1정모세포의 초기에 핵은 정원세포와 유사한 타원형으로 핵 내에서는 응축된 이형염색질 덩어리가 뚜렷하였으며, 핵의 후방에 미토콘드리아들이 분포하고 있었다(Fig. 5A). 이후, 핵질의 대부분은 미세한 과립상과 사상의 이형염색질들로 채워지며, 이중 사상형태로 응축된 전자밀도가 높은 연접사복합체(synaptonemal complex)를 관찰할 수 있었다(Fig. 5B). 제 2정모세포의 핵질에서는 제 1정모세포보다 이형염색질이 더욱 응축되어 진정염색질과의 구분이 뚜렷하였다. 핵 상부의 세포질에서는 시스터네(cisternae) 구조가 발달된 원형의 골지체가 관찰되었으며, 세포질 내의 조면소포체와 전자밀도가 높은 단백질성 과립들은 정원세포기보다 감소하였다(Fig. 5C).
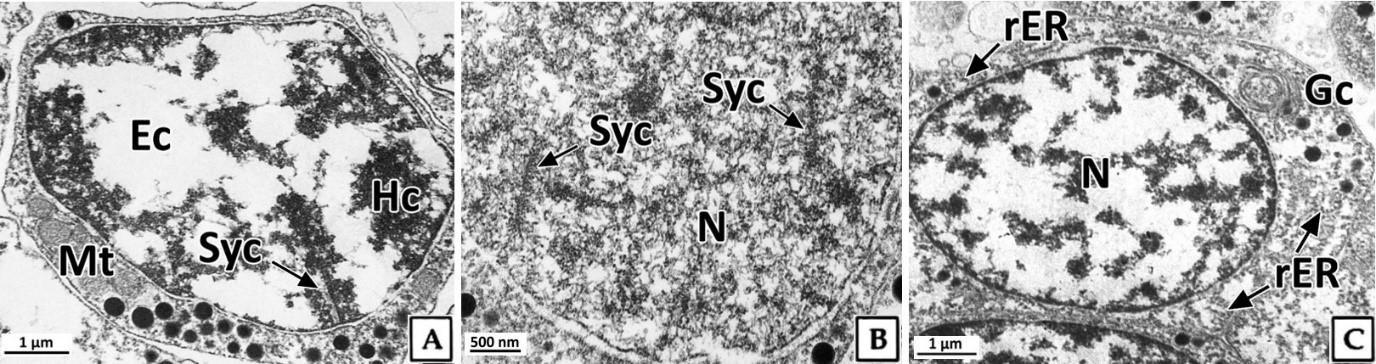
정자형성과정 동안 연접사복합체는 상동염색체를 결합하는 미세섬유로 이루어진 구조로 제 1감수분열의 전기에 볼 수 있는 중 요한 형질이다(Billard, 1984; de Boer and Heyting, 2006; Jung et al., 2007). 전복류에서 정원세포로부터 정자의 완성까지 기간 또는 정자형성 단계별 기간에 관해서는 구체적으로 보고된 바는 없지만, 제 1감수분열 전기 중 태사기의 기간이 긴 종에서는 연접사복합체의 확인이 쉬울 것으로 판단된다.
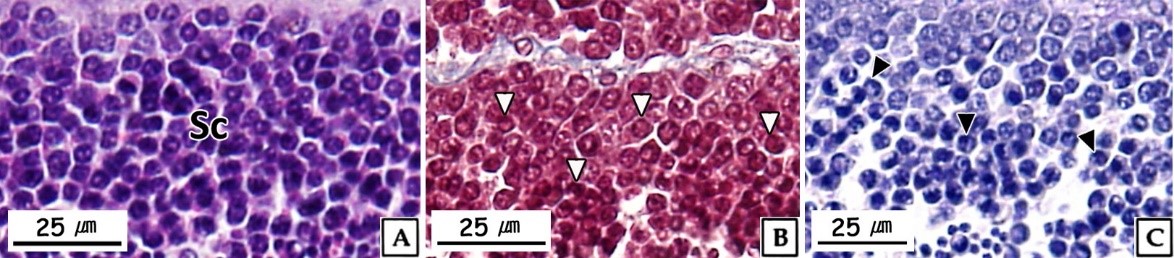
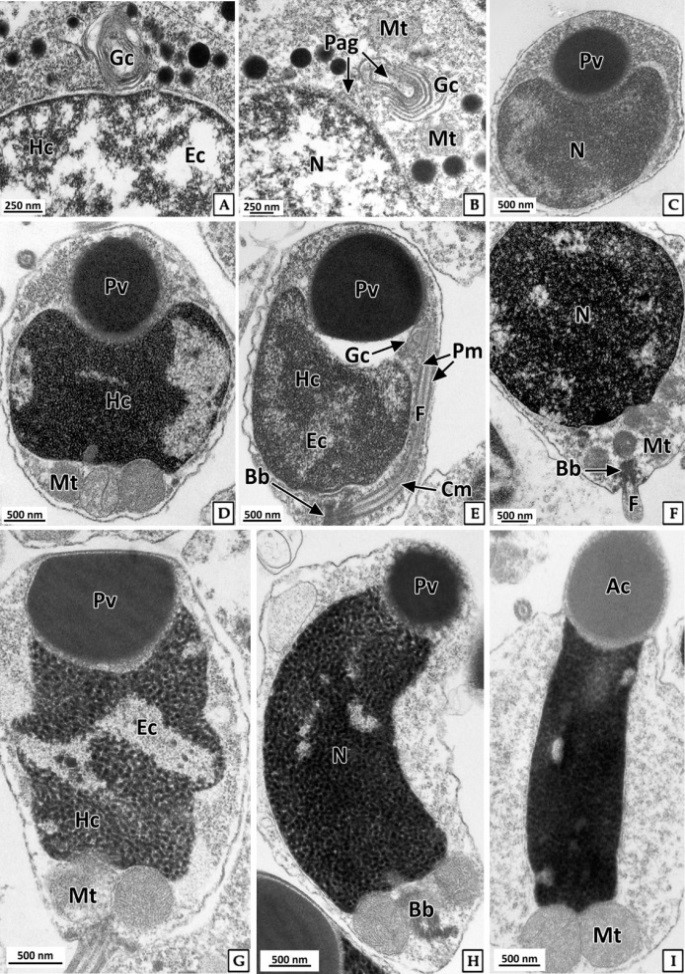
정세포들은 초기활성기와 후기활성기의 정소에서 주로 관찰 할 수 있었다. 초기 정세포는 여전히 원형으로 핵은 H-E 염색, Masson 삼중염색 및 AB-PAS (pH 2.5) 반응에서 모두 강한 호염기성을 나타내었다. 정세포기의 세포질에 대한 핵의 비율은 이전 단계보다 더욱 증가하여 광학현미경 표본에서는 세포질을 거의 관찰할 수 없었다(Fig. 6). 주사전자현미경 표본 분석 결과, 정세포들은 정자로 분화되는 정자변태과정(spermiogenesis)에서 꼬리와 중편의 형성, 원형에서 장방형으로 핵의 형태 변화, 첨체 형성이 관찰되었다(Fig. 7). 투과전자현미경 표본 분석 결과, 정세포 초기에 핵질은 제 2정모세포와 유사하게 전자밀도가 높은 이형염색질과 진정염색질과의 구분이 여전히 가능하였다(Fig. 8A, B). 하지만 정자변태과정이 진행됨에 따라 전자밀도가 높은 이형염색질이 더욱 미세한 과립상으로 응축되며, 핵질을 차지하는 비율이 높아져 정세포 후기에는 핵질의 대부분이 균질한 미세과립들로 채워졌다(Fig. 8C-I). 첨체의 형성은 제 2정모세포의 말기에 출현한 골지체로부터 시작되었다. 초기 정세포의 핵 위쪽 세포질에서는 내강과 시스터네가 발달한 동심원상의 골지체가 관찰되었다(Fig. 8A). 이후, 골지체 내강과 핵과 인접한 성숙면 근처에서 전자밀도가 높은 미세 과립상의 아첨체과립들(proacrosomal granules)이 관찰되었다(Fig. 8B). 정세포 중기에 아첨체과립들은 서로 융합되어 크기와 전자밀도가 증가하여 균질화 된 원형의 아첨체포(proacrosomal vesicle)를 형성하여(Fig. 8C, D) 정자변태과정 말기의 정세포에서는 전자밀도가 감소한 타원형의 첨체를 형성하였다(Fig. 8I). 중편은 정모세포기에 세포질에 산재하던 미토콘드리아들이 정세포기가 진행되면서 핵 후방으로 이동하여 기저체를 중심으로 단층으로 위치하면서 형성된다. 정세포기 말기에 미토콘드리아는 직경 약 500 nm로 이전 단계보다 크기가 증가하였으며, 내부의 크리스테가 발달되어 있었다(Fig. 8I). 미부는 핵의 하단에 위치한 중심립으로 구성된 기저체에서 발달한 편모 축사의 미세소관들이 신장되어 형성된다. 미부는 정세포 중기에 이미 형성되어 세포질 내에서 핵의 장축을 따라 위치하고 있다가 세포질 밖으로 돌출되었다(Fig. 8G, H).
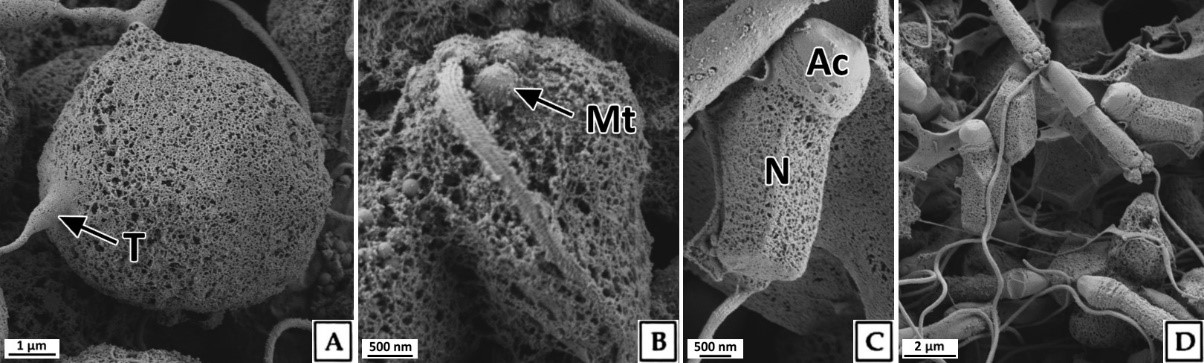
정세포에서 정자로 분화하는 정자변태과정에서 세포형태의 변화는 핵질 응축 및 세포질 소실에 따른 것이며, 핵은 핵질 가운데 이형염색질의 응축형태에 따라 원형 또는 타원형이나 장방형으로 신장된다(Yasuzumi, 1974; Lewis et al., 1980; Billard, 1984; Franco et al., 2008). Yasuzumi (1974)는 핵에서 이형염색질의 응축형태를 과립상(granular pattern), 섬유상(fibrillar pattern) 및 판상(lamellar pattern)으로 구분하였는데, 이러한 기준으로 볼 때 북방전복 정세 포에서 핵질의 응축형태는 H. rufescens (Lewis et al., 1980)와 마찬가지로 과립상에 해당하는 것으로 판단되었다. 정자의 첨체는 정자변태과정에서 첨체포로부터 형성되는데, 첨체포는 골지체로부터 형성된 아첨체과립에서 발달된다(Dohmen, 1983). 이들 골 지체의 활성 및 첨체포의 형성시기는 보통 초기 정세포 단계이다(Hodgson and Bernard, 1988). 하지만 북방전복의 정자형성과정에서 골지체의 활성은 제 2정모세포 후기에 시작되어 다른 종들 보다는 빠른 것으로 나타났다.
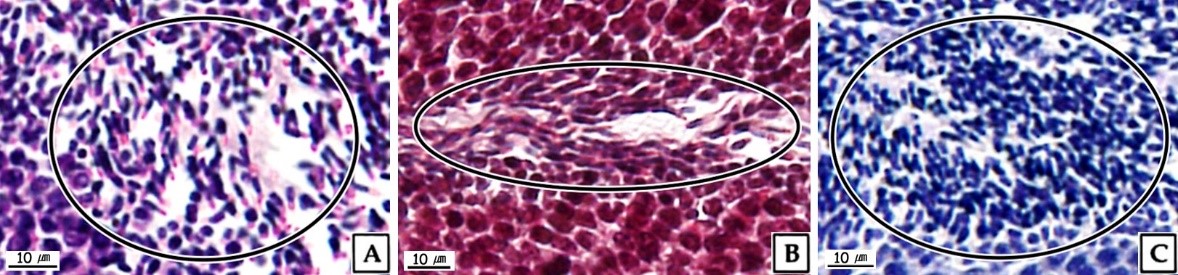
정자는 주로 완숙기의 정소에서 관찰되었다. 정자들은 무리지어 존재하였는데, 정자의 두부가 밀집된 부분은 H-E 염색, Masson 삼중염색 및 AB-PAS (pH 2.5) 반응에서 각각 보라색, 자주색 및 청자색을 나타냈다. 정자의 미부가 밀집된 부분은 H-E 염색에서는 호산성으로 반응하여 붉은색으로 나타났으며, Masson 삼중염색과 AB-PAS (pH 2.5) 반응에서는 각각 붉은색과 옅은 청색으로 반응하였다(Fig. 9). 주사전자현미경 표본에서 완숙 정자는 전체 길이 약 35.8 μm로 두부, 중편, 미부로 구성되어 있었다. 두부는 끝이 둥근 장방형으로 핵과 첨체로 구성되어 있었으며, 두부의 길이는 약 5.3 μm이었다. 첨체는 긴 총알형으로 길이는 약 2.3 μm, 가운데 직경은 약 870 nm이었다. 핵의 길이는 약 3.0 μm, 직경은 약 900 nm이었다(Fig. 10A). 정자의 중편부는 미토콘드리아들로 이루어져 있었다(Fig. 10B). 꼬리는 하나이며, 길이는 약 30 μm, 직경은 180 nm 내외 였으며(Fig. 10A), 기저부에서는 주변 미세소관들의 윤곽이 뚜렷하였다(Fig. 10B).
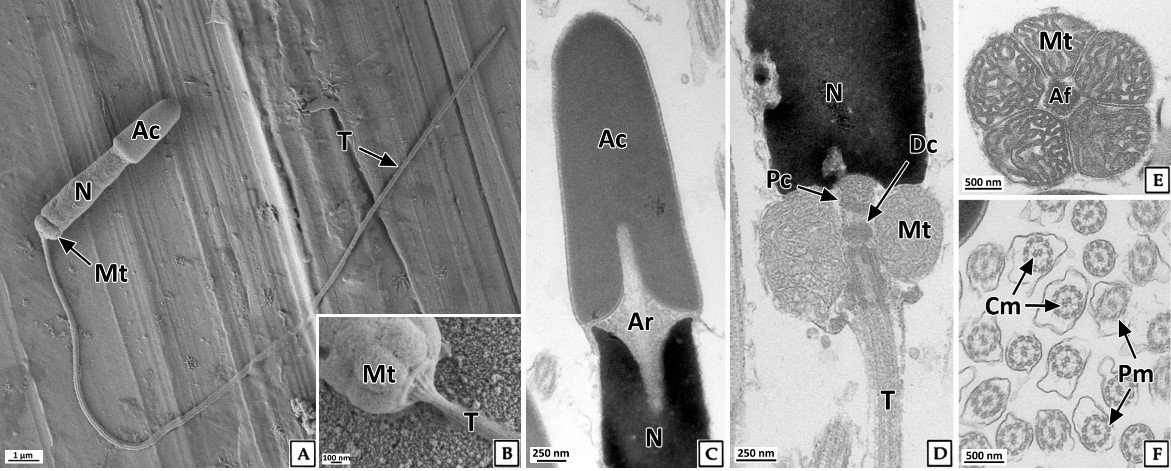
전복류 성숙 정자의 계측형질에 관한 연구는 매우 희박하여 종간 비교가 어렵지만, H. rufescens (Lewis et al., 1980)와 비교 해 볼 때 북방전복 정자의 전체 길이(52 μm), 핵(4.2 μm), 중편(0.75 μm), 꼬리(45 μm)는 짧은 편이었으며, 첨체의 길이(2.5 μm)는 유사하였다.
투과전자현미경 표본에서 세포질이 소실된 완숙 정자는 원형질막으로 둘러싸여 있었다. 첨체는 첨체막으로 둘러싸여 있었고 전자밀도는 핵보다 낮았으며, 매우 균질한 상태였다. 핵과 첨체사이에는 다수의 미세섬유들로 구성된 첨체기둥(acrosomal rod)이 정자의 길이방향으로 형성되어 있었다. 핵은 장방형으로 핵질은 전자밀도가 높았으며 대부분 균질한 상태였다(Fig. 10C). 정자의 중편부에서는 크리스테가 잘 발달된 직경 600~700 nm의 미토콘드리아가 관찰되었고 정세포기에 비해 크리스테의 전자밀도와 두께가 증가하였다. 종단면에서 미토콘드리아는 한 층으로 배열되어 있었으며, 횡단면에서는 다섯 개의 미토콘드리아가 편모 축사를 둘러싸고 있었다(Fig. 10D, E). 정자 미부의 횡단면에서는 2개의 중심 미세소관을 9쌍의 주변 미세소관이 싸고 있는 "9+2" 구조를 보였다(Fig. 10F).
복족류 정자의 첨체는 주로 첨체포(acrosomal vesicle)와 첨체기둥(acrosomal rod)으로 구성되는데, 미세섬유상의 첨체기둥은 전복류인 H. rufescens (Lewis et al., 1980), H. asinina (Sobhon et al., 2001), H. ovina (Singhakaew et al., 2003)를 비롯하여 Neritina communis (Kohnert and Storch, 1984), Bathynerita naticoidea (Hodgson et al., 1998)와 소라 Batillus cornutus (Jung et al., 2007)의 정자에서도 같은 구조가 보고되었다.
동물의 정자는 연구자와 분류 기준에 따라 다소 차이가 있는데, Franzén (1956)은 무척추동물의 정자를 원시형(primitive type)과 발달형(modified type)으로 구분하였다. 그리고 Jamieson (1991)은 정자를 수정장소에 따라 체내수정형과 체외수정형으로 구분하였으며, 첨체의 유무에 따라 첨체형 정자(acrosomal sperm)와 무첨체형 정자(anacrosomal sperm)로 구분하였다. 체외수정형 정자는 주로 수서동물에서 볼 수 있으며, 무첨체형 정자는 경골어류에 한정되어 볼 수 있다. 연체동물의 이매패강, 굴족강, 복족강에 속하는 체외수정형 정자는 보통 원시형으로 정자의 두부는 핵과 첨체로 구성되며, 길이는 약 4~6 μm로 짧은 편이다. 중편은 4~5개의 미토콘드리아로 구성되며, 편모는 하나로 "9+2" 구조를 가진다. 전복류에서 원시형 정자는 H. laevigata, H. ovina, H. rufescens에서 보고되었다(Lewis et al., 1980; Franzén, 1983; Healy, 1988; Matos et al., 1997; Healy et al., 1998; Singhakaew et al., 2003).
이러한 기준으로 볼 때, 북방전복의 정자는 H. rufescens (Lewis et al., 1980)를 비롯한 전복과에 속하는 다른 종들의 정자와 마찬가지로 원시형에 속하는 것으로 판단되었다.
- References
-
11. Gwo JC, Chang HH, Jong KJ. 1997. Ultrastructure of the sperm- atozoa of the small abalone, Sulculus diversicolor supertexta (Mollusca, Gastropoda, Haliotidae). J Submicrosc Cytol Path 29: 239-244.
-
13. Healy JM. 1988. Sperm morphology and its systematic importance in the Gastropoda. Malacol Rev 4: 251-266.
-
21. Lee JS, Son MH, Lee JS, Lim HK, Won SH, Lee JH, Kang JC, Kim JW, Kim SY. 2015. Korean Abalone (I): Morphology, Taxonomy and Ecology. Maple Design, Busan, pp 1-68.
-
28. Visser-Roux A. 2011. Reproduction of the South African abalone, Haliotis midae. Ph.D. University of Stellenbosch. pp 1-88.














