JMLS 2020 December;5(2):43-50. http://jmls.or.kr Epub 2020 December 16
Copyright © 2020 by The Korean Society of Marine Life Science
Toxic Effect of Zinc Undecylenate on the Embryogenesis of Sea Urchins Hemicentrotus pulcherrimus and Mesocentrotus nudus
Hoon Choi; Department of Life science, Incheon National University, Incheon 22012, Korea;West Sea Fisheries Research Institute, National Institute of Fisheries Science (NIFS), Incheon 22383, Korea
Yun-Ho Park; West Sea Fisheries Research Institute, National Institute of Fisheries Science (NIFS), Incheon 22383, Korea
Ju-Wook Lee; West Sea Fisheries Research Institute, National Institute of Fisheries Science (NIFS), Incheon 22383, Korea
Seung-Min Lee; West Sea Fisheries Research Institute, National Institute of Fisheries Science (NIFS), Incheon 22383, Korea
Youn-Seok Choi; West Sea Fisheries Research Institute, National Institute of Fisheries Science (NIFS), Incheon 22383, Korea
Un-Ki Hwang; West Sea Fisheries Research Institute, National Institute of Fisheries Science (NIFS), Incheon 22383, Korea
- Abstract
본 연구에서는 살균제, 항진균제 등의 의약품을 포함하여 다양한 목적으로 사용되며, 신방오도료로서의 가능성이 확인된 바 있는 Zinc undecylenate (ZU)를 이용해 연안환경 내 1차 소비자를 대표할 수 있는 성게 2종(H. pulcherrimus, M. nudus)에 대한 독성평가를 실시하였다. 실험결과 ZU에 대한 H. pulcherrimus와 M. nudus의 수정률 EC50은, 각각 11.27 mgl-1과 1.48 mgl-1로 나타났다. 또한, 정상배아 발생률의 EC50은 각각 0.94 mgl-1와 3.78 mgl-1로 나타났으며, NOEC는 0.20 mgl-1, 0.78 mgl-1를 나타내었다. 본 연구에서 도출된 성게 2종과 문헌조사를 통한 연안양식생물 2종의 급성독성결과를 이용하여 Predicted No Effect Concentration (PNEC)를 계산하였다. PNEC 값은 0.0094 mgl-1로 나타났으며, 위와 같은 결과는 해양환경 오염물질에 대한 환경 보호전략 수립을 위한 기초자료로 활용될 것이다.
The aim of this study is toxicity assessment using two types of sea urchins (H. pulcherrimus, M. nudus) that can representative primary consumers in potential coastal environments pollutants, Zinc undecylenate (ZU), which is used for various purposes, such as pharmaceutical agents and anti-bacterial and anti-fungi. The Fertilization rate and normal embryogenesis rate of H. pulcherrimus and M. nudus were concentration-dependent decreased. Besides, EC50 of fertilization rate with H. pulcherrimus and M. nudus were 11.27 mgl-1 and 1.48 mgl-1, and EC50 of normal embryogenesis were 0.94 mgl-1 and 3.78 mgl-1. NOEC of normal embryogenesis were 0.20 and 0.78 mgl-1, respectively. In addition, to find the safety criteria of the ZU on the marine environment. PNEC value was 0.0094 mgl-1, calculated using the toxicity values of two species of sea urchin derived from this study and the acute toxicity results of the coastal area through literature research. The above results will be used as basic data for establishing environmental protection strategies for marine environmental pollutants.
Keywords: Zinc undecylenate(운데실렌산아연) Hemicentrotus pulcherrimus(말똥성게) Mesocentrotus nudus(둥근성게) Toxicity test(독성실험)
Correspondence to: Un-Ki Hwang; West Sea Fisheries Research Institute, National Institute of Fisheries Science (NIFS), Incheon 22383, Korea; E-mail: vngi1@korea.kr
- Received
- 14 October 2020;
- Revised
- 20 October 2020;
- Accepted
- 22 October 2020.
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Language: Korean/English,
Full Text:

서 론
신방오도료물질은 2003년 사용금지 조치가 시행된 TBT (Tribu- tyltin)를 대체하기 위하여 개발된 방오물질로, 초기에는 Copper oxide가 함유된 물질이 사용되어 왔으나, 사용량의 증가로 인하여 해양환경에 축적되며 생기는 위해성이 지적된 바 있다(OSPAR, 2010; Karlsson et al., 2010; Ytreberg et al., 2010; Cima and Ballarin, 2012). 이후 약 18종의 신방오물질이 개발되어 사용되어 왔으나, 영국의 안전보건청(HSE: Health and safety executive)에서는 독성영향을 이유로 9개의 신방오물질(Chlorothalonil, Dichlofluanid, Diuron, Irgarol 1051®, Sea-nine 211®, TCMS pyrithione, TCMTB, Zinc pyrithione, Zineb)에만 사용허가를 한 상황이다(Chapman et al., 2014; Amara et al., 2017; Voulvoulis et al., 2000; Cresswell et al., 2006; Yamada, 2007; HMSO, 1998; Yonehara, 2000; Thomas, 2001; Voulvoulis et al., 2002). 언급한 신방오도류물질들은 환경 내에서 광합성활성 저해, 해당작용, 호흡, 항산화기능을 가진 효소활성의 저해, 대사산물 합성 저해 등을 통하여, 미생물, 해조류 등의 착생생물에게 방오효과를 나타내지만(Holt, 1993; Johansson et al., 2012; Chen and Qian, 2017; Adrislaine et al., 2018), TBT나 Copper oxide와 같이 해양생물 체내의 축적과 독성영향을 끼칠 수 있다고 밝혀지고 있다(DeLorenzo and Fulton, 2012). 이에 근래에는 실리콘 타입의 방오도료물질이나 생물유래의 친환경 방오도료물질 연구가 지속되고 있다(Mosmeri et al., 2019; Gu et al., 2020; Yang et al., 2020).
운데실린산(Undecylenic acid, Cas No. 112-38-9)은 건선을 포함한 다양한 종류의 피부장애(가려움, 감염, 화상 등)에의 의학적 치료제로 사용되는 천연 살균제 및 항진균제로, 칼슘이나 아연과 합성하여 화장품, 의약품 등으로 널리 사용되어 왔다(Nikolov and Ganchev, 2010; Bigot et al., 2016). 이외에도 실리콘베이스의 바이오센서, 향미료나 조미료에 쓰이는 중간화학물질, 방부제, 제염제 등에까지 널리 사용되는 물질이다. 특히, 운데실린산 특유의 살균, 항진균 활성은 아연 염을 합성하여 만들어진 Zinc undecylenate (ZU)에서 더욱 뛰어난 효과를 보이며, 재발성이 있는 HSV (Herpes Simplex Virus)의 치료나 장과 질내 세균의 균형을 유지하는데 효과적인 것으로 밝혀져 있다(Chretien et al., 1980; Lin et al., 2006).
ZU는 아연기 양 측쇄에 불포화 지방산이 각각 결합되어 있는 구조를 가지며, 주로 항균, 항진균제 및 피부연고로서 사람의 치료 목적으로 사용되고 있다(Hardman et al., 2001). 일반적으로, 인간을 대상으로 처방하는 의약품에 사용되고 있기에, 환경에 대한 독성이 보고된 바 없으며, 이온화된 undecylenate가 강한 활성을 나타내므로(Bourne et al., 1999), Jung (2012)에서는 ZU의 신방오도료물질로의 사용가능성을 확인 한 바 있으며, 실험 쥐의 구강독성에서 LD50 값이 2,500 mgKg-1일 정도로 생물독성이 낮아, 환경적인 측면에서 안전할 것으로 보인다. 하지만, 고농도로 방오도료에 첨가해야 기능을 나타낼 수 있기에(Jung, 2012), 신방오도료물질로 사용 시 연안환경 내 지속적인 유출에 의한 오염과 축적이 우려될 수 있다. 또한, US-EPA에서 제공하는 독성 database인 ECOTOX에 등록된 ZU의 독성시험결과는 3건에 불과할 정도로, ZU에 대한 생물독성 연구는 전세계적으로 매우 부족한 상황이므로(US EPA, ECOTOX), 본 연구가 수행되었다.
성게류는 전세계 연안환경 내 조간대 혹은 조하대에서 발견할 수 있는 유용수산생물로, 생식세포의 획득과 인공수정을 통한 배아획득이 쉽고, 배아 발생과정 중 수정란의 분열 및 유생의 골격형성 등을 쉽게 관찰 할 수 있어, 생태독성평가 시험종으로 널리 사용되고 있다(Nacci et al., 1986; Hwang et al., 2014). 특히, 말똥성게(Hemicentrotus pulcherrimus)와 둥근성게(Mesocentrotus nudus)의 경우, 해양환경공정시험법의 해양생물 공정시험방법으로 등록되어 널리 사용중인 시험종이다(Agatsuma, 2001; Hwang et al., 2011; Choi et al., 2020; Hwang et al., 2020).
본 연구에서는 신방오도료물질의 사용으로 건의된 바 있는, 연안환경의 신규 오염물질인 ZU로 인한 해양환경의 오염을 방지하고 보전하기 위하여, 오염물질의 기준농도를 설정하고자 하였다. 이에 국내 연안환경 내 무척추동물을 대표할 수 있는 H. pulcherrimus와 M. nudus의 수정률과 정상배아 발생률에 미치는 ZU의 영향을, EC50 (50% Effective Concentration), NOEC (Non-Observed Effective Concentration), LOEC (Lowest Observed Effective Concentration) 등의 독성값을 나타냈으며, 또한 예측무영향농도(PNEC: Predicted No Effect Concentration) 값을 산출하였다.
재료 및 방법
1. 시험생물 채집
시험생물인 말똥성게(Hemicentrotus pulcherrimus)는 2020년 2월에 전라북도 부안군 격포리 연안(35°38'04"N, 126°27'41"E)에서 채집하여 사용하였으며, 둥근성게는(Mesocentrotus nudus) 2019년 7월 충청남도 태안군 모항리 연안(36°46'38"N, 126°07'26"E)에서 채집하여 사용하였다. 채집한 말똥성게와 둥근성게는 각각 저온 상태로 실험실까지 이송하여 즉시 실험에 사용하였다. 즉시 실험에 사용하지 못할 경우에는 여과해수가 흐르는 유수식 수조에 자연채광조건 및 15±1℃의 온도조건에서 순치한 뒤 시험에 사용하였다.
2. 생식세포 획득
생식세포 획득을 위하여 H. pulcherrimus는 직경 3.5 cm, M. nudus는 직경 10 cm 이상으로 충분히 성장한 성체, 각 6마리 이상을 선별하여 시험에 사용하였다. 선별된 성게의 표면은 mem- brane filter (pore size 0.45 μm)를 사용하여 여과된 자연해수로 세척하여 이물질을 제거한 후, 체강 내에 0.5 M KCl 용액 1 ml을 주입시켜 생식세포의 방란 및 방정을 유도하였다. 방난, 방정이 유도된 성게는 생식공이 충분히 잠기도록 여과해수가 담긴 비이커에 담구어 정자와 난자를 인위방출 시켰다. 수집한 생식세포는 이물질을 충분히 제거하고 세정한 후에 시험에 사용하였다.
3. 대조구 및 시험구의 시험용액 제작
본 시험에 사용된 ZU의 시험농도 범위는 예비실험을 통하여 0~20 mgl-1으로 설정되었다. H. pulcherrimus와 M. nudus의 수정률 및 정상유생 발생률 시험에서 사용된 대조구는 membrane filter (pore size 0.45 μm)로 여과된 자연해수를 사용하였다. 시험용액의 경우, DMSO (Dimethylsulfoxide, Sigma-aldrich, USA)를 carrier solvent로 사용하여, 10,000 mgl-1의 고농도 ZU stock solution을 제작한 뒤, 대조구로 사용된 여과해수로 희석하여 사용하였다. 이때 시험생물에게 노출되는 carrier solvent의 최종 노출농도는 0.1% (NOEC, Non-Observed Effective Concentration) 이하로 노출되도록 조성하였다(Manzo et al., 2006). 시험물질의 기본정보 및 종말점별 시험농도는 Table 1과 같다.
4. 수정률 및 정상유생 발생률
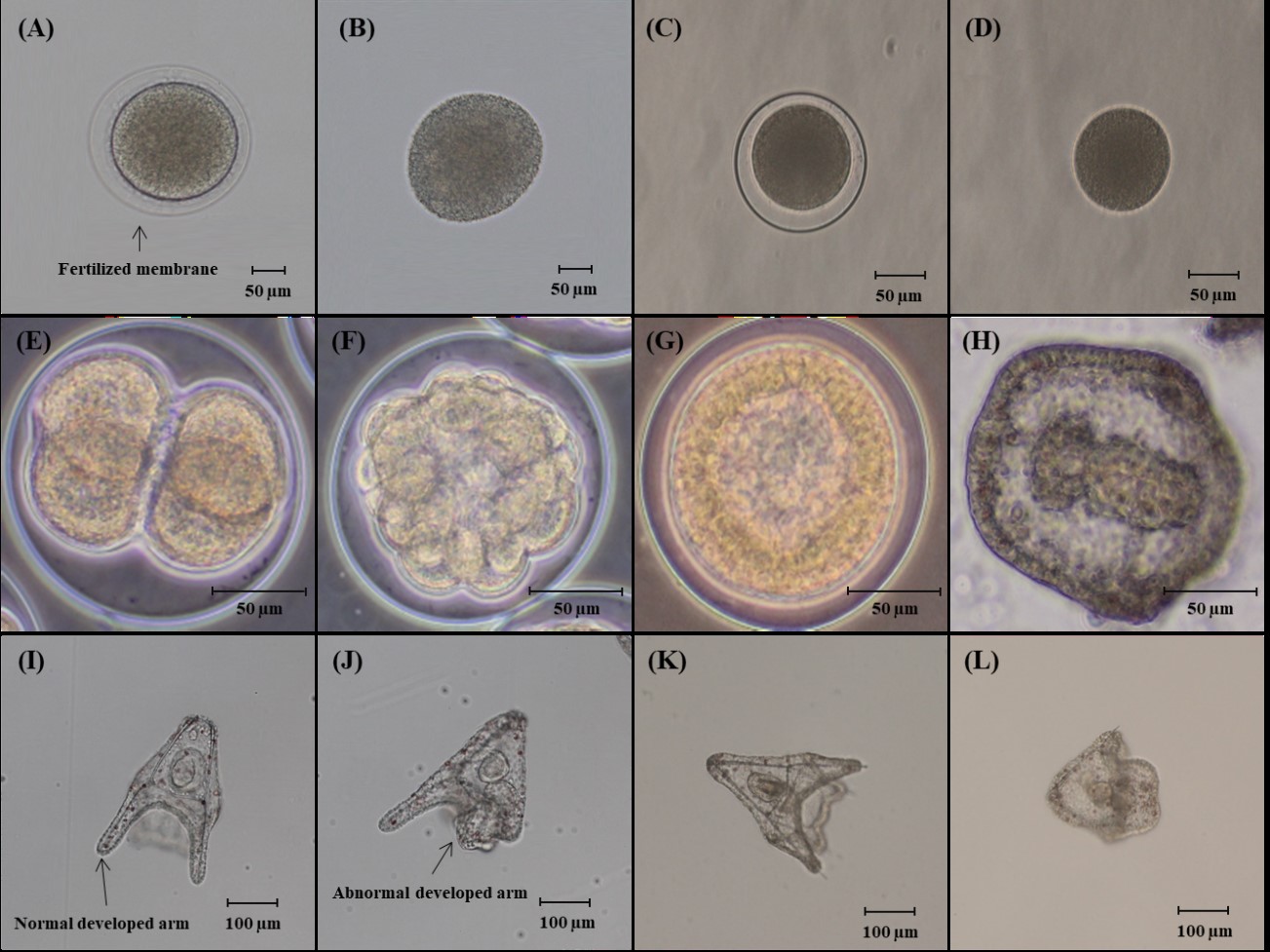
수정률 시험의 경우 농도별로 10 ml씩 분주된 6 well plate에 성게의 정자를 1 μl씩 분주하여 30 min간 노출시켰다. 30 min 이후 well당 100~150개의 난자를 분주하여 10 min 이후 수정막의 형성 유무를 통하여 수정률을 판단하였다(Fig. 1).
정상유생 발생률의 경우 농도별로 10 ml씩 분주된 6 well plate에 ml당 10~15개씩 수정란을 분주하였다. 이 후, H. pulcherrimus는 16±0.5℃, M. nudus는 20±0.5℃의 온도조건, 100±10 μmol photons · m2 · s-1의 광량조건, 8 Light : 16 Dark의 광주기에서 배양하였다. 측정시기는 H. pulcherrimus와 M. nudus가 인공수정 후 pluteus 유생으로 발달되는 시기인 64 h, 48 h에 각각 측정하여 정상유생 발생률을 측정하였다(Hwang et al., 2014). 정상유생 발생은 4-armed pluteus stage 유생의 대표적 형태적 특징인 4개의 arm의 정상발달 유무로서 판단한다(Fig. 1). 본 시험에서 사용된 시험방법은 해양환경공정시험기준의 해양생물공정시험기준 제 25항, 성게를 이용한 해양생태독성 시험방법에 의거하여 수행되었다(Table 2).
5. 통계분석
실험간 유의성 검정은 SigmaPlot 12.0 version (Systat Software, Inc., San Jose, California, USA)의 Student's t-test로 비교 하였으며, p가 0.05 혹은 0.01 이하인 것을 유의한 것으로 판단하였다. 정상유생 발생률에 대한 EC50와 95% 신뢰구간(95% Confidence Interval; 95% Cl)은 Toxicalc 프로그램(Toxicalc 5.0, Tidepool scientific software, USA)의 probit 통계법을 이용하여 분석하였다. NOEC 및 LOEC도 Toxicalc 프로그램의 Dunnett's test를 이용하여 분석하였다.
결 과
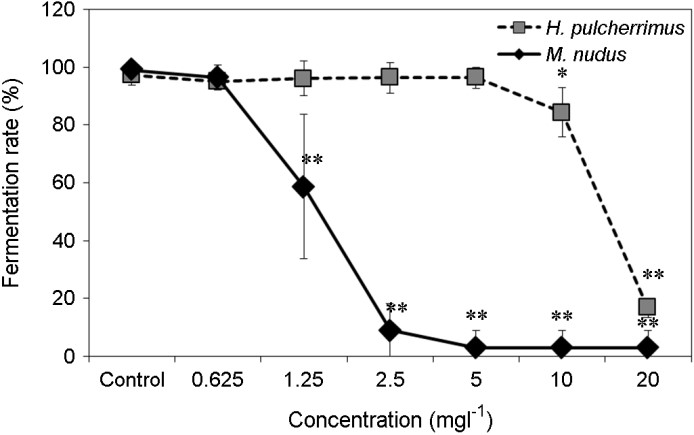
1. 성게류의 수정률에 미치는 Zinc undecylenate의 영향
수정막의 형성 유무로 수정률을 관찰하였으며(Fig. 1. B, D) 대조구에서는 90% 이상의 수정률이 관찰되었으나, ZU의 경우 시험농도 0~20 mgl-1 내에서 농도 의존적인 성게 수정률의 감소가 관찰되었다(Fig. 2). H. pulcherrimus의 경우 10 mgl-1에서 84.33% (±8.75) 로 감소가 나타나며(p < 0.05), 20 mgl-1에서는 16.67% (±3.27)로 감소하였다(p < 0.01). 또한, M. nudus의 경우 1.25 mgl-1에서 58.67% (±4.28)로 감소가 나타나며(p < 0.01), 2.5 mgl-1에서는 9.0% (±8.98)로 수정률의 감소가 나타났다(p < 0.01).
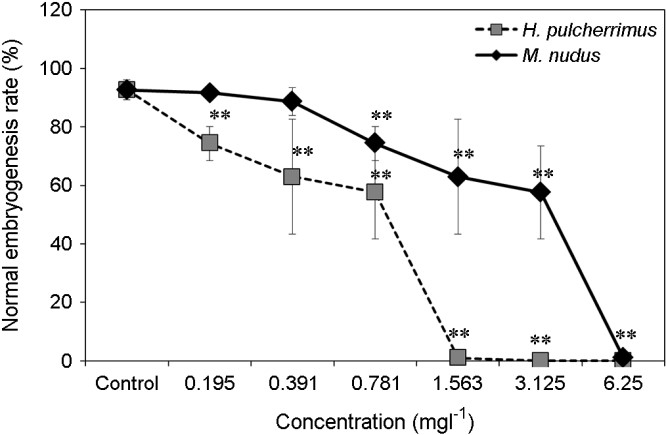
2. 성게류의 정상배아 발생률에 미치는 Zinc unde- cylenate의 영향
H. pulcherrimus와 M. nudus의 정상배아 발생률에 미치는 ZU의 영향을 확인하기 위하여 0.195 mgl-1, 0.391 mgl-1,
0.781 mgl-1, 1.563 mgl-1, 3.125 mgl-1, 6.25 mgl-1에서 각각 64 h과 48 h 동안 노출시킨 후, 정상 pluteus 유생의 발생을 관찰하여 백분율로 나타내었다(Fig. 3). 일반적으로 유해물질에 성게의 수정란이 노출되면 정상적으로 발달하지 못하며, pluteus 유생의 외형에 기형이 나타났다(Fig. 1. J, L). 실험결과, 두 성게종 모두의 대조구에서 90% 이상의 정상 pluteus 유생의 발생이 관찰되었으며, 농도가 증가함에 따라 농도 의존적으로 정상유생 발생률의 감소가 관찰되었다. H. pulcherrimus의 경우 0.195 mgl-1부터 정상유생 발생률이 74.33% (±5.81)로 정상 pluteus 유생 발생의 저해가 시작되어(p < 0.01), 1.563 mgl-1부터 정상 pluteus 유생이 관찰되지 않았으며(p < 0.01), M. nudus의 경우 0.781 mgl-1부터 74.67% (±5.70)으로 감소하기 시작하여(p < 0.01), 최고농도인 6.25 mgl-1에서 정상 pluteus 유생이 관찰되지 않았다(Fig. 3).
3. 독성파라미터
ZU에 대한 H. pulcherrimus와 M. nudus의 10 min-수정률 EC50 값은 각각 11.27 mgl-1과 1.48 mgl-1로 나타났다. 무영향농도(NOEC: Non-observed effective concentration)는 각각 5 mgl-1와 0.63 mgl-1로 나타났으며, 최소영향농도(LOEC: Low-observed effective con- centration)는 10 mgl-1와 1.25 mgl-1로 나타났다. 또한, H. pulcher- rimus와 M. nudus의 정상배아 발생률의 EC50 값은 각각 0.94 mgl-1와 3.78 mgl-1로 나타났다. 무영향농도는 각각 0.20 mgl-1와 0.78 mgl-1로 나타났으며, 최소영향농도는 0.39 mgl-1와 1.56 mgl-1로 나타났다. 해양생물 3종 급성독성값 문헌조사를 통한 예측무영향농도(PNEC: Predicted No Effect Concentration)의 경우 0.0094 mgl-1로 나타났다(Table 3).
고 찰
성게는 연안 암반에 부착하여 생활하며, H. pulcherrimus는 조간대의 얕은 수심에서 주로 서식하고, M. nudus는 조하대의 깊은 수심에서 해조류를 주로 섭취하는 생태계 내에서 1차 소비자 역할을 담당하는 무척추동물이다(Hwang et al., 2020; Choi et al., 2020).
EC50 값을 기준으로 H. pulcherrimus에서는 64 h-정상배아 발생률이 수정률에 비하여 약 10배 이상 민감하게 나타났으나, M. nudus에서는 10 min-수정률이 정상배아 발생률에 비하여 2배 이상 민감한 것으로 나타났다(Table 3). 지금까지 성게류를 이용해 연구된 다양한 오염물질에 대한 생태독성 시험결과, 일반적으로 분화가 진행되는 배아 발생시기의 민감성이 수정란 시기보다 높은 것으로 알려져 있으나(Hwang et al., 2020; Choi et al., 2020), 본 연구에서 도출된 M. nudus의 독성값은 분화 이전인 수정란 단계에서 더 민감한 것으로 나타났다. Zinc와 Undecylenate가 결합된 형태의 ZU는 아연의 활성보다는 이온화된 undecylenate가 강한 활성을 나타내지만(Bourne et al., 1999), Zinc의 국소적인 농도 변화는 생물체 내에서 다양한 역할을 하는 효소에 영향을 주어 생물의 생리활성을 강화시키거나, 독성의 변화를 유도할 수 있다(Lansdown, 1991; Keller and Mann, 1940). 또한, 생물종의 생리 · 생태학적인 특이성에 의하여 독성민감성에 차이가 나타날 수 있을 수 있기에(Yu, 1998), 위와 같은 결과가 나올 수 있을 것이라 사료된다.
ZU에 대하여 생태독성시험이 수행된 경우는 거의 없으며(US EPA, ECOTOX), 해양생물종으로는 1차 소비자를 대표하는 성게류 2종 H. pulcherrimus, M. nudus와 생태계 내 생산자를 대표하는 규조류(Skeletonema costatum), 1차 소비자인 윤충류(Brachionu plicatilis)에 관한 연구가 진행되었다(Hwang et al., 2018; Lee et al., 2019). ZU에 대한 S. costatum의 96 h-개체군성장률 EC50 값은 16.95 mgl-1로 나타났으며(Lee et al., 2019), B. plicatilis의 72 h-개체군성장률 EC50 값은 26.4 mgl-1로 나타났다(Hwang et al., 2018). 독성값을 비교하며, 성게류 H. pulcherrimus와 M. nudus는 S. costatum과 B. plicatilis보다 ZU에 대한 독성민감성이 높은 것으로 나타났으며, H. pulcherrimus의 64 h-정상유생 발생률은 모든 생물종의 종말점 중에 가장 민감하게 나타나, ZU의 생물독성을 판단하기에 가장 민감한 지표인 것으로 보인다. 또한 H. pulcherrimus의 정상유생 발생률에 대한 NOEC 값은 0.2 mgl-1로, 가장 낮은 값을 나타내었다(Table 3).
해양생태계 보호를 위한 Predicted No Effect Concentration (PNEC)는 일반적으로 생태독성자료의 질과 양에 따라 확률론적 방법과 결정론적 방법으로 나누어 적용될 수 있다. ZU의 경우 생태독성평가의 결과가 전무한 수준이므로, 가용한 생태독성자료 중 가장 민감한 H. pulcherrimus의 64 h-정상유생 발생률을 대상으로 하는 결정론적 방법을 활용하였다(Ministry of Environment, 2016; Ryu et al., 2018). 또한, 가용한 모든 자료의 생태독성평가결과값이 급성독성값만 존재하므로, 안전계수(AF)값 100을 적용하여 PNEC 값을 산출하였다(Ministry of Environment, 2016). 산출 결과, PNEC 값은 0.0094 mgl-1으로 나타나(Table 3), 해양생태계 내에서 ZU이 0.0094 mgl-1 이상으로 존재하면, 해양생물에게 영향을 미칠 수 있다고 보인다. 하지만, ZU의 경우 수용해도가 0.124 mgl-1로 낮은 편이고, PNEC 값을 산출하기 위한 AF 값이 보수적으로 설정되었기에, 산출된 PNEC 값보다 실제 영향농도가 더 낮을 수 있다.
본 연구에서는 의약품을 포함하여 다양한 목적으로 사용되며, 신방오도료로서의 가능성이 확인된 바 있는 Zinc undecylenate을 이용해 연안환경 내 1차 소비자를 대표할 수 있는 성게 2종(H. pulcherrimus, M. nudus)에 대한 생태독성평가를 수행하였다. 추가적으로 해양환경과 연안환경에 서식하는 다양한 생물종을 대상으로, ZU의 안전수준을 알 수 있는 예측무영향농도를 산출하였다. 위와 같은 결과는 해양환경 오염물질에 대한 환경 보호전략 수립을 위한 기초자료로 활용될 것이다.
- References
-
-
22. Jung SM. 2012. Development of new antifouling systems based on nontoxic self - polishing copolymer coatings. Soon Chun Hyang University.
-
29. Ministry of Environment. 2016. Guidelines for procedure and methodology for risk assessment of environmental hazardous factors. Established rule-585.
-
33. OSPAR. 2010. Assessment of the Impact of Shipping on the Marine Environment. Quality Status Report 2010. OSPAR Commission, London, UK.
-
40. Yonehara Y. 2000. Recent topics on marine antifouling coatings. Bull Soc Sea Water Sci Jpn 54: 7-12.
-
41. Yu CM. 1998. A study on the effect of heavy metals on embryos formation of sea urchins. Kor J Env Hlth Soc 24: 6-10.














