JMLS 2020 December;5(2):35-42. http://jmls.or.kr Epub 2020 December 16
Copyright © 2020 by The Korean Society of Marine Life Science
Effect of 17β-estradiol on Ecdysteroid Pathway Related Genes in the Brackish Water Flea Diaphanosoma celebensis
Soyeon In; Department of Biotechnology, College of Convergence Engineering, Sangmyung University, Seoul 03016, Korea
Jewon Yoo; Department of Biotechnology, College of Convergence Engineering, Sangmyung University, Seoul 03016, Korea
Hayoung Cho; Department of Biotechnology, College of Convergence Engineering, Sangmyung University, Seoul 03016, Korea
Young-Mi Lee; Department of Biotechnology, College of Convergence Engineering, Sangmyung University, Seoul 03016, Korea
- Abstract
17β-estradiol (E2)는 난소로부터 방출되는 호르몬으로 가정 및 축산 오폐수에 포함되어 환경으로 지속적으로 유출된다. E2는 높은 에스트로겐 활성을 가지고 있어 갑각류의 발달과 생식에 영향을 미치는 내분비계교란물질로 알려져 있다. 갑각류의 발달은 탈피호르몬(ecdysteroid)의 신호 전달 과정에 의해 이루어지지만 E2가 소형 갑각류의 탈피호르몬 경로 유전자를 어떻게 조절하는지에 대한 연구는 매우 미흡하다. 본 연구에서는 기수산 물벼룩 Diaphanosoma celebensis에서 E2에 대한 급성 독성 시험을 통해 24-h LCx 값을 도출하였고, E2 노출에 따른 탈피호르몬 경로에 관여하는 7개의 유전자(CYP314a1, EcRA, EcRB, USP, ERR, Vtg, VtgR)의 시간별 발현 변화를 quantitative real time polymerase chain reaction (qRT-PCR)을 이용하여 분석하였다. D. celebensis의 24-h LC50 값은 9.581 mg/l (95% C.I.: 7.697~11.927 mg/l), 24 h-LC10 값은 4.842 mg/l (95% C.I.: 3.683~6.366 mg/l)로 나타났다. CYP314a1, EcRA, USP, VtgR 유전자의 발현이 12시간 또는 24시간에 유의하게 증가하는 양상을 보였다. 이러한 결과는 E2가 D. celebensis의 탈피호르몬 경로에 관련하는 유전자의 발현을 조절함으로써 탈피와 생식에 영향을 미칠 수 있을 것임을 시사한다. 본 연구는 소형 갑각류에서 내분비계교란물질이 탈피 경로에 미치는 영향에 대한 분자 기전을 이해하는데 도움이 될 것이다.
17β-estradiol (E2) is a natural hormone secreted by ovary, and continuously discharged from household and livestock wastewater into aquatic environment. Due to its strong estrogenic activity, it has adverse effects on development and reproduction in crustacean as an endocrine disrupting chemical. Although ecdysteroid signaling pathway play a key role in development in crustacean, little information on transcriptional modulation of ecdysteroid-related genes in response to E2 is available in small crustacean. Here, we investigated the acute toxicity of E2 to obtain 24-h LCx values in the brackish water flea Diaphanosoma celebensis. Time-dependent expression patterns of seven ecdysteroid pathway - related genes (CYP314a1, EcRA, EcRB, USP, ERR, Vtg, VtgR) were further examined using quantitative real time reverse transcriptase polymerase chain reaction (qRT-PCR). As results, 24-h LC50 and LC10 values were 9.581 mg/l and 4.842 mg/l, respectively. The mRNA expression of CYP314a1, EcRA, USP, VtgR was significantly up-regulated at 12 or 24 h after exposure to E2. These findings indicate that E2 can affect their molting and reproduction by modulating the expression of ecdysteroid pathway - related in D. celebensis. This study will be useful for better understanding of molecular mode of action of endocrine disrupting chemicals on molting process in small crustacean.
Keywords: 17β-estradiol(에스트라디올) Endocrine disrupting chemicals(내분비계교란물질) Ecdysteroid(탈피호르몬) Brackish water flea(기수산물벼룩) Acute toxicity(급성독성) Gene expression(유전자 발현)
Correspondence to: Young-Mi Lee; Department of Biotechnology, College of Convergence Engineering, Sangmyung University, Seoul 03016, Korea; E-mail : ymlee70@smu.ac.kr
- Received
- 15 July 2020;
- Revised
- 29 July 2020;
- Accepted
- 13 August 2020.
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Language: Korean/English,
Full Text:

서론
생물의 정상적인 내분비계를 교란시키는 화학물질을 통칭하여 내분비계교란물질(Endocrine disrupting chemicals; EDCs)로 정의한다. EDCs는 호르몬의 생성 및 작용 과정에 영향을 미침으로써, 생물의 정상적인 발달 및 생식 과정을 지연시키거나 촉진시키는 것으로 알려져 있다. EDCs에 속하는 물질은 크게 두 가지 종류로 나뉜다. 하나는 인간을 포함한 생물의 체내에서 자연적으로 발견되는 에스트로겐, 프로게스테론 및 테스토스테론을 포함하는 천연호르몬이며, 다른 하나는 산업에서 사용되도록 제작된 인공 화학물질들이다(Jaffrezic-Renault et al., 2020). 이러한 ECDs에 의한 지속적인 내분비계 교란 과정은 인간을 포함하는 포유류, 조류, 어류, 절지동물 등의 발달을 지연시키거나, 생식 과정에 영향을 미쳐 결과적으로 개체군의 감소를 초래할 수 있다(Esplugas et al., 2007).
17β-estradiol (E2)는 난소로부터 방출되는 천연 내재성 호르몬으로, EDCs에 속하는 의약품들의 중요한 화합물 뿐만 아니라, 살충제 및 동물 사료의 첨가제로서 사용된다(Elnwishy et al., 2012). 때문에 가축 폐기물과 가정용 폐수 등 다양한 경로를 통해 방출되어 자연 수역에 분포되어 있다(Forghani et al., 2020). E2는 높은 에스트로겐 활성을 가지고 있기 때문에 ng/l로 매우 낮은 농도로 존재하더라도 호르몬 작용을 야기할 수 있어 유럽 연합의 Water Framework Directive (WFD)에 에스트로겐 우선 오염물질로 등록되어 있다(Dai and Liu, 2017Dai and Liu, 2017).
E2는 핵 수용체(nuclear receptors, NRs) 중 estrogen receptor (ER)과 결합하여 발달 및 생식에 영향을 미친다(Welshons et al., 2003). 갑각류(Crustacean)에서 E2와 같은 성호르몬이 생식소 발달 교란, 암컷의 생식능력 감소, 비텔린의 양 감소 등 영향을 미치는 것으로 알려져 있다(Segner et al., 2003; Ghekiere et al., 2006). 그러나 갑각류는 ER 대신 estrogen-related receptor (ERR)가 존재하며(Thornton, 2003), 척추동물의 ER의 서열과 유사성이 높아 생식 과정에 관여하는 것으로 추정되어지나 구체적인 기능에 대해서는 보고된 바가 없다(Giguère, 2002).
갑각류의 발달은 탈피(molting)이라고 불리는 새로운 외골격을 형성함으로써 이루어지며, 이는 탈피호르몬(ecdysteroid)의 신호 전달 과정에 의해 이루어진다(Gismondi, 2018). CYP314a1은 ecdy- sone 호르몬을 20-hydroxyecdysone (20E)으로 변환하는데 관여하는 유전자이며(Rewitz et al., 2010), ecdysteroid receptor (EcR)과 ultraspiracle (USP)는 heterodimer를 형성하여 20E를 핵 내에 수송하는 과정을 담당하는 유전자로 탈피호르몬의 신호 전달 경로에 대한 지표로 사용된다(Christiaens et al., 2010). 또한 생식 과정은 vitellogenesis라고 불리는 난모 성숙 과정으로 vitellogenin (Vtg)이 난모세포 막에 존재하는 vitellogenin receptor (VtgR)와 결합하는 단계를 통해 이루어진다(Tufail and Takeda, 2009). Vitellogenesis 과정은 내분비계를 조절하며 탈피호르몬 신호 전달 경로와도 밀접한 관련이 있다는 것이 보고되었다(Tokishita et al., 2006). 여러 연구를 통해 estrogenic compounds에 노출된 많은 척추 및 무척추 생물의 수컷에서 vitellogenin의 양이 증가하기 때문에 내분비계 장애에 대한 주요 분자지표로 이용되어 왔다(Matozzo et al., 2008; Xuereb et al., 2011; Hara et al., 2016) 그러나 갑각류에서는 이에 대해 여전히 논란이 있어 추가적인 연구가 필요하다.
갑각류 중 지각목(Cladoceran)은 수생 생태계에서 먹이 사슬의 일차 소비자로, 생산자와 상위 포식자를 연결해주는 역할을 담당하고 있다. 본 연구에 사용된 Diaphanosoma celebensis는 기수산 물벼룩으로서 열대 아시아에 널리 분포하는 소형 갑각류이다. 광범위한 염분 농도에 서식하여, 해양 및 연안의 환경을 연구하기에 적합하다. 크기가 작고, 다음 세대까지의 시간이 4~5일 정도로 짧아 실험실 배양이 쉽고, 유지가 용이하다. 또한, 단성 생식을 하기 때문에 개체간 유전적 동일성이 높아 독성 평가에 사용하기에 적합하다(Marcial and Hagiwara, 2007). 이전 연구를 통해 확보된 D. celebensis 전사체 데이터베이스로부터 ecdystroid signaling pathway 관련 유전자들을 탐색하여 동정하였고, 대표적인 내분비계교란물질인 bisphenol ananlogues에 의한 이들 유전자의 전사 조절을 확인함으로써 탈피에 영향을 미칠 수 있음을 보고한 바 있다(Kim et al., 2018; IIn et al., 2019, 2020).
따라서 본 연구에서는 기수산 물벼룩 D. celebensis에 E2를 노출시켜 급성 독성을 조사하였고, 탈피 및 생식과 관련된 대표적인 유전자들(CYP314a1, EcRs, USP, ERR, Vtg, VtgR)의 발현을 확인하였다. 본 연구는 갑각류의 탈피와 생식 기전에 E2가 미치는 영향에 대해 분자적 수준에서 이해하는데 도움이 될 것이다.
재료 및 방법
1. 시험 생물 배양
본 연구에서 실험 생물로 사용한 Diaphanosoma celebensis는 한국해양과학기술원(KIOST) 이균우 박사에게 분양 받아, 상명대학교 융합공과대학 생명공학과 분자독성학 실험실에서 배양하고 있는 것을 사용하였다. 생물은 여과된 15 psu 인공해수(Instant ocean, France)에서 25±1℃, 12시간 : 12시간(light : dark) 광주기로 배양하였다. 배양 먹이는 Chlorella vulgaris를 4.0 - 4.5 × 108 cells/l 씩 매일 제공하였다.
2. 시험물질
본 연구에서 사용된 17β-estradiol을 포함한 모든 시약은 특별한 언급이 없는 한 Sigma-Aldrich Co. (St. Louis, Mo, USA)으로부터 구매하여 사용하였다. 실험을 위해 DMSO를 solvent로 사용하여 stock (12.5 mg/ml)을 제조하였으며, 제조한 stock은 -20℃에 보관하여 실험에 사용하였다.
3. 물질 노출 시험
급성 독성 시험은 OECD test guideline 202를 수정하여 진행하였다. D. celebensis는 4일차 개체 5마리를 5 ml의 시험 용액과 함께 six-well cell culture plate (SPL, Korea)에 넣어 시험하였으며, 4반복으로 진행하였다. 실험 조건은 배양 조건과 마찬가지로 12 h : 12 h (light : dark) 주기로, 25℃±1에서 진행하였으며, 17β-estradiol (0 to 10 mg/l)를 48시간 처리하여 유영 저해를 확인하였다. 유영 저해는 육안으로 확인하였으며, 10초 간 가라 앉아 있거나, 안테나는 움직이지만 유영을 하지 못하는 것을 유영 저해로 판단하였다. 실험 결과는 ToxRat® Professional software를 사용하여 95% confidence limits (C.L.) 값을 포함하는 half maximal effect concen- tration (EC50) 값으로 얻었다.
노출시간에 따른 유전자 발현 분석을 위하여, 250 ml 비커에 1/2 24-h LC10 (2.5 mg/l)의 시험 용액 200 ml를 넣고, 4일차 개체를 200마리씩 넣어주었다. 노출 시험의 농도는 24 h EC10 값에 해당하는 값을 2배 희석하여 처리하였으며 0 h, 6 h, 12 h, 24 h 노출시켰다. 노출 시험에서 DMSO의 최종 농도는 D. celebensis의 mortality가 확인되지 않은 0.05%로 사용하였으며(data not shown), 시험기간 동안 먹이는 제공 하지 않았다.
4. Total RNA 추출 및 cDNA 합성
시험물질에 노출된 생물을 모으고, 5배 용량의 TRIzol reagent (Thermo Fisher Scientific Inc., USA)를 넣어 균질화 하였다. 추출된 RNA의 정성 분석은 1% agarose gel에서 전기영동 Chemidoc (Bio-rad Inc., CA, USA)을 이용하여 확인하였고, 정량 분석은 Nano drop (Maestrogen, Taiwan)을 이용하였다. cDNA 합성은 0.5 μg의 total RNA를 이용하여 ReverTra Ace® qPCR RT Master Mix (Toyobo Corp. Ltd, Japan)의 제조자 방법에 따라 합성하였다.
5. Quantitative real-time reverse transcriptase poly- merase chain reaction (qRT-PCR)
qRT-PCR 진행 전에 PCR 반응의 효율을 확인하기 위하여 effi- ciency test를 진행하였으며, 그 결과 efficiency (E) 값이 90~105%, R2 결과가 0.98 이상인 sample만을 사용하였다(data not shown). 모든 PCR 반응은 제조한 cDNA를 1/10으로 희석하여 2 μl, primer set (Table 1) mixture 2 μl를 사용하였으며, PCR 조건은 다음과 같다. 95℃/10 min; 40 cycles of 95℃/15 s, 60℃/1 min. 반응이 끝난 후 특정한 산물의 증폭을 확인하기 위하여 60℃에서 95℃로 1 sec마다 0.5℃씩 증가시켜 melting curve를 확인하였다. SYBR mastermix (KAPA Bioassay system, USA)는 특정한 PCR 산물을 확인하기 위해 사용하였고, SYBR green - labeled products의 증폭 및 탐지는 CFX96TM real-time PCR system (Bio-Rad Inc., USA)을 이용하여 수행되었다. 각 실험에서 얻은 유전자 발현 결과를 normalization하기 위하여 D. celebensis의 18S rRNA를 reference gene으로 이용하였다. 측정된 Ct (threshold cycle) 값을 이용하여 2-△△Ct 방법에 따라 fold-change 값을 분석하여 상대적인 유전자 발현 정도를 계산하였다(Livak and Schmittgen, 2001).
6. 통계분석
모든 실험은 3반복으로 진행하였으며, 실험값은 평균 ± 표준편차(Mean ± S.D.) 값으로 표시하였다. 유전자 발현의 통계 분석은 일원배치 분산분석(One-way ANOVA)으로 분석하였다. 분석 프로그램은 IBM SPSS statistics 21 (SPSS Inc, USA)를 사용하였으며, 그래프를 가시화하기 위하여 SigmaPlot 12.0을 사용하였다. p < 0.05일 때 유의 하다고 판단하였다.
결 과
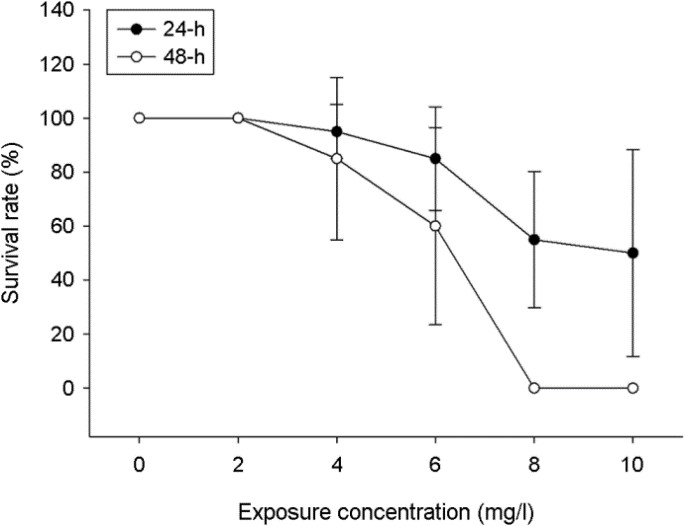
1. E2 노출에 따른 급성 독성
본 연구에서는 E2에 24 h 노출된 기수산 물벼룩 D. celebensis에서 생존률이 농도 의존적으로 감소하는 것을 확인하였다(Fig. 1). 이 결과를 기본으로 24-h LC10 값은 4.930 mg/l였고, 24-h LC50 값은 9.448 mg/l로 계산되었다(Table 2). 또한 48-h LC10 값은 4.125 mg/l, 24-h LC50 값은 5.639 mg/l로 각각 결정되었다(Table 2).
2. E2 노출에 따른 유전자 발현 결과
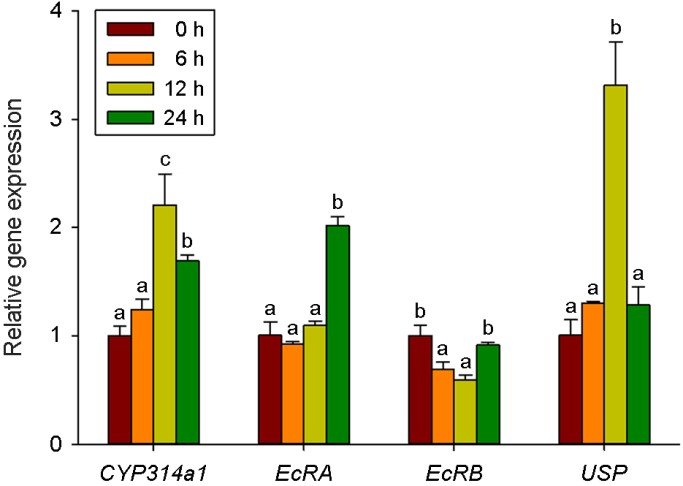
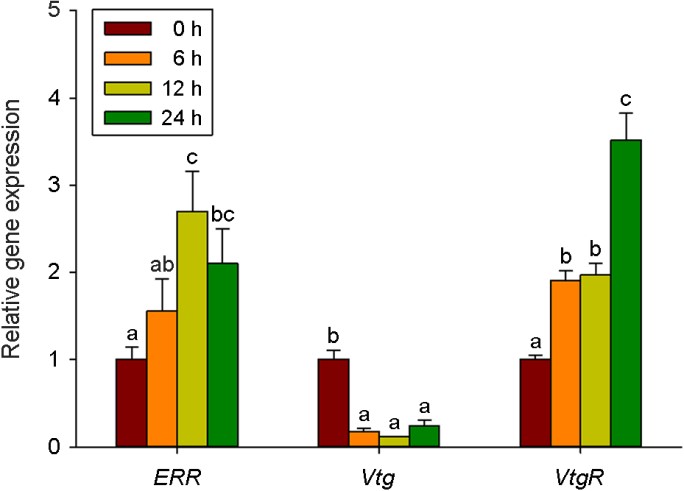
E2에 의한 시간별 유전자 발현 변화를 조사하기 위하여, D. celebensis에 E2 (2.5 mg/l)를 0 h, 6 h, 12 h, 24 h 동안 처리하였다. 탈피가 일어난 것으로 확인되는 24 h(5일)을 기준으로 하였을 때, CYP314a1과 USP, ERR 유전자의 발현이 12 h 전에 약 2.5배 이상의 유전자 발현량이 증가하였다(Fig. 2와 3). 반면, EcRA는 24 h에 약 2배의 발현량 증가를 나타내었으며, EcRB는 약간의 감소를 나타낼 뿐, 시간에 따라 발현량이 증가하지 않았다(Fig. 2). Vtg는 유의한 감소가 모든 시간에서 관찰되었으며, VtgR는 시간이 지남에 따라 유전자 발현이 증가하다가 24 h에서 가장 높은 발현량(약 3.5배 증가)을 나타내었다(Fig. 3).
고 찰
17β-estradiol (E2)는 산업 활동을 통해 환경에 꾸준히 유출되어, 환경 오염물질로 정의되지만, 대부분의 환경 오염을 야기하는 EDCs에 대한 연구는 산업용 화학물질에 집중되어 있어, 상대적으로 천연호르몬에 대한 독성 작용 메커니즘에 대한 연구는 부족하다. 본 연구에서 E2를 D. celebensis에 24 h 노출시킨 결과 LC50 값은 9.448 mg/l (95% C.I.: 7.697~11.927 mg/l)로 나타났다(Fig. 1). 이러한 결과는 adult D. celebensis에 E2 노출 시 24-h LC50 값이 10.37 mg/l로 나타났다고 보고한 Marcial과 Hagiwara (2007)의 연구와 유사하였다. 담수산 물벼룩의 경우 24 h-LC50 값이 3.67 mg/l로 나타나 E2에 대해 민감도가 D. celebensis에서 좀 더 낮다고 볼 수 있다(Brennan et al., 2006). E2에 대한 LC50 값은 다른 무척추 생물에서 잘 알려져 있지 않지만 여러 연구를 통해 ng/l - μg/l 수준의 E2가 소형 무척추 생물의 생식에 영향을 미칠 수 있다는 것이 보고된 바 있다. 예를 들어, 담수산 요각류인 Brachionus calyciflorus Pallas에 E2 노출 시 최대 100~1,000 μg/l에서 gener- ation time이 증가하고, 순 생식률이 증가하는 효과를 나타내었다(Huang et al., 2012Huang et al., 2012). 또한 E2에 노출한 D. celebensis에서도 10~ 1,000 μg/l에서 첫 번째 생식 시기가 빨라지고, fecundity가 증가하는 양상을 나타내었다(Marcial and Hagiwara, 2007).
Segawa와 Yang (1990)에 따르면, D. celebensis의 경우 성숙 이전에는 하루에 한번씩 탈피가 일어나며, 성적 성숙 이후부터는 2일에 한번씩 탈피하는 것으로 보고된 바 있다. 예비 실험을 통해 D. celebensis는 약 4일에 첫 번째 neonates를 방출하며, 탈피 주기는 5일과 7~8일 사이에서 관찰된 바 있다(data not shown). In 등 (2019)은 태어난 후 4~9 days 동안 D. celebensis에서 cyp314a, EcRA, EcRB, 그리고 USP 유전자의 발현 변화 분석을 통해 이들 유전자가 D. celebensis의 탈피 주기와 일치하는 경향을 보여 탈피 경로와 관련되어 있음을 입증한 바 있다. 또한 ERR, Vtg, VtgR 유전자의 발생 주기별 발현 양상이 D. celebensis의 생식 주기와 일치하는 것을 확인한 바 있다(In et al., 2020). 본 연구에서 1/2 24-h LC10의 E2에 노출된 후 D. celebensis의 cyp314a1, USP, ERR 유전자 발현이 12시간에 가장 높았으며, EcRA와 VtgR의 유전자 발현은 24시간에 가장 높게 나타났다(Fig. 2). 갑각류에서 ecdysteroid는 탈피 전에 증가하기 시작해서 탈피 직전에 가장 증가하며, 탈피와 탈피 사이 그리고 탈피 이후에는 낮게 유지된다고 알려져 있다(Martin-Creuzburg et al., 2007Martin-Creuzburg et al., 2007). CYP314a의 산물인 E20-hydroxylase는 전사 단계에서 조절되며 20E (20-hydroxyecdysone) 생산에 관여한다(Maeda et al., 2008). 본 실험에서 태어난 지 4일째 된 개체에 노출시켰기 때문에 E2 노출 후 24시간이 되면 D. celebensis가 탈피 시기(5일차)에 접어들게 된다. 정상적인 발달 과정에서는 In 등 (2019)의 결과에서처럼 CYP314a1 유전자의 발현량은 탈피가 시작되는 5일째에 가장 높은 peak(약 2.4배)를 보이게 된다. 그러나 E2 노출에 의해 CYP314a1의 전사량이 12시간째에 가장 높게 나타나고 24시간째에는 오히려 1.5배 정도로 감소하는 경향을 보인다. Huang 등 (2012)은 Brachionus calyciflorus에 E2를 노출시켰을 때 배 발생 단계가 단축되고, juvenile 시기와 생식 주기가 길어졌다고 보고한 바 있다. 한편 Marcial와 Hagiwara (2007)는 D. celebensis에 E2를 노출시킨 결과 첫 생식 시기가 빨라지고, fecun- dity가 증가한 것으로 나타났다. 탈피는 갑각류의 성장, 발생, 변태 및 생식에 중요한 단계이다(Lafont and Mathieu, 2007). 본 연구에서는 이러한 개체 수준에서의 발생과 생식에 미치는 영향을 관찰하지는 못했으나, 이전 연구를 통해 탈피를 조절하는데 관여하는 유전자의 발현 증가가 E2에 의해 빨라진 것이 D. celebensis의 탈피 주기를 조절함으로써 생식이나 발생에 영향을 미칠 수 있음을 시사한다.
EcR은 USP와 결합하여 ecdysteroid를 세포질에서 핵으로 이동하는데 관여한다. 이전 연구들을 통해서 EcRA는 성체의 발달과 관련이 있는 반면, EcRB는 유생 시기에 탈피 과정과 관련이 있다고 알려져 있다(Kato et al., 2007). 본 연구에서도 EcRB는 유전자 발현이 초기에 억제되다가 24시간에 대조군 정도로 회복되는 반면, EcRA는 24시간에 증가하는 양상을 보였다. 증가된 양은 In 등 (2019)에서 보고되었던 4일차 대비 5일차의 발현량에 비해 본 실험에서 E2 노출 후 약 2배 증가하는 양상을 보여 이러한 발현량의 차이가 E2 노출에 의한 것으로 추정할 수 있다. Kato 등 (2007)은 2개의 EcR과 USP 간의 결합은 탈피 과정 동안 달라질 수 있다고 제시한 바 있어 향후 D. celebensis의 생식과 발생 과정 중 EcRA와 EcRB의 역할은 좀 더 연구가 필요하다. 본 연구에서 E2 노출에 따른 EcRA와 USP 유전자의 발현 패턴이 정상적인 발생 과정에서의 발현 패턴과 다르게 나타난 것으로 보아 E2에 의해 탈피 과정이 영향을 받을 수 있음을 시사한다.
정상적인 발생 과정 동안 D. celebensis ERR 유전자는 4일 대비 5일차에 2배 정도 발현량이 증가하였으며, 유사한 패턴이 VtgR에서도 관찰된 바 있다(In et al., 2020). 또한 동 실험에서 Vtg는 4~5일 사이에 거의 변화가 없었다. 본 실험에서 E2에 노출된 후 D. celebensis ERR 유전자의 발현 량은 12시간 이후 2.5배 이상 증가하였으나, 24시간(5일차)에는 2배 정도로 감소하여 E2에 의한 영향을 파악하기 어려웠다(Fig. 3). 실제로 E2에 노출된 Mytilus의 ERR 유전자의 발현이 유의한 영향을 보이지 않은 것으로 나타나 ERR이 E2에 반응하지 않는다고 제시한 바 있다(Nagasawa et al., 2015Nagasawa et al., 2015). 그러나 E2와 마찬가지로 ER과 결합하는 것으로 알려진 bisphenol A에 노출된 D. celebensis에서 ERR 유전자가 유의하게 증가하는 양상을 보였으며, 이와 같은 경향은 다른 무척추 생물에서도 관찰되었다(Chen et al., 2016; Herrero et al., 2018; In et al., 2020). 이러한 결과는 E2과 ERR의 관계뿐 아니라 물벼룩류에서 ERR의 기능에 대해 좀 더 연구될 필요가 있음을 시사한다.
한편 VtgR은 24시간에 3.5배까지 증가하여 E2 노출 후 발현량이 높아진 양상을 보였으나, Vtg 유전자의 양은 오히려 E2 노출 후 현저히 감소된 양상을 보였다(Fig. 3). 무척추동물에서 Vtg는 VtgR과 결합하여 생식소로 이동하며, 난 발생과 생식 조절에 관여한다(Ali et al., 2017). Vtg와 VtgR의 서로 다른 유전자 발현 양상과 관련해서는 Vtg 합성 전에 VtgR의 전사가 먼저 일어나는 Ali et al., 2017것으로 알려져 있다(Dominguez et al., 2012). Vtg는 척추동물의 수컷에서 EDCs에 노출 후 그 발현량과 단백질 양이 증가하는 성 특이적인 발현 양상을 통해 잘 알려져 있는 biomarker이지만, 갑각류에서는 생물의 종과 성별 및 발생 단계에 따라 반응이 다양해서 ECDs에 대한 적합한 biomarker가 아니라는 논쟁이 있다(Boulangé-Lecomte et al., 2017Boulangé-Lecomte et al., 2017). E2에 노출된 grass prawn Palaemon elegans larvae에서는 Vtg 단백질이 감소하는 경향을 보였으며(Sanders et al., 2005), 4-nonyphenol에 대해서도 D. magna 암컷은 Vtg 단백질 양이 증가한 반면(Hannas et al., 2011), littoral crab Carcinus maenas 수컷에서는 변화가 없었다(Lye et al., 2008). Bisphenol analogues에 노출된 D. celebensis에서는 BPA와 BPS는 Vtg 유전자의 발현을 유의하게 증가시킨 반면 BPF는 감소시켰다(In et al., 2020). 한편 BPA에 노출된 D. magna neonate에서는 Vtg 유전자의 발현이 감소되었다(Jeong et al., 2013Jeong et al., 2013). 이러한 결과는 소형 갑각류에서 좀 더 다양한 EDCs에 대한 Vtg 유전자의 발현 양상 및 Vtg 발현에 영향을 미치는 호르몬 경로에 대한 추가적인 연구가 필요하다는 것을 시사한다.
결론적으로 본 연구에서는 17β-estradiol (E2)가 D. celebensis의 ecdysteroid 경로와 관련된 유전자들의 발현을 조절함으로써 탈피와 생식에 영향을 미칠 수 있음을 제시하였다. 향후 E2과 ERR의 결합 여부와 탈피 과정에서 ERR의 기능에 대한 연구가 필요하며, 나아가 E2 노출 후 D. celebensis의 탈피와 생식이 어떻게 영향을 받는지 개체 수준에서의 다세대 영향 연구가 요구된다. 본 연구는 E2 노출이 D. celebensis의 생식과 발생에 미치는 분자 기전을 이해하는데 도움이 될 것이다.
- References
-
2. Boulangé-Lecomte C, Xuereb B, Trémolet G, Duflot A, Giusti N, Olivier S, Legrand E, Forget-Leray J. 2017. Controversial use of vitellogenin as a biomarker of endocrine disruption in crustaceans: New adverse pieces of evidence in the cope pod Eurytemora affinis. Comp Biochem Physiol C Toxicol Pharmacol 201: 66-75.
-
11. Ghekiere A, Verslycke T, Janssen C. 2006. Effects of methoprene, nonylphenol, and estrone on the vitellogenesis of the mysid Neomysis integer. Gen Comp EGhekiere A, Verslycke T, Janssen C. 2006. Effects of methoprene, nonylphenol, and estrone on the vitellogenesis of the mysid Neomysis integer. Gen Comp Endocrinol 147: 190-195.ndocrinol 147: 190-195.
-
39. Xuereb B, Bezin L, Chaumot A, Budzinski H, Augagneur S, Tutundjian R, Garric J, Geffard O. 2011. Vitellogenin-like gene expression in freshwater amphipod Gammarus fossarum (Koch, 1835): functional characterization in females and potential for use as an endocrine disruption biomarker in males. Ecotoxicology 20: 1286-1299.














