JMLS 2017 October;2(2):70-74. Epub 2017 November 03
Copyright © 2017 by The Korean Society of Marine Life Science
온도 및 염분 등의 환경요인이 참돔(Pagrus major)의 Interleukin-1 Receptor Accessory Protein 발현에 미치는 영향(Effects of Environmental Factors Such as Temperature and Salinity on Expression of Interleukin-1 Receptor Accessory Protein in the Red Seabream (Pagrus major))
강한승; 엠에스바이오랩 유전체 연구부
민병화; 국립수산과학원 양식관리과
- Abstract
IL-1RAcP는 일명 interleukin-1 receptor accessory protein이라 칭하며 interleukin-1 염증성 사이토카인과 interleukin-1 receptor I (IL-1RI) 결합체와 복합체를 형성하여 작용한다. IL-1RAcP는 면역반응, 스트레스 및 세포사멸과 관련이 있다. 본 연구의 목적은 참돔(Pagrus major)을 저수온(8℃, 33 psu) 및 저염분(20℃, 10 psu) 상태에 노출시킨 후, IL-1RAcP 유전자의 발현을 관찰하는 것이다. 연구결과, IL-1RAcP 유전자의 발현은 저수온(8℃, 33 psu) 및 저염분(20℃, 10 psu) 상태에서 유의적으로 증가하는 것으로 나타났다. 이 연구결과로서 IL-1RAcP 유전자는 저수온 및 저염분 등의 환경 스트레스에 대한 생체지표유전자로서 역할을 한다고 제의한다.
Interleukin-1 (IL-1) is one of the proinflammatory cytokines, after IL-1 binds to IL-1RI, IL-1RacP (interleukin-1 receptor accessory protein) joins with IL-1/IL-1RI to form a complex, and leading to cell activation. IL-1RAcP is involved in immune response, stress and apoptosis. The purpose of this study was to investigate the gene expression of IL-1RAcP in red seabream (Pagrus major) exposure to low water temperature (8℃, 33 psu) and low salinity (20℃, 10 psu). Results showed that, the expression of IL-1RAcP was significantly increased in the experiment groups, such as low water temperature (8℃, 33 psu), and low salinity (20℃, 10 psu). These results suggest that IL-1RAcP was played roles in biomarker gene on the environmental stress such as low water temperature and low salinity.
Keywords: Pagrus major(참돔) IL-1RAcP(인터루킨-1 수용체 부속 단백질) Biomarker(생체지표) Temperature(온도) Salinity(염분)
Correspondence to: Han Seung Kang; Genome Research Department, MS BioLab, Daejeon 34576, Korea; E-mail : hanseungkang66@gmail.com;
- Received
- 23 October 2017;
- Revised
- 24 October 2017;
- Accepted
- 24 October 2017.
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Language: Korean/English,
Full Text:

서 론
해양환경은 해양에 서식하는 생물들에게 생리대사와 서식분포에 영향을 미치는 중요한 요인이다. 특히 어류를 비롯한 해양생물은 수온 및 염분 등의 물리적 환경요인에 의해 많은 영향을 받는다. 기후변화에 따른 수온의 변동은 생물의 서식이나 회유경로 변화 등 생태계 전반에 많은 영향을 미친다고 알려져 있다(Kinne, 1963). 염분농도는 해양생물의 생리 및 생태에 영향을 미치는 중요한 요인 중의 하나이다(Kinne, 1963; Berger and Kharazova, 1997).
어업은 고급어종의 어획량 감소 등의 이유로 잡는 어업에서 기르는 어업으로 많이 전환되었으나 양식장 주변의 환경오염 및 해양 환경요인의 변화에 따라 생산에 많은 영향을 미친다. 양식생물에게 피해를 많이 주는 환경요인은 저수온(Kang et al., 2007), 고수온(Choi et al., 2009), 저염분(Kang et al., 2008) 등이다. 이러한 환경요인으로 인한 성장, 생식, 대사, 삼투압 조절과 같은 양식생물의 생리적 변화는 질병 및 폐사에 영향을 미칠 수 있다(Wedemyer and Mcleay, 1981). 환경요인이 양식생물의 항상성에 불균형을 초래하여 폐사에 이르게 하는 위해 수준의 정도에 대한 과학적인 자료의 준비는 환경요인의 변화에 대비한 선제적 적응 대책의 수립, 지역별 서식환경과 양식생물 간의 관계에 대한 변화체계 모니터링 및 데이터베이스 구축을 통한 안정적인 양식생산성 예측을 위한 기반 확보로 중요하다. 국내가 아닌 외국의 연구 동향을 살펴보면 일본의 경우 양식생물에 대한 기초 생물학적 연구가 체계적으로 수행되어 각 해양생물에 대한 적정수온, 한계수온, 적정염분 및 용존산소 농도 범위 등과 같은 기초자료가 각 생물에 따라 체계적으로 정리되어 있다(Kodama et al., 2012; Thanasaksiri et al., 2014). 미국 및 유럽에서는 해양생물의 건강성 평가, 생리적 내성 범위 등 환경변화에 따른 생태, 생리 및 분자생물학적 연구에 관한 기초 연구결과가 풍부하다(Múgica et al., 2015; Balbi et al., 2017; Parisi et al., 2017).
분자생물학적 연구방법을 통한 유전체 연구는 생물체의 유전정보를 분석하고 활용하는데 있어 새로운 도구와 방법론을 제공하고 있다. 환경요인의 변화에 따른 유전자 발현의 변화는 생물개체의 건강상태를 평가하는데 있어서 유용한 방법으로 이러한 생체지표유전자(biomarker gene)를 이용한 평가는 저비용으로 신속하게 개체의 상태를 평가할 수 있는 장점이 있다.
따라서 본 연구의 목적은 환경요인 중에서 저수온 및 저염분에 의해 발생된 참돔(Pagrus major) 개체의 스트레스에 따른 건강상태를 평가하는데 있어서 생체지표유전자를 이용한 평가에 목적을 두며, 참돔 성어 저수온 및 저염분 노출개체를 대상으로 차세대유전체분석법(next generation sequencing, NGS)을 통하여 발굴된 유전자 중에서 interleukin-1 receptor accessory protein (IL-1RAcP)를 선택하여 평가하였다.
재료 및 방법
1. 실험동물
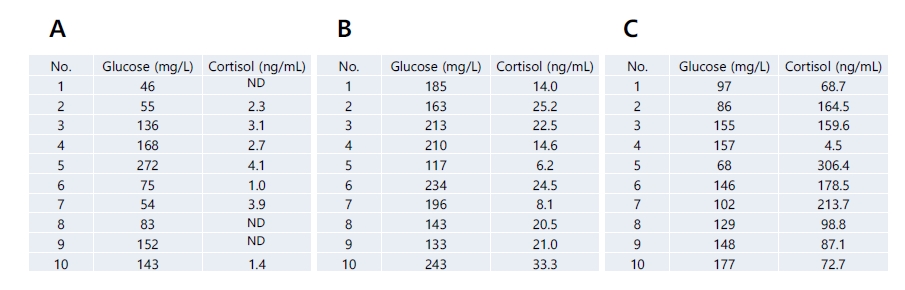
참돔 성어를 대조구(20℃, 33 psu), 저수온(8℃, 33 psu) 및 저염분(20℃, 10 psu) 상태의 실험구를 준비한 후 5시간 노출시켰다. 각 실험구별 10마리의 개체를 선택한 후에 혈액성상 분석을 시행하여 스트레스 지표로 알려진 glucose 및 cortisol 농도를 분석하여 대조구 대비 저수온 및 저염분에 따른 스트레스를 받은 개체를 선정하여 실험어로 선정하였다(Fig. 1). 대조구의 경우 glucose 및 cortisol 농도의 수치가 낮은 것을 선정하였으며, 상대적으로 저수온 및 저염분 실험구에서는 glucose 및 cortisol 농도의 수치가 높은 것을 선정하였다. 실험어는 각각 5마리로서 대조구(No: 1, 2, 6, 7, 8), 저수온(No: 3, 6, 7, 9, 10) 및 저염분(No: 2, 3, 5, 6, 7) 선정하였다. 각 실험구별 실험어에서 조직시료(뇌, 뇌하수체, 간, 비장, 신장)를 수집한 후에 액체질소를 이용하여 동결 전 처리 후 -80℃ 초저온 냉동고에 보관하였다.
2. RNA 추출
Total RNA 추출은 GeneAll RiboEx kit를 사용하였다. 저온 동결보존된 조직시료를 grinder로 곱게 갈았다. RiboEx 용액(1 ml/100 mg)을 조직에 넣고 잘 혼합한 후 실온에서 5분간 방치하였다. Chloroform 0.2 ml를 넣어주고 혼합 후 실온에서 2분간 방치하였다. 원심분리를 시행하여 상등액을 새로운 tube에 옮겨 담고 isopropyl alcohol 0.5 ml를 넣어 10분간 실온에서 방치하였다. 원심분리를 시행하여 상등액을 제거하고 75% EtOH로 세척한 후 DEPC-water로 녹여 -80℃ 초저온 냉동고에 보관하였다. RNA quality 확인은 Agilent사의 Bioanalyzer RiboPico 6000 chip을 이용하여 18S/28S 비율 및 RIN (RNA Integration Number)을 조사하였다.
3. 실시간 역전사-중합효소연쇄반응(Real-time RT-PCR)
Real-time RT-PCR 분석을 위한 total RNA의 준비는 대조구 및 실험구 개체별 각각의 조직에서 추출한 total RNA를 동량 혼합하여 준비하였다. cDNA 합성을 위한 역전사 반응(Reverse Transcription, RT)은 iScript cDNA synthesis kit (Biorad Co.)를 이용하였다. Total RNA 1 μg, iScript 5×Master mix 4 μl, iScript reverse transcriptase 1 μl 및 DEPC-water을 넣어 최종 반응용액 20 μl을 맞추어 42℃에서 1시간 반응하여 cDNA를 합성하였다. 실시간 중합효소연쇄반응(real-time PCR)은 iQ SYBR Green Supermix kit (BioRad)를 이용하여 5 반복 수행하였다. cDNA 1 μl, primer (20 pmol) 각각 1 μl, iQ SYBR Green Supermix (2×) 10 μl 및 DEPC-water을 넣어 최종 반응용액 20 μl되게 맞춘 후에 real-time PCR machine (CFX96, Biorad)를 이용하여 증폭하고 형광량을 분석하였다. 유전자를 증폭시키기 위한 반응 조건은 95℃에서 3분간 유지, 이후 95℃에서 15초, 60℃에서 30초, 72℃에서 30초를 45 cycles를 반복하였으며, 마지막으로 72℃에서 5분간 유지하였다. Melting curve의 분석은 0.5℃ 간격으로 60℃에서부터 95℃까지 상승시켰다가, 이후 30℃에서 5분간 유지하였다. 상대적인 유전자 발현량의 결정은 2-ΔΔCt 방법(comparative Ct method)을 이용하여 유전자의 발현량을 분석하였다. 내재표준유전자로는 house keeping 유전자인 β-actin을 사용하여 발현량을 normalization시켰다. 프라이머 염기서열은 IL1RAcP forward (5'-CCACTGCTGGGTGTGTCTTC-3'), reverse (5'-ATC- TCCAAAGATCATCGGGC-3'), β-actin forward (5'-GGCACTGCTGCCT- CCTC-3'), reverse (5'-GCCAGGATGGAGCCTCC-3')이다.
4. 통계학적 분석
대조구 및 실험구와의 유의성 검정은 Student's t-test로 비교하였으며, p가 0.01 이하인 것만 유의한 것으로 하였다.
결과 및 고찰
Interleukin-1 (IL-1)은 염증유발 사이토카인(proinflammatory cytokines) 중 하나로서 interleukin-1α (IL-1α), interleukin-1β (IL-1β) 및 interleukin-1 receptor antagonist (IL-1Ra) 등의 3개의 리간드(ligands)를 가진다(Arend et al., 2008). IL-1 계열 수용체는 I형(IL-1RI), II형(IL-1RII) 및 IL-1R accessory protein (IL-1RAcP)이다. IL-1이 IL-1RI에 결합한 후, IL-1RAcP은 IL-1/IL-1RI 결합체와 결합하여 복합체를 형성하고, 두 수용체 사슬의 세포질 도메인(cytoplasmic domain)에 의해 세포 활성화를 유도한다(Wesche et al., 1997; Arend et al., 2008). IL-1RAcP는 해양생물에서의 연구는 미미하여 잘 알려져 있지 않다. 사람 및 포유동물에서는 만성 및 급성 염증반응의 매개인 IL-1의 수용체인 IL-1RI과 복합 수용체로서 역할을 하며 스트레스, 면역반응 및 세포사멸(apoptosis)에 관여하는 것으로 알려져 있다(Wesche et al., 1997; Laye et al., 2001; Jensen and Whitehead, 2003).
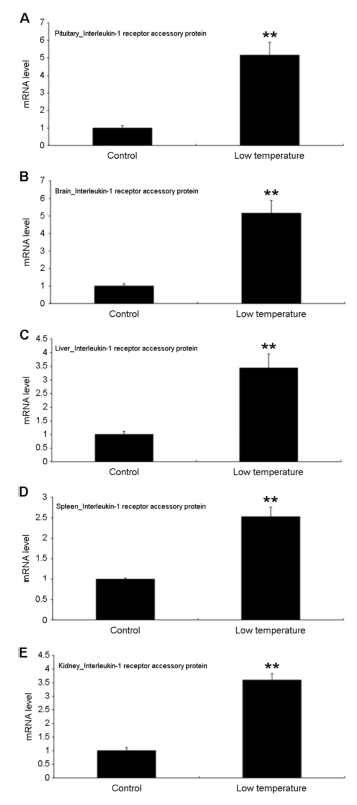
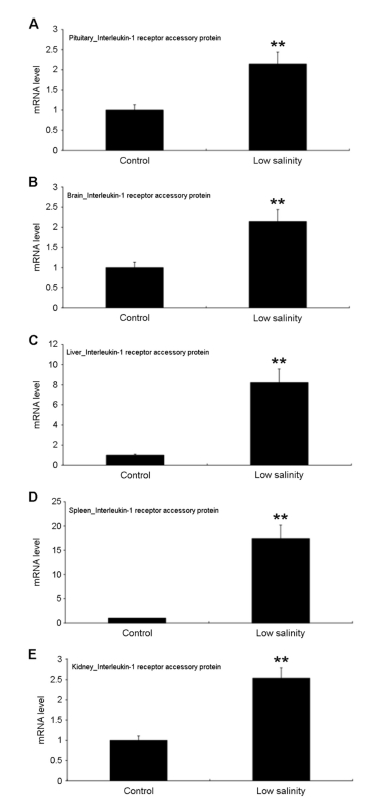
본 연구결과 참돔 성어를 저수온 및 저염분에 단기 노출시켜 스트레스를 유발시킨 후, 각각의 조직에서 IL-1RAcP 유전자의 발현을 살펴본 결과, 뇌하수체, 뇌, 간, 비장 및 신장 조직에서 대조구에 비해 유의한 발현의 증가를 나타냈다(Fig. 2, 3). 저수온에 노출된 개체의 조직별 발현양상을 가장 높은 발현을 보인 조직에서 상대적으로 낮은 발현을 보인 조직을 순서대로 나열하면 뇌, 뇌하수체, 신장, 간 및 비장의 순서로 5.2, 5.1, 3.6, 3.4 및 2.5배 정도의 발현차이가 나타났다(Fig. 2). 저염분에 노출된 개체 조직을 대상으로 고발현에서 저발현으로의 순서를 나열하면 비장, 간, 신장, 뇌 및 뇌하수체의 순서로 17.4, 8.2, 2.5, 2.1 및 2.0배 정도의 발현차이를 보였다(Fig. 3). 저수온 및 저염분의 스트레스에 대한 참돔 조직에서의 IL-1RAcP 발현은 조직마다 유의적으로 상이하게 나타났다. 저수온 스트레스의 경우 뇌 조직에서, 저염분 스트레스의 경우는 비장 및 간 조직에서 상대적으로 다른 조직에 비해 높은 발현양상을 보였다.
본 연구의 목적은 환경요인 중에서 저수온 및 저염분 등의 스트레스에 의해 발생된 참돔개체의 건강상태를 생체지표유전자의 발현양상을 이용하여 평가하는데 목적을 두었다. 분자생물학적 유전자 발현을 통한 생체지표유전자의 선정 조건은 환경요인의 영향에 민감하게 반응하여 유전자의 발현변화가 큰 유전자가 적합하다. 환경요인 스트레스에 대한 건강상태를 평가하기 위한 생체지표유전자로서 IL-1RAcP를 이용할 경우 각각의 환경요인에 대한 고발현이 나타난 조직 즉 저수온에서는 뇌 조직, 저염분에서는 비장 혹은 간 조직을 대상으로 평가하는 것이 유용하다고 판단된다.
생체지표유전자로서 IL-1RAcP는 참돔에게 있어 주요한 스트레스 및 폐사 유발 가능 환경요인인 저수온 및 저염분의 영향에 따른 개체의 건강상태의 평가를 위한 유전자로서 매우 유용하리라 판단된다.
- References
-
13. Thanasaksiri K, Sakai N, Yamashita H, Hirono I, Kondo H. 2014. Influence of temperature on Mx gene expression profiles and the protection of sevenband grouper, Epinephelus septem- fasciatus, against red-spotted grouper nervous necrosis virus (RGNNV) infection after poly (I:C) injection. Fish Shellfish Immunol 40: 441-445.














