JMLS 2017 October;2(2):39-48. Epub 2017 November 03
Copyright © 2017 by The Korean Society of Marine Life Science
참전복(Haliotis discus hannai)의 장거리 수송을 위한 적정 수온 및 염분 조건 탐색(Investigation of Optimal Temperature and Salinity for Long Distance Transport of the pacific abalone (Haliotis discus hannai))
양성진; 국립수산과학원 전략양식부 양식관리과
민병화; 국립수산과학원 전략양식부 양식관리과
이정용; 국립수산과학원 전략양식부 양식관리과
전제천; 국립수산과학원 전략양식부 양식관리과
명정인; 국립수산과학원 전략양식부 양식관리과
- Abstract
생존율은 염분과 관계없이 8℃, 10℃일 때는 98.7~100%였으나, 4℃일 때는 생존율이 25~55%로 나타났다. 혈림프액 내 SOD와 glutathione 농도와 같은 스트레스 지표는 모든 염분구에서 4℃, 6℃일 때 높게 나타났다. THC, hemocyte population, apoptotic cell및 necrotic cell의 비율은 염분 별로는 26 psu구에서 가장 높게 나타났고, 4~6℃일 때 다른 실험구에 비해 유의하게 높았다. 이러한 결과들은 26 psu의 염분과 6℃ 이하의 수온에서는 참전복의 스트레스 반응이 증가하였으나, 30, 34 psu의 염분과 8, 10℃의 수온에서는 대조구와 차이가 없어, 참전복의 수송을 위한 적정 수온 및 염분 조건은 8~10℃, 30~34 psu인 것으로 나타난다.
This study was carried out to investigate the stress response of pacific abalone exposed to various water temperatures (4, 6, 8, and 10℃) and salinities (26, 30, and 34 psu) for 7 days, with the aim of finding optimum conditions for long-distance ocean transport of pacific abalone. At the end of the experiments, the survival rate was ranged from 98.7~100% at 8 and 10℃ but dropped to 25~55% at 4℃ in all salinity levels. The levels of SOD and glutathione in hemolymph were significantly higher at 4 and 6℃ than the control in all salinity groups, indicating that these temperatures induce severe stress in pacific abalone. It was found that THC was lowest at 6℃ in the 26 psu groups. The study showed that the hemocyte of pacific abalone populations mostly consisted of blast-like cells and hyalinocytes with the ratio of hyalinocytes being significantly lower at 4 and 6℃ than the other temperatures in the 26 psu groups. Percentages of apoptotic cells and necrotic cells were higher in the 26 psu group and 4 and 6℃ temperature groups. These results explicit that pacific abalone was exposed to greater stress at 26 psu and at 4 and 6℃ but experienced no significant higher stress at 30 and 34 psu and 8 and 10℃. It was therefore concluded that the optimum temperature and salinity for the long distance transport of pacific abalone range from 8~10℃ and 30~34 psu, respectively.
Keywords: Haliotis discus hannai(참전복) Temperature(온도) Salinity(염분) Stress response (스트레스 반응) Transport condition(수송조건)
Correspondence to: Jeong-In Myeong; Aquaculture Research Division, National Institute of Fisheries Science, Busan 46083, Korea; E-mail : cosmo@Korea.kr
- Received
- 14 October 2017;
- Revised
- 18 October 2017;
- Accepted
- 23 October 2017.
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Language: Korean/English,
Full Text:

서 론
전세계적으로 최근 육류의 소비는 점차 줄어드는 반면 수산물의 소비는 계속 증가하고 있다(FAO, 2015). 특히, 활수산물은 주로 한국과 일본 등에서 제한적으로 소비되어 왔지만, 최근 들어 보다 많은 국가에서 선호하는 식품으로 소비되고 있어 국가 간의 활수산물 교역량도 크게 증대될 전망이다.
활수산물 수입 또는 수출은 주로 항공기나 선박을 이용하여 이루어지고 있다. 항공 수송은 신속하다는 장점이 있지만 품종의 제한과 높은 수송비가 단점이 있다(Piper et al., 1982; Berka, 1986). 반면, 선박 수송은 항공 수송에 비해 비용이 저렴하며, 다양한 품종을 대량으로 수송할 수 있는 장점이 있지만 수송시간이 길다는 단점이 있다.
살아있는 어패류를 장시간 수송할 경우 수송 과정 중 수많은 스트레스 요인에 노출된다. 이러한 스트레스 요인으로는 운반수 유동(Davis and Parker, 1986)과 같은 물리적인 스트레스, 대사 산물 축적에 의한 수질악화, 운반수의 용존산소 감소 등이 있다(Paterson et al., 2003; Harmon, 2009). 이러한 스트레스 요인들은 서로 복합적으로 작용하여 수송생물에게 부정적인 영향을 미치며, 특히, 수질은 수송 중 대상생물의 건강과 생존에 직접적인 영향을 미치는 중요한 요인이다(Wedemeyer, 1997; King, 2009). 폐쇄된 환경으로 인해 운반수는 수송생물의 대사작용으로 수질이 점차 악화된다. 더구나 수송생물은 수송 스트레스로 인해 수송 전보다 대사량이 약 3배 가량 높기 때문에 운반수의 수질은 빨리 악화된다(Froese, 1988). 수중에 대사 산물인 암모니아의 농도가 수송생물의 내성범위를 초과하게 되면 그 독성으로 수송생물은 폐사하게 된다.
이산화탄소 농도 역시 수송생물의 내성범위를 초과하게 되면 호흡성 산증(respiratory acidosis)이 초래되어 최종적으로 저산소증에 의한 폐사가 나타난다(Amend et al., 1982; Wedemeyer, 1996). 또한, 배출된 배설물에서 발생된 미세 부유물질은 수송어류의 아가미에 직접적인 손상을 입히기도 한다(Harmon, 2009).
이러한 장거리 수송 문제를 극복하고자 현재까지 많은 수송관련 연구가 이루어져 온 바(Ferreira et al., 1984; Yoshikawa et al., 1989; Cho et al., 1994), 이 중 수온을 저하시켜 운반하는 저온 수송법이 가장 효과적인 것으로 나타나고 있다. 저온 수송은 생물의 대사량을 줄여 배설물에 의한 오염을 감소시키므로 선박을 이용한 장시간의 수송이 가능하다.
한국에서는 2012년 저온 수송이 가능한 선박용 컨테이너가 개발되어, 이를 이용하여 실제로 2012년부터 2014년까지 넙치(54.6 ton), 조피볼락(19 ton), 터봇(16.3 ton), 숭어(2.4 ton), 강도다리(0.9 ton)를 선박을 이용하여 부산에서 미국 캘리포니아 Long Beach까지 성공적으로 운송한 바 있다(MOF, 2014). 그러나 수송생물의 임계 수온 및 염분, 용존산소와 같은 생리 특성을 고려하지 못한 장시간의 수송은 대상생물에게 극심한 스트레스 요인으로 작용하여 이들의 생리 활성을 떨어뜨리거나 폐사를 유발하므로(Wedemeyer, 1996; Harmon, 2009), 수송생물의 안정적인 수송을 위해서는 이들의 적정수송 조건의 탐색이 선행되어야 한다.
일반적으로 대사량은 수온에 비례하므로, 수송 시 대사량을 줄이기 위해서는 수온을 낮추어야 한다. 그러나, 저온에 대한 임계점이나 생리학적 반응은 어종에 따라 다양하게 나타나 수송하는 대상에 따른 적정 수송 온도 구명이 우선시 되어야 한다. 예를 들어 salmonide는 5~7℃ (Wedemeyer, 1996), striped bass (Morone saxatilis)는 12.8~18.3℃ (Piper et al., 1982), large-mouth bass (Micropterus salmoides)는 16℃ (Carmichael et al., 1984), brown crab (Cancer pagurus)는 2~10℃ (Fotedar and Evans, 2011), lobster (Panulirus cygnus)와 European lobster (Homarus gammarus)는 각각 12~15℃와 5~10℃ (Whiteley and Taylor, 1992)가 수송에 적합한 수온으로 나타났다.
또한, 염분은 수계생물들의 생존, 성장, 대사 등 다양한 생리적 반응에 큰 영향을 미치며(Marshall, 2002; Romo et al., 2010), 어류의 경우 수송 시 염분 조건에 따라 건강도나 생존율이 향상된다는 보고가 있다(Weirich and Tomasso, 1991; Weirich et al., 1992). Harrell (1992)는 red-tail brycon (Brycon cephalus)와 M. saxatilis 수송 시 염분은 각각 6 psu, 10 psu가 적당하다고 하였다. 또한, red drum (Sciaenops ocellatus) 치어는 11 psu로 수송할 때 생존율이 가장 높다고 보고된 바 있다(Weirich and Tomasso, 1991). 어종에 따른 적정 염분농도는 종 특이성이므로 대상종에 따른 수송 과정 중 적정 염분농도의 구명이 필요하다.
한국에서 참전복(Haliotis discus hannai)의 양식 생산량은 2000년에 20톤이었던 것이 2016년도에는 12,356톤으로 급격하게 증가하였다. 생산량은 전체 패류 양식 생산량 중 3.4%에 불과하지만, 생산 금액은 3,475억원으로 전체 생산 금액의 56.5%의 비중을 차지하는 고부가가치 품종이다(MOF, 2016). 이러한 상황을 고려해서 한국에서는 참전복을 수산물 수출전략품종으로 지정하였다. 따라서 본 연구는 참전복의 성공적인 수출을 위하여 장거리 수송을 위한 적정 조건을 밝히고자 수온 및 염분에 대한 스트레스 반응과 건강도를 파악하였다.
결 과
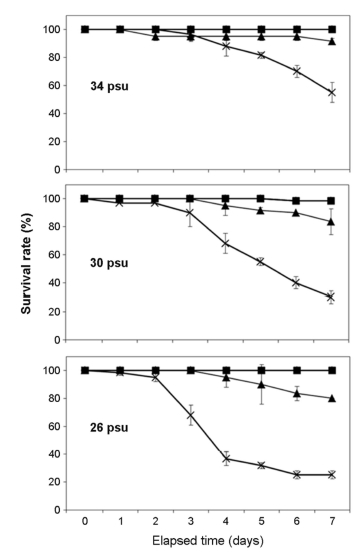
1. 생존율
실험종료 시 34 psu에서 10℃와 8℃일 때 생존율은 실험종료 시 100%로 나타났으며, 6℃와 4℃일 때는 각각 91.5±2.1%, 55.0±7.1%로 나타났다. 30 psu에서는 10℃ 와 8℃일 때 생존율은 95% 이상이었으며, 6℃와 4℃는 각각 83.5±9.2%, 30.0±4.2%로 나타났다. 26 psu에서는 10℃와 8℃일 때 모두 생존하였으나, 6℃일 때 80.0±0.0%로 나타났고, 4℃일 때는 25.0±2.8%로 나타나 실험구 중 가장 낮았다(Fig. 1).
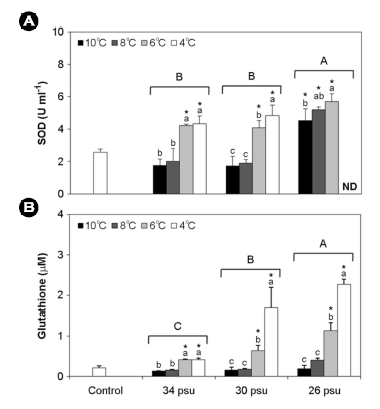
2. Antioxidant enzyme
26 psu구의 SOD 농도는 30 psu구 및 34 psu구보다 유의하게 높았다. 30 psu구 및 34 psu구에서는 4℃와 6℃의 SOD 농도가 8℃ 및 10℃보다 유의하게 높았다. 26 psu구에서는 4℃일 때 SOD가 검출되지 않았다. 30, 34 psu구의 경우 4, 6℃ 그리고 26 psu의 모든 수온에서 SOD 농도가 대조구에 비해 유의하게 높았다(Fig. 2).
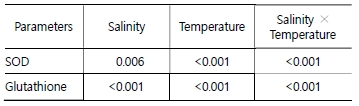
Glutathione 농도는 염분구 중 26 psu구에서 가장 높았으며, 4℃ 및 6℃일 때 8℃와 10℃ 및 대조구에 비해 유의하게 높았다(Fig. 2). 또한, SOD와 glutathione은 염분, 수온의 단독조건과 염분과 수온의 상호작용으로도 영향을 받는 것으로 나타났다(Table 1).
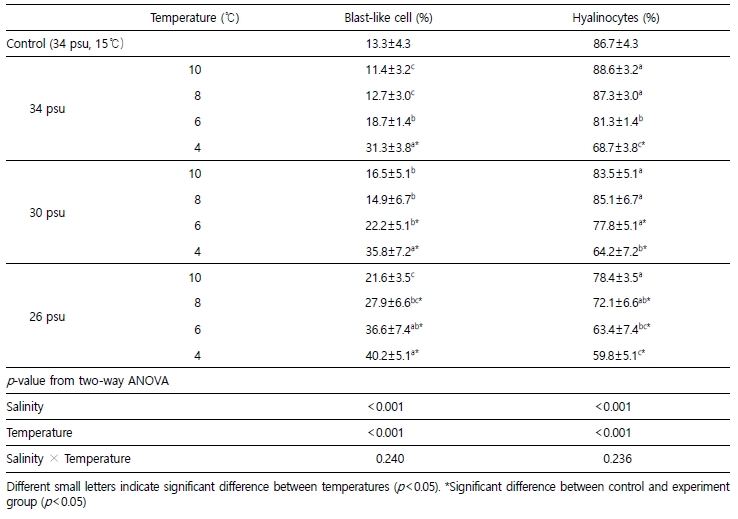
4. Hemocyte population
참전복의 hemocyte population은 blast-like cell과 hyalinocyte로 구분되었다. 실험종료 시 blast-like cell의 비율은 26 psu구가 30 psu구 및 34 psu구보다 유의하게 높았으며, 모든 염분구에서 4℃일 때 가장 높게 나타났다. Hyalinocyte의 비율은 26 psu구가 30 psu구 및 34 psu구보다 유의하게 낮게 나타났으며, 모든 염분구에서 4℃일 때 가장 낮게 나타났다. Blast-like cell과 hyalinocyte은 34 psu에서는 4℃, 30 psu에서는 4℃, 6℃ 그리고 26 psu에서는 4℃, 6℃, 8℃일 때 대조구와 유의한 차이가 나타났으며, 염분과 수온의 단독조건에만 영향을 받는 것으로 나타났다(Table 2).
5. Hemocyte mortality
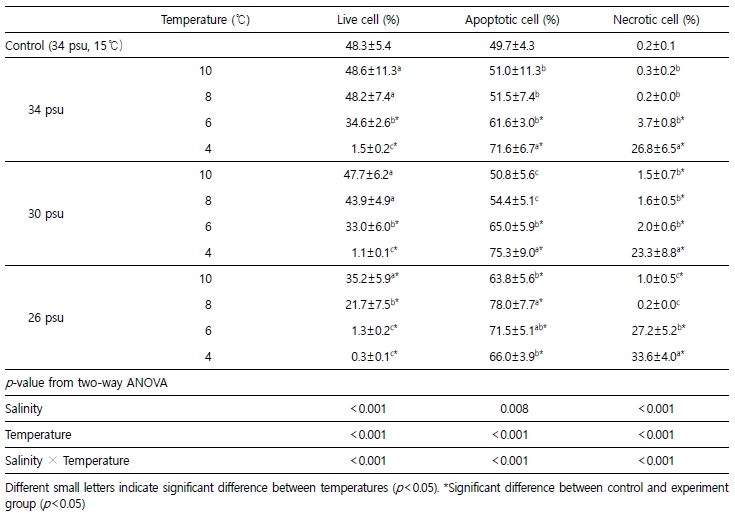
실험종료 시 live cell 비율은 26 psu구가 30, 34 psu구보다 유의하게 낮았으며, 모든 염분구에서 4℃ 및 6℃일 때 8℃, 10℃ 및 대조구보다 유의하게 낮았다.
Apoptotic cell 비율은 26 psu구가 30 psu구 및 34 psu구보다 유의하게 높았다. 30 psu구와 34 psu구에서는 4℃ 및 6℃일 때 8℃, 10℃ 및 대조구보다 유의하게 높았으나 26 psu구의 모든 수온에서 대조구에 비해 유의하게 높았다.
Necrotic cell 비율은 26 psu구가 30 psu구와 34 psu구보다 역시 유의하게 높았다. 모든 염분구에서 4℃일 때 가장 높았으며, 34 psu구에서는 4, 6℃, 30 psu구 및 26 psu구에서는 모든 수온조건이 대조구보다 유의하게 높았다(단 26 psu-8℃ 조건은 제외). 또한, live cell, apoptotic cell 및 necrotic cell은 염분, 수온의 단독조건과 두 요인의 상호작용으로도 영향을 받는 것으로 나타났다(Table 3).
고 찰
저수온은 수산생물의 대사를 감소시킬 수 있으나, 내성범위를 벗어난 경우 생리적 기능 저하 및 건강도를 악화시켜, 오래 지속될 경우 폐사에 이르게 한다(Bayne et al., 1985; Romo et al., 2010). Haliotis diversicolar supertexta 치패는 저온 내성범위가 3.5~14.0℃이며(Chen and Chen, 1999), Haliotis sieboldi 치패의 적수온 범위는 10~25℃로 알려져 있다(Kim et al., 2006). 본 연구에서 염분과 관계없이 8℃, 10℃일 때는 참전복의 생존율이 98.7~100%로 나타났다. 6℃일 때는 80.0~91.5%로 생존율이 다소 감소하였으며, 4℃일 때는 25~55%까지 낮아져 참전복의 경우 6℃ 이하의 저온 수송은 부적합한 것으로 사료된다.
일반적으로 생물은 스트레스를 받게 되면 체내에 oxygen free radical이 생성된다. Oxygen free radical는 산화력이 매우 강하여 아미노산을 산화시켜 단백질 기능을 저하시키거나 핵산과 세포막을 손상시켜 생리적 기능 장애의 원인으로 작용한다(Anderson et al., 1992). oxygen free radical에 대한 체내 방어기작으로 antioxidant enzyme이 생성되며 이로 인해 oxygen free radical이 제거된다. 이러한 antioxidant enzyme로는 SOD, catalase, glutathione이 있다(Roch, 1999). SOD에 의해 superoxide radical이 생물에 무해한 O2와 H2O2로 분해되고, H2O2는 다시 catalase에 의해 O2와 H2O로 분해가 되며, 이때 미처 분해되지 못한 나머지 H2O2는 glutathione에 의해 분해가 되어 최종적으로 활성산소가 제거되게 된다(Nordberg and Arner, 2001). 따라서 수서생물도 스트레스를 받게 되면 antioxidant enzyme 활성이 높아지기 때문에 혈중 anti- oxidant enzyme 농도는 스트레스 지표로 사용된다(Farombi et al., 2007; Zoysa et al., 2009). South African abalone (Haliotis midae)의 경우 hyperoxia 상태일 때 정상보다 glutathione peroxidase의 활성이 높게 나타났으며(Vosloo et al., 2013), 참전복에서는 25℃ 이상일 때 SOD 활성이 높게 나타났다(Kim et al., 2005).
본 연구에서는 참전복의 SOD와 glutathione 농도가 모든 염분구에서 4℃, 6℃일 때 대조구보다 높게 나타나 4℃ 및 6℃일 때 스트레스를 받는 것으로 나타났다. SOD 및 glutathione 농도는 26 psu구에서 다른 염분구에 비해 높게 나타났다. 참전복은 저염분과 저수온이 동시에 작용할 시 스트레스를 더 많이 받는 것으로 나타났다.
일반적으로 스트레스를 많이 받을수록 혈중 antioxidant enzyme 농도가 높게 나타나므로 본 연구에서 SOD 농도가 염분과 수온이 가장 낮은 26 psu/4℃에서 가장 높게 나타날 것으로 예상했으나 검출되지 않았다. 이는 극도의 스트레스로 인해 생리 기능에 장애가 발생되게 되어 SOD 생성에 문제가 생긴 것으로 해석해 볼 수 있다. Japanese pearl oyster (Pinctada fucata)의 경우 대량 폐사가 일어난 집단(SOD activity 38.8 U ml-1)이 건강한 집단(SOD activity 97.7 U ml-1)에 비해 SOD 활성이 더 낮게 나타났으며(Uchimura et al., 2003), Scallop (Chlamys farreri)은 5, 17, 25℃로 온도를 달리하여 공기 중에 노출시켰을 때 혈구의 폐사율이 가장 높은 25℃, 6시간 째 SOD 활성이 가장 낮았다(Chen et al., 2007). 또한, H. midae의 경우도 정상 상태에 비해 hypoxia 상태일 때 SOD 활성이 유의하게 낮았다고 보고된 바 있다(Vosloo et al., 2013).
참전복과 같은 연체동물에서는 혈구가 혈림프액과 조직 사이를 이동하며 영양분의 소화와 운반, 해독작용 그리고 손상된 패각 및 조직의 치유 등의 같은 다양한 생리적 기능과 체내 면역 반응에 중추적인 역할을 한다.
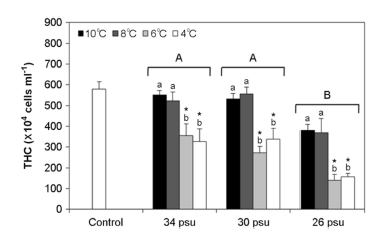
수온과 염분은 수서생물의 THC, hemocyte population 변화에 영향을 미친다(Flye-Sainte-Marie et al., 2009; Jauzein et al., 2013). 연체동물의 경우 THC는 중요한 면역학적 지표로써 체내 박테리아 증가와 같은 병리적 현상 또는 환경 변화 및 중금속 오염 등과 같은 스트레스에 따라 변한다(Mello et al., 2010). Striped venus clam (Chamelea gallina)의 경우 30℃일 때 25℃에 비해 혈림프액 내 박테리아 수가 증가함에 따라 THC가 높아졌다(Monari et al., 2007). 구리에 노출된 American oyster (Crassostrea virginica)에서는 THC가 증가한 반면(Fisher et al., 2000), 망간에 노출된 mussel (Mytilus edulis)의 경우는 THC가 감소하였다(Oweson and Hernroth, 2009). 또한 저산소 상태에서는 C. farreri (Chen et al., 2007)과 H. diversicolor supertexta (Cheng et al., 2004)의 THC가 감소한다고 보고된 바 있다.
본 연구에서 참전복의 THC는 26 psu구에서 영향을 받는 것으로 나타났으며, 또한 수온이 6℃ 이하일 때 감소하는 것으로 나타났다. M. edulis의 경우도 염분이 낮아질수록 THC가 유의하게 감소하여 본 연구와 유사하게 나타났다(Cheng et al., 2004). Donaghy et al. (2009)은 이매패류의 경우 봄과 여름에 비해 수온이 낮고 먹이생물이 적은 겨울에 대사량이 감소하여 THC가 낮아진다고 하였다. 이처럼 THC 변화는 종, 스트레스 요인 또는 계절에 따라 다르므로 이에 대한 연구가 더 필요하다.
본 연구에서 참전복의 hemocyte population은 대부분 blast-like cell과 hyalinocyte로 이루어진 것으로 나타났다. Disk abalone (Haliotis discus discus)의 경우 hemocyte population이 blast-like cell와 hyalinocyte로 나타나 참전복과 일치하였지만, 같은 복족류인 spiny top shell (Turbo cornutus)에서는 blast-like cell, hyalinocyte, granulocyte로 나타나 차이를 보였다(Donaghy et al., 2010). 또한 이매패류인 green mussel (Perna viridis)의 경우 혈구가 hyalinocyte와 granulocyte로 구성된 것으로 나타나(Donaghy and Volety, 2011) 참전복과는 다르게 나타났다. 이러한 차이는 종 특이적인 것으로 여겨지며, Hine (1999)은 패류의 hemocyte population은 종, 지역, 계절 등에 따라 다르게 나타난다고 하였다.
많은 연구에서 굴, 담치, 가리비 등과 같은 다양한 해산 이매패류에서는 hemocyte population 중 granulocyte가 면역 기능을 담당하는 것으로 보고되고 있지만(Carballal et al., 1997; Hine, 1999; Hégaret et al., 2003), granulocyte없이 hyalinocyte만 존재하는 종에서는 hyalinocyte가 면역을 담당하는 것으로 보고되고 있어(Donaghy et al., 2010), 참전복의 경우는 hyalinocyte 비율을 면역력의 지표로 사용이 가능할 것으로 여겨진다. Freshwater snail (Bellamya bengalensis)에서도 화학물질에 노출 시 이에 대응하기 위해 hyalinocyte 비율이 유의하게 증가하는 것으로 보아 hyalinocyte가 면역 기능을 담당하고 있음을 뒷받침해준다(Ray et al., 2013). 본 연구에서는 4℃ 또는 6℃일 때 그리고 26 psu(10℃ 제외)에서 hyalinocyte의 비율이 대조구에 비해서 유의하게 낮은 것으로 보아 면역력이 저하된 것으로 보인다.
패류의 건강도는 주로 비만도, 조직학적 변화, 혈림프액 성상, 조직 내 유리아미노산 등 뿐만 아니라 혈구의 사멸률을 통해서도 평가할 수 있다(Kiss, 2010; Park et al., 2012). 혈구 사멸은 크게 apoptosis와 necrosis로 구분할 수 있다. 이러한 혈구 사멸은 중금속이나 세균 감염, 그리고 극심한 스트레스 환경(염분 및 수온의 급변)에 의해 촉진된다(Fournier et al., 2001; Oliver et al., 2003; Kiss, 2010). C. gallina과 C. farreri의 경우 저산소 스트레스를 받았을 경우 혈구의 사멸률이 증가하며(Pampanin et al., 2002; Chen et al., 2007), Pacific oyster (Crassostrea gigas)의 경우 수온과 염분 스트레스를 받았을 때 혈구 사멸률이 증가하였다. 또한 P. viridis도 염분 스트레스를 받았을 때 혈구 사멸률이 높아졌다(Wang et al., 2012). 본 연구에서는 참전복의 apoptotic cell과 necrotic cell은 대조구에 비해 4℃와 6℃에서 높았고, 26 psu구가 30, 34 psu구보다 높은 것으로 나타났다. 이는 4℃ 및 6℃, 26 psu의 환경은 참전복의 생리학적 조건에 적합하지 않는 것을 뜻한다.
세포의 apoptosis 진행 기작에 대해서는 아직까지 정확하게 규명되지 않았지만, Russo and Madec (2007)은 oxygen free radical이 mitochondrial membrane potential에 작용하여 phosphatidylserine이 세포 내부로부터 세포 밖으로 노출되는 apoptosis 단계를 유도시킨다고 하였다. 본 연구에서도 참전복 혈구의 apoptosis 발생은 수온과 염분이 낮아질수록 유의하게 증가하여 SOD와 glutathione 활성과 비슷한 경향이 나타나 스트레스로 인한 oxygen free radical 증가로 참전복 혈구의 apoptosis가 일어난 것으로 유추해볼 수 있다.
결론적으로 참전복은 26 psu의 염분과 6℃ 이하의 수온에서 스트레스 반응이 증가한 반면, 30~34 psu, 8~10℃에서는 자연 조건과 차이를 보이지 않았다. 따라서 참전복의 수송을 위한 적정 수온 및 염분 조건은 8~10℃, 30~34 psu인 것으로 나타났다.
- References














