JMLS 2016 April;1(1):50-55. Epub 2016 April 30
Copyright © 2016 by The Korean Society of Marine Life Science
수온과 염분이 참전복, Haliotis discuss hannai 의 혈림프액 성상과 유리아미노산 조성에 미치는 영향
양성진; 국립수산과학원 전략양식부 양식관리과
이정용; 국립수산과학원 전략양식부 양식관리과
황형규; 국립수산과학원 전략양식부 양식관리과
민병화; 국립수산과학원 전략양식부 양식관리과
신윤경; 국립수산과학원 남동해수산연구소
명정인; 국립수산과학원 전략양식부 양식관리과
- Abstract
본 연구결과 glucose, NH3, AST, ALT는 4℃일 때 가장 높게 나타났으며, glucose와AST는 4℃일때 다른 염분구보다 26 psu에서 유의하게 높았다. 참전복에는 총 18가지 FAA가 존재하였으며, taurine, arginine, glutamic acid, alanine, glycine, lysine이 전체의 90% 가량을 차지하는 우점 FAA로 나타났다. Taurine은 30 psu 이상에서는 수온 간 유의한 차이가 없었으나, 26 psu에서는 6, 8℃일 때 유의하게 증가하였다. Glycine은 수온이 낮아질수록 유의하게 감소하여 6℃일 때 가장 높게 나타났다. 따라서 참전복은 30~34 psu, 8~10℃에서의 조건으로 수송 시 스트레스를 최소화할 수 있을 것으로 여겨진다.
Glucose was continuously increased as time was elapsed under the temperature at 6℃ and 4℃. NH3 was significantly increased at 4℃. AST was increased as temperature and salinity were decreased which indicated that it was affected by temperature, salinity and interaction of temperature×salinity. ALT was significantly increased as temperature was decreased. Free amino acid contents, excluding aspartic acid, threonine, serine and glycine were increased as temperature was decreased. This decreasing tendency was also observed when salinity was decreased. Taurine, aspartic acid, glutamic acid and arginine were significantly increased as salinity was decreased, while glycine, alanine, methionine, tyrosine, and histidine were decreased as salinity was decreased. The result of this study suggested that transport condition to minimize the stress is considered in the range of 30~34 psu, 8~10℃.
Keywords: Abalone(전복) Haliotis discuss hannai (참전복) Salinity(염분) Temperature(수 온) Hemolymp characteristic(혈림프액 성상) Free amino acid(유리아미노산)
Correspondence to: Jeong In Myeong; Aquaculture Management Division, National Institute of Fisheries Science (NIFS), Busan 46083, Korea, E-mail : cosmo@korea.kr
- Received
- 8 April 2016;
- Revised
- 23 April 2016;
- Accepted
- 25 April 2016.
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Language: Korean/English,
Full Text:

서 론
최근 육류의 소비는 점차 줄어드는 반면 수산물의 소비는 계속 증가하고 있다(FAO, 2015). 특히, 우리나라와 일본 등지에서 주로 횟감으로 소비되었던 활수산물이 보다 많은 국가에서 선호하는 식품으로 자리 매김 함에 따라, 국가 간의 활수산물 교역량도 크게 증대될 전망이다.
과거의 활수산물 수송은 살아있는 상태를 유지하기 위해 대부분 항공기에 의해 수송되어 신속하다는 장점이 있으나 수송비용이 많이드는 문제가 있다(Piper et al., 1982; Berka, 1986). 이러한 단점을 극복하고자 현재까지 많은 수송관련 연구가 이루어졌고(Ferreira et al.,1984; Yoshikawa et al., 1989; Cho et al., 1994), 이 중 수온을 저하시켜 운반하는 저온수송방법이 가장 효과적인 것으로 나타나고 있다.
저온수송은 생물의 대사량을 최소화시켜 장시간의 수송을 가능하여 비용이 상대적으로 저렴한 선박을 이용한 수송이 가능하다. 실제로 2012년 9월에 1.8톤의 넙치를 활컨테이너를 이용하여 부산항에서 선적하여 미국 California주 서남쪽 해안의 Long Beach항에 시험운송을 한 것을 시작으로 넙치, 터봇, 숭어 등 다양한 활어운송이 이루어진 바 있다(MOF, 2014). 그러나 수송생물의 생리대사 특성을 고려하지 못한 장시간의 활어패 수송은 극심한 스트레스 요인으로 작용하여 건강도 하락으로 인해 상품의 가치를 떨어뜨리거나 폐사를 유발하므로, 안정적인 활어패 수송을 위해서는 적정 수온 · 염분 등의 수송조건의 탐색이 선행되어야 한다(Wedemeyer, 1996; Harmon, 2009).
참전복, Haliotis discus hannai 은 전 세계적으로 고부가가치의 종이다. 우리나라 전복 양식생산량은 2015년 7,114톤으로 우리나라 양식패류 생산량 중 2.1% (MOF, 2015)에 불과하지만, 생산금액은 2,333억원으로 전체 생산금액의 47.6% (MOF, 2015)의 비중을 차지하고 있어 우리나라 패류양식산업에 있어서 매우 중요한 품종으로 자리잡고 있다. 또한, 전복은 수산분야 10대 수출전략 품목으로, 최근 한중 FTA 채결에 의한 한중 무역규모 확대에 따라 전복의 수출량 증대를 위한 활패 상태로 장시간 수송방법 개발이 필요할 것으로 예상된다. 따라서 본 연구에서는 참전복 활패의 장시간 수송을 위한 적정조건을 구명하고자, 수온 및 염분에 따른 혈림프액 성상과 유리 아미노산 조성을 조사하였다.
재료 및 방법
1. 실험생물 및 실험조건
실험에 사용된 참전복, Haliotis discus hannai 은 경남 통영에 소재한 양식장에서 구입하여 국립수산과학원내 사육실로 옮긴 후 유수식 수조(2톤)에서 14일간 적응시켰다. 참전복의 크기는 각장 7.5±0.4 cm, 각폭 5.1±0.3 cm, 전중 49.0±11.3 g이었다. 적응기간 동안 수온은 15±1℃ 염분은 33.5±0.5 psu였으며, 먹이로 건다시마를 매일 1회 충분히 공급하였다.
적정수송 조건을 탐색하기 위해 수온과 염분의 2인자에 수온은 4개의 처리(4, 6, 8, 10℃), 염분은 3개의 처리(26, 30, 34 psu)로 요인 실험을 하였다. 200 ℓ의 순환여과식 아크릴수조 12개에 실험조건별로 참전복을 각각 30개체씩 수용하였으며, 이와 동시에 동일한 크기의 수조에 30개체씩 수용하여 자연 수온(15℃) 및 염분(34 psu) 조건으로 실험하였다. 실험기간은 국내에서 중국을 포함하여 대만까지 활컨테이너를 이용하여 활수산물을 수송하는데 소요되는 시간을 감안하여 7일로 설정하였다. 실험기간 동안 수온은 냉각기와 온도조절기를 이용하여 조절하였으며, 광주기는 12L : 12D로, 용존산소는 포화농도 상태로 유지하였다.
2. 혈림프액 채취
실험종료 시 각 실험수조에서 5마리씩 무작위로 잡아 혈림프액을 채취하였다. 혈림프액은 3 ml 주사기(26 G)를 이용하여 입 부분에서 약 1 cm 밑 발근육 내의 cephalic arterial sinus에서 채혈하였으며, 원심분리(14,000 g, 4℃, 10 min) 후 상층액만 분석전까지 -80℃에 보관하였다.
3. 혈림프액 성분분석
혈림프액의 glucose, aspartate aminotransferase (AST), alanine aminotransferase (ALT) 및 NH3는 건식임상화학자동분석장치(FUJI DRI-CHEM 4000i, Japan)를 이용하여 측정하였다.
4. 유리아미노산(Free amino acid, FAA) 분석
FAA 변화를 살펴보기 위해 각 실험구의 참전복을 실험종료 시 각각 5마리씩 무작위로 잡아 발근육 부분을 채취하여 ninhydrin method (Yemm et al., 1955)에 따라, 동결건조한 시료 2 g을 70% ethanol 30 ml와 섞은 후 균질화하여 4℃에서 15분간 원심분리하였다. 분리된 상층액을 40℃ 이하에서 감압 농축한 후 ether로 세척하여 다시 감압 농축하였다. 농축된 시료에 25 ml dilution buffer 와 1 g의 sulphosalicylic acid를 혼합한 후 암실에서 1시간 방치하였다. 이 후 15분간 원심분리하여 0.45 μm membrane filter로 여과 후 희석하여 Amino Acid Analyzer S433 (Sykam, Germany)를 이용하여 유리아미노산을 정량분석하였다. 분석 시 column은 cation seperation column LCA07 (4.6 mm × 150 mm, 7 μm), detector는 UV/VIS (absorbance: 570 nm and 440 nm)이었으며, reagent flow rate와 buffer flow rate는 각각 0.25 ml min-1와 0.45 ml min-1이며, 반응 온도는 120℃로 설정하였다.
5. 통계처리
실험의 결과값은 평균 ± 표준편차로 나타내었으며, 실험구간 유의성(p <0.05)은 SPSS program (Ver. 17.0)을 사용하여 One-way ANOVA test 또는 Two-way ANOVA test와 Duncan's test로 검증하였다.
결 과
1. 혈림프액 parameters 변화
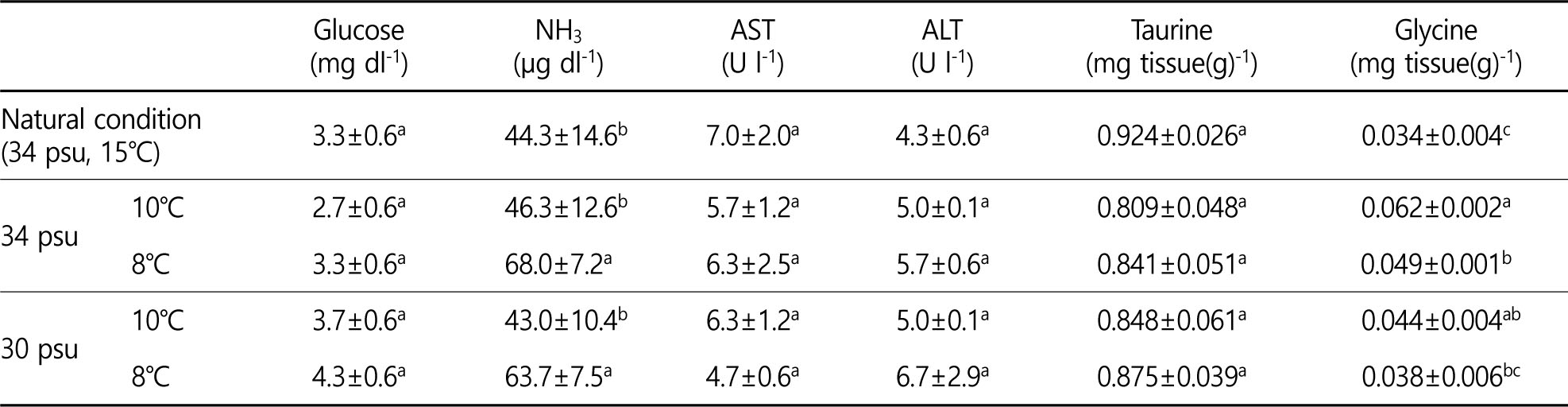
실험종료 시 glucose 농도는 모든 염분에서 4℃일 때 가장 높았고, 34 psu의 경우 4℃를 제외한 나머지 수온 구간에서 유의한 차이는 없었으며(Fig. 1), 수온에 영향을 받는 것으로 나타났다(Table 1).
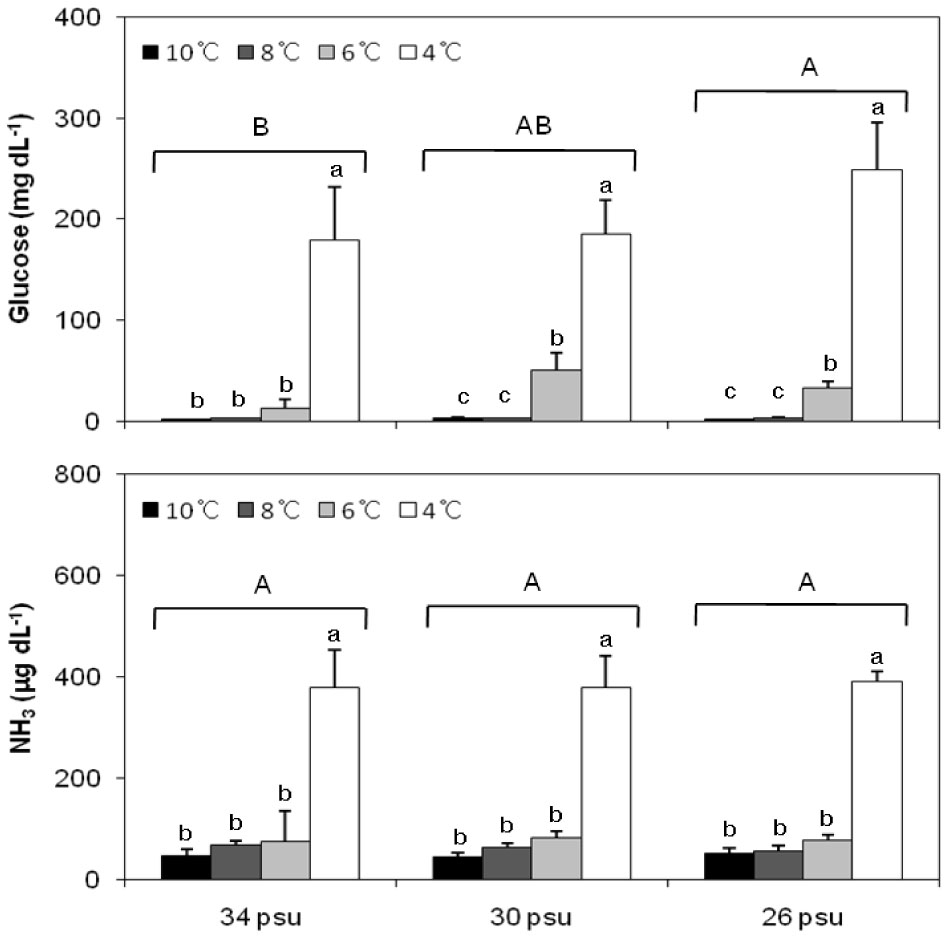
NH3 농도는 4℃가 다른 수온보다 유의하게 높았으며(Fig. 1), NH3 는 수온에 영향을 받는 것으로 나타났다(Table 1).
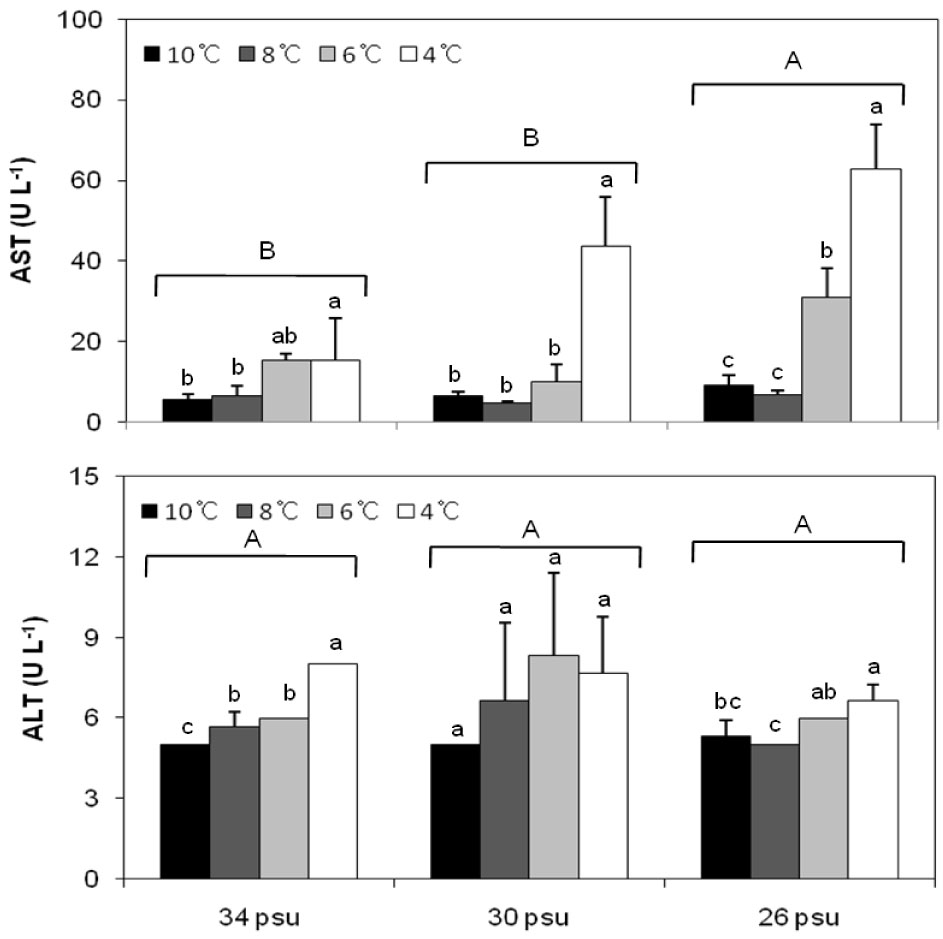
AST는 모든 염분에서 4℃일 때 가장 높았고, 특히 26 psu에서는 6℃, 8℃가 10℃보다 유의하게 높게 나타나(Fig. 2) 수온, 염분 및 수온 염분 상호작용에 영향을 받는 것으로 나타났다(Table 1).
ALT는 수온이 낮아질수록 증가하는 경향을 보였으나, 30 psu에서는 유의한 차이를 나타내지 않았으며(Fig. 2), 34 psu와 26 psu에서 는 4℃에서 가장 높게 나타나 수온에 영향을 받는 것으로 나타났다(Table 1).
2. 조직 내 FAA 함량 변화
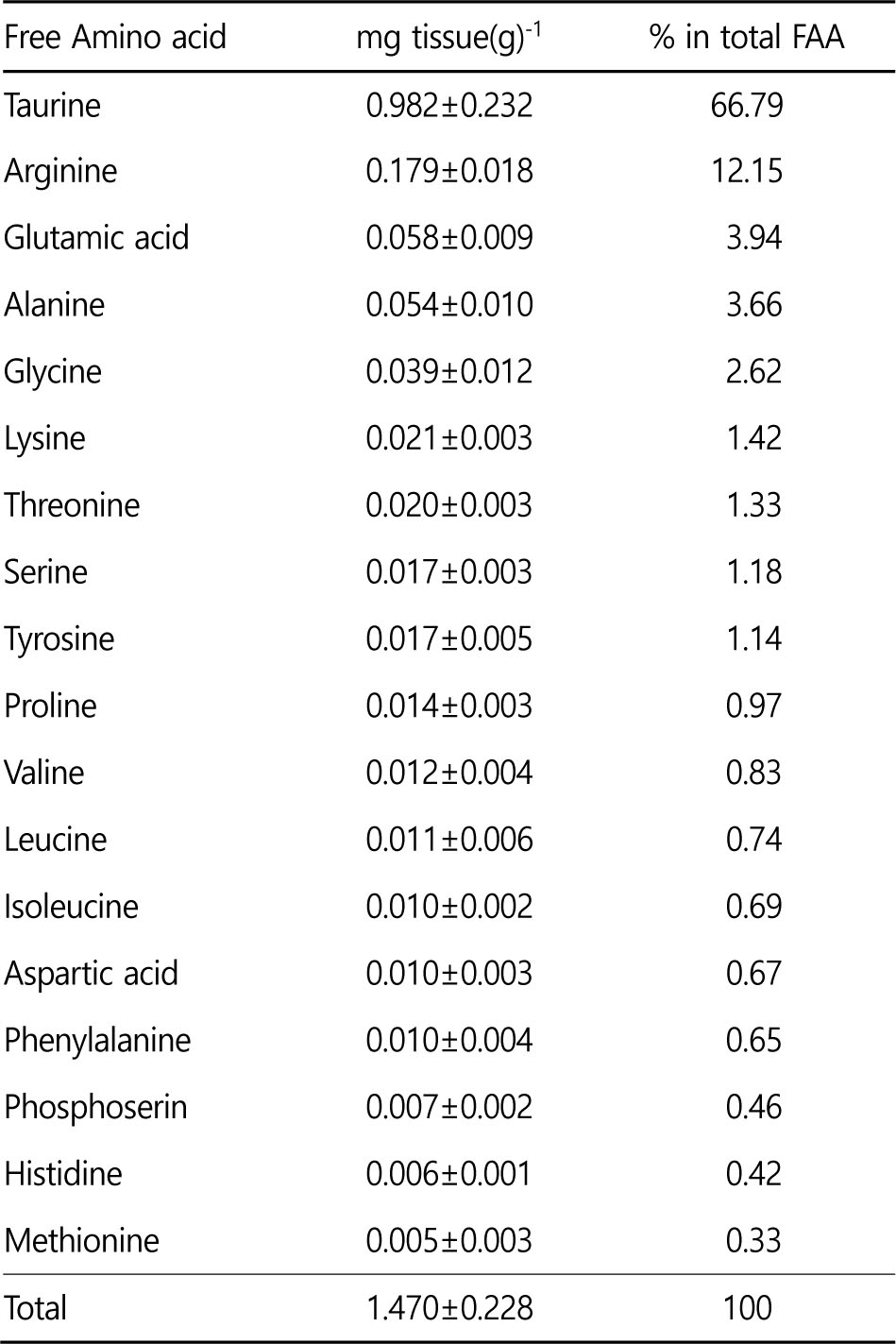
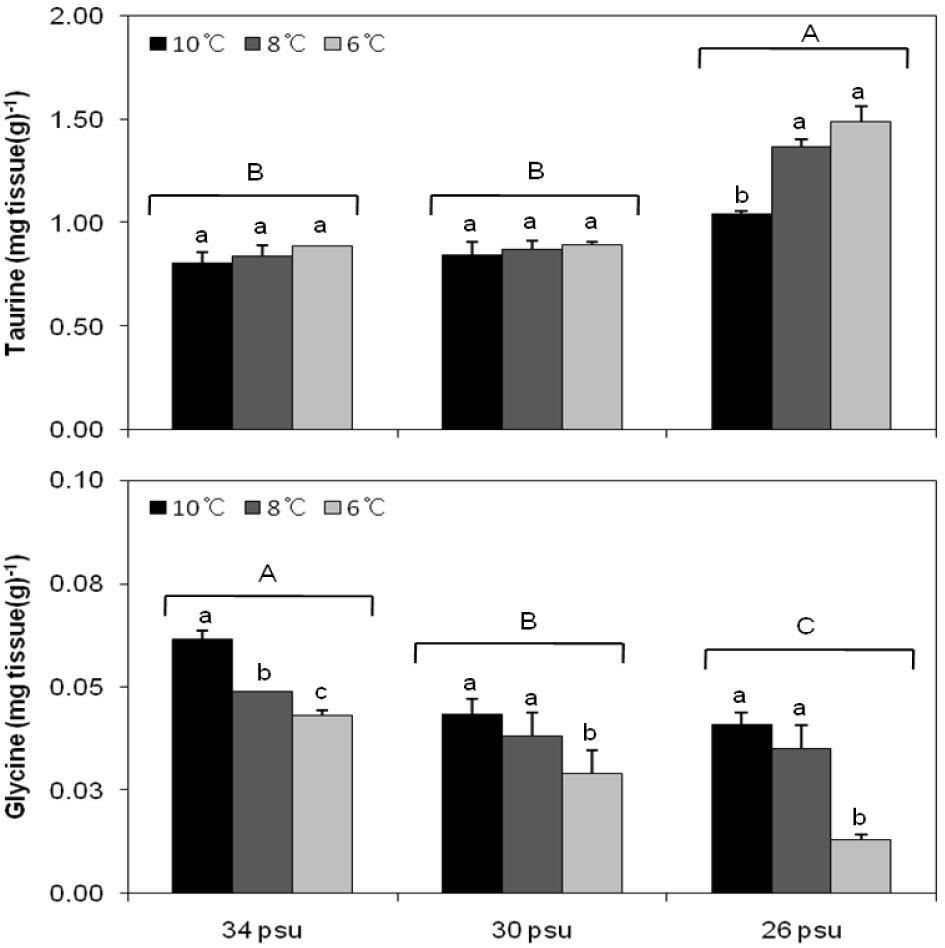
참전복 근육 내 FAA를 분석한 결과 총 18종이 존재하는 것으로 나타났으며, 전체 FAA 조성 중 taurine, arginine, glutamic acid, alanine, glycine, lysine이 90% 가량을 차지하여 주요 구성 성분으로 나타났고, 이 중 taurine이 66.8%로 가장 높은 조성을 보였다(Table 2).
Taurine은 30 psu 이상의 염분에서는 수온간 유의한 차이가 없었으나(Fig. 3), 26 psu에서는 6, 8℃에서 가장 높게 나타나 수온, 염분, 수온과 염분의 상호작용이 모두 영향을 미치는 것으로 나타났다(Table 3).
Glycine은 수온이 낮아질수록 유의하게 감소하여 6℃일 때 가장 낮게 나타났으며(Fig. 3), 26 psu/6℃일 때 0.013±0.001 mg tissue(g)-1로 가장 낮게 나타나 수온, 염분에 영향을 받는 것으로 나타났다(Table 3).
Aspartic acid, threonine, serine, glycine을 제외한 나머지 아미노산의 함량은 수온이 낮아질수록 증가하는 경향이 나타났다. Aspartic acid는 34 psu에서는 수온이 낮아질수록 함량이 낮아졌지만 그 이하의 염분에서는 증가하였으며, threonine과 serine은 실험구 간 유의한 차이가 나타나지 않았다. Phosphoserin, methionine, phenylalanine은 30 psu 이상에서는 수온이 감소할수록 함량이 유의하게 증가하였지만, 26 psu에서는 수온에 따른 유의한 차이가 나타나지 않았다. Aspartic acid, glutamic acid, arginine은 염분이 낮아질수록 함량이 유의하게 증가했지만, alanine, methionine, tryosine, histidine 은 염분이 낮아질수록 감소하였다(Data not shown).
고 찰
수온과 염분은 수서생물의 생활에 영향을 끼치는 주요한 원인으로 수온과 염분의 급변은 성장, 발달, 대사 등 여러 가지 생리적 활동에 영향을 미치며 스트레스로 작용할 경우 혈액성상 및 삼투조절능력등의 변화가 일어난다. Glucose, AST, ALT, NH3 등의 혈액성상은 건 강도와 관련이 있으며(Davis and Parker, 1990; Van et al., 1996), 또한 Souza and Scemes (2000)은 해양무척추동물은 스트레스를 받을 경우 그에 대한 생리적 반응으로 체내 유리아미노산 조성이 변하므로 유리아미노산은 스트레스 지표로 사용된다고 하였다.
해양생물은 수온과 염분의 급격한 변화를 포함한 여러 스트레스 요인으로부터 항상성을 유지하기 위해 에너지 사용한다(Vijayan et al., 1996). 패류의 경우에도 스트레스를 받을 시 항상성 유지를 위한 에너지 요구가 높아져 glucose 농도가 상승하게 되므로 스트레스 지표로 사용이 된다(Gustafon et al., 2005). 본 연구에서 실험종료 시 glucose 농도는 모든 염분에서 4℃에서 가장 높게 나타나 4℃ 이하에서는 참전복이 수온 스트레스를 많이 받는 것으로 판단된다. 또한 34 psu에서는 4℃를 제외한 나머지 수온 간 유의한 차이가 없는 것에 반해 30 psu 이하에서는 6℃에서도 유의한 증가가 나타나 저수온과 저염분이 복합적으로 작용할시 더 큰 스트레스를 유발하는 것으로 나타났다.

본 연구에서는 혈림프액의 NH3 농도가 모든 염분의 4℃에서 유의하게 높게 나타났는데 이는 간췌장의 기능이 스트레스로 인해 저하되어 NH3가 원활하게 배출되지 못하여 체내에 축적되는 것으로 보이며, 어류에서는 간이나 신장기능이 저하되면 암모니아 배출능력이 감소하여 혈중농도가 증가하게 된다고 보고된 바 있어 이를 뒷 받침해준다(Person-Le et al., 1995).
Value (means ± SD) in the same column mean not sharing a common superscript are significantly different (p <0.05)
아민기 전이효소의 일종인 AST와 ALT는 간 조직에 손상이 생길 시 혈중으로 유출되되어 농도가 상승하며, 패류에서는 혈림프액으로 유출되므로 간 기능을 반영하는 지표로 사용된다(Shich, 1978; Smith and Ramos 1980; Casillas et al., 1982). 본 연구에서 7일째 AST 농도는 6℃ 이하부터는 유의하게 증가하였고, 4℃에서 가장 높게 나타나 6℃ 이하의 수온은 적응하지 못하는 것으로 나타났으며, 염분이 낮아질수록 농도가 유의하게 증가하여 저수온과 저염분이 복합적으로 작용할 시 스트레스의 정도가 더욱 높아지는 것으로 나타났다. 또한 ALT도 수온이 낮아질수록 증가하는 경향이 나타났다. 계통분류상 거리는 있으나 피조개, Scapharca broughtonii 와 개량조개, Mactra chinensis에서도 수온과 염분 스트레스를 받았을 경우 혈림프액의 AST와 ALT 농도가 증가하는 것으로 보고되어 같은 경향을 나타내고 있다(An and Choi, 2010; Ryu, 2014).
FAA (Free Amino Acid)는 단백질 구성 성분이며 체내 에너지 대사경로의 기질과 에너지원의 역할을 한다(Hervé et al., 2007). 연체동물에서 taurine, glycine 등과 같은 FAA는 주변 환경과 스트레스에 따라 다르게 나타나므로 환경 변화에 따른 스트레스 지표로도 이용되어 왔다(Cook et al., 1972; Zurburg et al., 1989; Silva et al., 2005).
참전복에서는 총 18개의 FAA가 검출되었으며, 이 중 taurine (66.8%), arginine (12.2%), glutamic acid (3.9%), alanine (3.7%), glycine (2.6%)이 전체의 90% 가량을 차지하는 주요 구성 성분으로 나타났다. Hwang et al. (1997)은 오분자기, Haliotis diversicolor 의 FAA 주요성분이 taurine, arginine, glutamic acid, alanine, glycine이라고 보고하였고, New Zealand abalone, Haliotis iris의 경우 taurine과 glycine이 주요 구성아미노산이며, Haliotis tuberculata와 Hariotis discus는 taurine이 FAA pool에서의 우점 아미노산으로 나타나 참전복의 FAA 조성과 유사하게 나타났다.
이매패류의 경우 환경이나 중금속 같은 독성에 의한 스트레스를 받으면 taurine은 증가하고 glycine은 감소하므로 스트레스 지표로도 사용되며(Zurburg et al., 1989; Hummel et al., 1996), 구리에 오염된 대양 조개류인 Macoma balthica (Hummel et al., 1996), 15 psu의 저염분에 노출된 Pacific oyster (Hosoi et al., 2003), 또한 30 psu 이하와 40 psu 이상의 염분에 노출된 Haliotis discus discus의 경우 조직 내 taurine은 증가하고 glycine은 감소하는 것으로 나타났다(Yang et al., 2008). 본 연구에서 참전복의 조직 내 taurine 함량은 일반해수와 30 psu의 염분에서는 수온에 따른 유의한 차이가 없었으나, 26 psu의 염분에서는 8℃ 이하에서 유의하게 증가하였다. 또한 glycine 함량은 모든 염분구에서 수온이 낮아질수록 감소하여 6℃에서 가장 낮았으며, 염분별로 26 psu의 염분에서 가장 낮게 나타나, 실험구 중 6℃와 26 psu에서 스트레스를 가장 많이 받는 것으로 나타났다.
본 연구에서 30~34 psu, 8~10℃에서는 참전복의 혈림프 성상 및 FAA의 함량이 26 psu, 4~6℃에서보다 유의하게 낮은 것으로 나타났으며(단 glycine은 높았음), 또한 자연 조건에서 사육한 참전복의 분석 parameter와의 비교에서도 큰 차이를 보이지 않아(Table 4), 전복의 수송을 위한 적정 수온 및 염분 조건은 30~34 psu, 8~10℃인 것으로 사료된다.
사 사
본 연구는 국립수산과학원 수산과학연구사업(R2016017)의 지원에 의해 수행되었습니다.
- References
-
-
15. MOF. 2014. Development of the transport system of live fish for export. Ministry of Oceans and Fisheries, ROK, pp 1-157.
-
19. Ryu JH. 2014. Studies on physiological Activity of Adult shell, Egg Development and Larval Cryopreservation in Surf Clam Mactra chinensis for its Species Conservation. Master thesis, Pukyong National University, pp 1-70.
-
26. Wedemeyer GA. 1996. Physiology of intensive culture systems. Chapman and Hall, New york. pp 1-227.
-
29. Yoshikawa H, Ueno S, Mitsuda H. 1989. Short and long term coldanaesthesia in Carp. Nippon Suisan Gakkaishi 55: 491-498.














